プレスリリース STAT1遺伝子変異の病的意義を高精度に予測するツールとして、網羅的アラニンスキャンニングを用いた参照データベースを確立
プレスリリース
国立大学法人広島大学
かずさDNA研究所
国立研究開発法人日本医療研究開発機構
本研究成果のポイント
- 網羅的アラニンスキャニング(※1)により、STAT1遺伝子に存在するアミノ酸置換が持つ病的意義を高精度に予測できる、参照データベース作製に成功しました。
- STAT1(※2)のホモ二量体(※3)(antiparallel dimer)を不安定化させるアミノ酸変異はSTAT1の機能を促進させ、安定化させるアミノ酸変異は機能を低下させることを発見しました。
- 網羅的遺伝子解析手法で問題視されている『患者で同定される膨大な数のアミノ酸置換の質的評価』の解決法の一つとして、網羅的アラニンスキャニングによる参照データベース作製の有用性を示しました。
概要
STAT1は、インターフェロン-α/β, -γ(IFN-α/β, -γ)のシグナル伝達を行い、宿主の感染防御を担う分子です。STAT1遺伝子の機能が失われる変異(LOF変異)を持つ患者は、メンデル遺伝型マイコバクテリウム易感染症(MSMD:※4)を発症することが知られています。一方で、STAT1遺伝子の機能が亢進した変異(GOF変異)は、慢性皮膚粘膜カンジダ症(CMCD:※5)の原因となります。CMCDとMSMDは全く異なった原発性免疫不全症である一方で、両疾患は稀に類似した臨床症状を示すことがあります。そのため、患者で認めたSTAT1遺伝子変異の病的意義を判断するためには、個々の変異の機能解析が必要でした。
この度、国立研究開発法人日本医療研究開発機構(AMED)難治性疾患実用化研究事業のサポートを受け、小林正夫(広島大学大学院医歯薬保健学研究院統合健康科学部門小児科学教授)、岡田賢(同講師)、香川礼子(同大学院生)らの研究グループ、藤木亮次、小原收(かずさDNA研究所)及び、St. Giles Laboratory of Human Genetics of Infectious Diseases(ロックフェラー大学)の研究グループは、岐阜大学大学院医学系研究科小児病態学との共同研究により、STAT1 遺伝子変異の病的意義を予測するツールとして、STAT1遺伝子変異の参照データベースの作製に成功しました。作製した参照データベースは、既存の変異機能を予測するコンピューターアルゴリズム(MSC-CADD法:※6)と比較して、格段に精度が高い予測ツールであることが分かりました。さらに参照データベースの作製により、LOF変異とGOF変異に一定の法則性があることを発見し、遺伝子変異がSTAT1の機能異常を引き起こす原因を解明することに成功しました。
論文発表
共著者:Reiko Kagawa, Ryoji Fujiki, Miyuki Tsumura, Sonoko Sakata, Shiho Nishimura, Yuval Itan, Xiao-Fei Kong, Zenichiro Kato, Hidenori Ohnishi, Osamu Hirata, Satoshi Saito, Maiko Ikeda, Jamila El Baghdadi, Aziz Bousfiha, Kaori Fujiwara, Matias Oleastro, Judith Yancoski, Laura Perez, Silvia Danielian, Fatima Ailal, Hidetoshi Takada, Toshiro Hara, Puel Anne, PhD, Stéphanie Boisson-Dupuis, PhD, Jacinta Bustamante, Jean-Laurent Casanova, Osamu Ohara, Satoshi Okada*, Masao Kobayashi
*Corresponding Author(責任著者)
本研究成果は、2016年12月20日(火)午前7時(米国東部標準時間―日本時間午後9時)に、The Journal of Allergy and Clinical Immunologyで公開されます。
【DOI番号】10.1016/j.jaci.2016.09.035
背景
STAT1は、IFN-α/β, -γのシグナル伝達に必須の転写因子で、病原体に対する感染防御に重要な分子です。IFN-α/β, -γはウイルスの排除に、IFN-γは抗酸菌(結核菌など)の排除に重要であることから、STAT1の機能異常を持つ患者は様々な感染症を発症します。実臨床において、STAT1遺伝子のLOF変異を持つ患者はMSMDを発症します。一方で、STAT1遺伝子のGOF変異はCMCDの発症に関与します。過去の検討で、GOF変異はSTAT1のcoiled-coilドメイン(CCD)、DNA結合ドメイン(DBD)に集中して認められることが知られています(図1)。一方で、LOF変異はCCD、DBDを含むSTAT1の全長にわたって分布します。MSMDとCMCDは全く異なったタイプの原発性免疫不全症ですが、両疾患は稀に類似した臨床症状を示すことがあります。そのため、患者で認めたSTAT1遺伝子変異の病的意義を判断するためには、個々の変異の機能解析が必要でした。
このような問題点を解決するために、我々の研究グループはSTAT1のCCDとDBD(CCD/DBD)にアラニン置換体を網羅的に作製し、個々の機能解析を行うことでSTAT1遺伝子変異の参照データベースを確立し、その評価を行いました。
研究成果の内容
STAT1のCCD/DBD に合計342のアラニン置換体を作製し、個々のアラニン置換体に対してIFN-γ刺激に伴う転写活性化能の測定を行いました。その結果111のアラニン置換体がGOF変異、30のアラニン置換体がLOF変異と判断されました。過去にSTAT1遺伝子のCCD/DBDには4つのLOF変異、74のGOF変異が認められていたため、アラニン置換体により、それらの既知変異が正確に評価できているか検討しました。その結果、既知のLOF変異との一致率は100%、GOF変異との一致率は78.1%という良好な結果が得られました。さらに、CCD/DBDに存在する39の正常多型(variants)を対象にして、アラニン置換体が正確に機能を評価できているか検討したところ、71.1%という高い一致率が得られました。これらの結果は、アミノ酸置換の機能変化を予測する既存のコンピューターアルゴリズムであるMSC-CADD法と比較しても、格段に精度が高い一致率と考えられました。
STAT1は通常状態で二量体(antiparallel dimer)を形成しており、IFN-γ刺激により活性化された二量体(parallel dimer)に構造変化することが知られています。網羅的アラニンスキャニングで得られた結果を、antiparallel dimer、parallel dimerに反映させた結果、一定の法則性が認められました。図2に示すように、GOF変異はantiparallel dimerにおける二分子間接合面に集中していました。一方で、LOF変異はparallel dimerにおけるDNA結合部位に多く認められました。これらの結果から、GOF変異は不活性型であるantiparallel dimerの形成を障害することで機能亢進にいたることが分かりました。さらに、antiparallel dimerの二分子間接合面に存在する特殊なLOF変異(E157K変異)を持つMSMD家系例を同定し、E157K変異がantiparallel dimerを安定化させ、その結果としてLOF変異になることを証明しました。一連の結果から、antiparallel dimerを安定化させる変異はLOF変異、不安定化させる変異はGOF変異になることが分かりました(図3)。
今後の展開
用語説明
- ※1:アラニンスキャニング
- タンパク質の構成成分であるアミノ酸を、1つずつアラニンに置換してその機能を評価する手法。タンパク質を構成する各アミノ酸残基の役割を検討する手法として使われる
- ※2:STAT1
- シグナル伝達兼転写活性因子。IFN-α/β, -γなどのシグナル伝達を介在するとともに、転写活性化により遺伝子発現をうながす役割を持つ分子
- ※3:ホモ二量体
- 同一のサブユニットが二量化したもの。本研究報告においては、2つのSTAT1分子が二量化したものを示す
- ※4:メンデル遺伝型マイコバクテリア易感染症(MSMD)
- BCG、非結核性抗酸菌、サルモネラなどの細胞内寄生菌に対し、選択的に易感染性を示す原発性免疫不全症。MSMD患者の一部(約4%)においてSTAT1のLOF変異が同定されることが知られており、現在までに少なくとも18家系45症例が報告されている
- ※5:慢性皮膚粘膜カンジダ症(CMCD)
- 皮膚、爪、口腔粘膜、外陰部などの粘膜病変を中心に、慢性・反復性にカンジダ感染を発症する原発性免疫不全症。CMCD患者の約半数で、STAT1のGOF変異が認められることが知られており、現在までに300例を超える患者が報告されている
- ※6:MSC-CADD法
- CADDは、コンピューターを用いて塩基置換が分子構造に及ぼす影響を推測する、遺伝子多型の機能予測ツール。MSCは、CADDのcut off値(機能障害と予測する水準を決定する値)を遺伝子毎に設定し、CADDの正確性を高める手法(Itan Y, et al. Nat Methods 13: 109-10, 2016)
参考図
図1
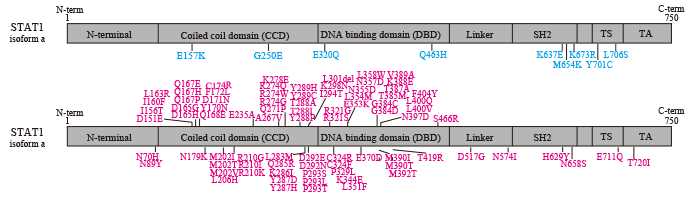 既知のSTAT1遺伝子変異
既知のSTAT1遺伝子変異
上段:LOF変異(薄青)、下段:GOF変異(マゼンダ)
GOF変異はSTAT1のCCD/DBDに集中して認められる
図2
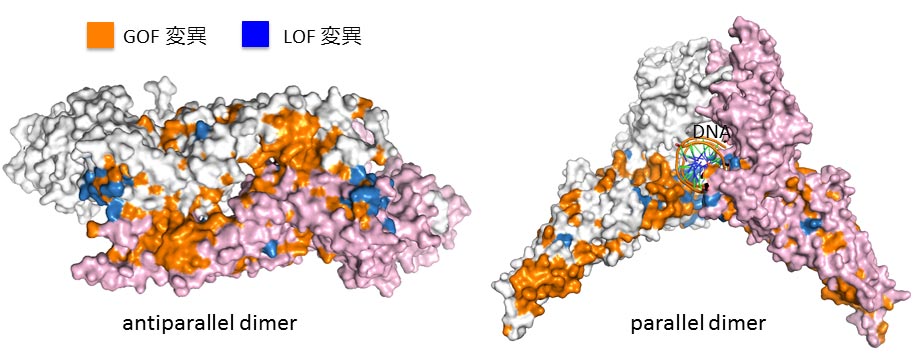 STAT1遺伝子のGOF変異(オレンジ)は、antiparallel dimerの二分子間接合面(白とピンクで示されたSTAT1の接合部位)に集中して認められる。一方で、LOF変異(青)は、parallel dimerのDNA結合部位に多く認められる。
STAT1遺伝子のGOF変異(オレンジ)は、antiparallel dimerの二分子間接合面(白とピンクで示されたSTAT1の接合部位)に集中して認められる。一方で、LOF変異(青)は、parallel dimerのDNA結合部位に多く認められる。
図3
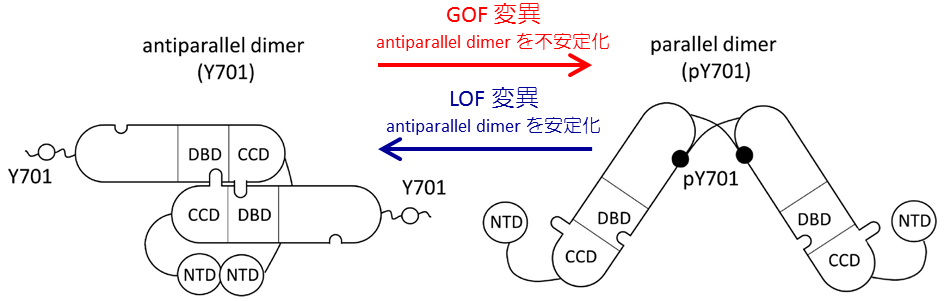 STAT1はIFN-γ刺激によりTyr701(Y701)の部位がリン酸化を受け活性化され、不活性型であるantiparallel dimerから活性型であるparallel dimerに構造変化する。今回の研究成果で、antiparallel dimerを不安定化するアミノ酸置換はGOF変異、安定化させるアミノ酸置換はLOF変異になることを発見した。
STAT1はIFN-γ刺激によりTyr701(Y701)の部位がリン酸化を受け活性化され、不活性型であるantiparallel dimerから活性型であるparallel dimerに構造変化する。今回の研究成果で、antiparallel dimerを不安定化するアミノ酸置換はGOF変異、安定化させるアミノ酸置換はLOF変異になることを発見した。
お問い合わせ先
内容に関するお問い合わせ
講師 岡田 賢、 教授 小林正夫
TEL:082-257−5212 FAX:082-257-5214
E-mail:sokada“AT”hiroshima-u.ac.jp(岡田)
かずさDNA研究所
特任研究員 藤木 亮次、 副所長 小原 收
TEL:0438-52-3913 FAX:0438-52-3914
E-mail:ohara“AT”kazusa.or.jp(小原)
AMED事業に関するお問い合わせ
日本医療研究開発機構 戦略推進部 難病研究課
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2223 FAX:03-6870-2243
E-mail: nambyo-info“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 平成28年12月20日
最終更新日 平成28年12月20日


