プレスリリース ビタミンDが体内の脂質量を抑制 メタボや癌の予防に期待
プレスリリース
京都大学 物質-細胞統合システム拠点
国立研究開発法人日本医療研究開発機構
京都大学(総長:山極壽一)物質-細胞統合システム拠点(iCeMS=アイセムス)の上杉志成(うえすぎ・もとなり)副拠点長・教授、大学院医学研究科 浅野理沙(あさの・りさ)博士課程学生らは、生体内に存在するビタミンDが、脂質生合成を抑制することを発見しました。
生物は脂質の量を様々な方法で調節しており、脂質調節に異常があると、メタボリックシンドロームや癌などの疾患を引き起こします。本研究では脂質生合成の指令塔である転写因子(*1) SREBP(*2)(Sterol Regulatory Element-binding Protein)に着目し、ビタミンD代謝物がSREBPの活性を調節していることを新たに発見しました。そのメカニズム解析を進めたところ、ビタミンDがSREBPの働きをこれまで知られていなかった方法で抑えていることが分かりました。
ビタミンDについてはこれまで、疫学的な報告により、メタボリックシンドロームや癌などの疾患の予防に効果があることが分かっていましたが、そのメカニズムについては不明なままでした。しかし、今回の生化学的なアプローチにより、脂質代謝とビタミンDとの関係が、分子レベルで明らかになってきました。
ビタミンD代謝物は生体内に元々存在する(=内因性である)ため、安全性が高く、今後、メタボリックシンドロームや癌の予防に効果のある人工ビタミンDの作成などに応用されることが期待されます。
本成果は米国東部時間2017年1月26日正午(日本時間27日 午前2時)に、米科学誌「Cell Chemical Biology」で公開される予定です。
背景
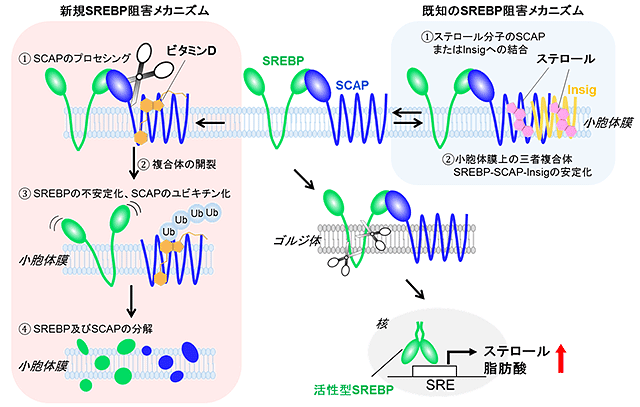
脂質代謝の中心的調節因子であるSREBPは、結合タンパク質SCAP(*3)(SREBP Cleavage-activating Protein)と安定な複合体を形成し、小胞体膜上に存在しています。脂質やステロールレベルが低いとき、SREBPはSCAPの働きによって小胞体膜からゴルジ体へと移行し、そこでプロテアーゼによるプロセシングを受けて活性型となります。その後核内で転写因子として働き、脂質やステロールの生合成に関与する遺伝子を活性化します。一方、生合成産物の一種であるコレステロールやオキシステロールは、直接SCAP、及び別の小胞体膜タンパク質Insigに作用し、SREBP-SCAP-Insig三者複合体の形成を促し、SCAPのゴルジ体への移行ステップを抑制します。すなわちSREBPの活性化は、ステロールによるネガティブフィードバック機構によって制御を受けています。しかし、SREBPは生体内で複雑な制御を受けているため、その全貌は明らかではなく、さまざまな疾患への関与も知られています。例えば、ガン細胞や脂質疾患などにおいては、このネガティブフィードバックによるSREBP制御機構が正常に機能していないと考えられています。
このような背景から、SREBPの複雑な生体内制御機構の理解及び制御を目的として、新規内因性SREBP阻害物質の探索を行いました。
研究内容と成果
そこで次にSCAPに着目して詳細を解析しました。その結果、ビタミンD依存的にSCAPがポリユビキチン化されていることが確認でき、ユビキチン・プロテアソーム系によってSCAPが分解されていることが確かめられました。更に詳細な解析を進めることで、SCAPのユビキチン化に先立って、プロテアーゼによるSCAPのプロセシングが起きていることが明らかとなり、このプロセシングがSCAPのユビキチン化及び分解の引き金になっていると考えられました。
そこでSCAPのプロセシングの意味を確かめるために、大まかなプロセシングサイトの同定を行い、その情報をもとに、ビタミンD存在下でもプロセシングを受けないビタミンD耐性のSCAP変異体を作成しました。その結果、期待通り、ビタミンD耐性の変異体SCAP発現細胞においてのみ、SCAPの分解が止まり、更にはSREBPの活性の回復も見られ、SCAPのプロセシングの重要性が明らかになりました。
最後にビタミンDのターゲットを検討するために、ビオチン及び光反応基をもつビタミンDプローブを作成しました。細胞のライセートに対してプローブ処理を行った後、UV照射することでプローブと結合タンパク質とをクロスリンクさせ、アビジンビーズを用いて精製した結果、SCAPのプローブ依存的な結合が見られました。つまり、ビタミンDがSCAPに直接作用して、プロセシングを誘発している可能性が考えられました。
以上の知見から次のようなSREBPの不活性化メカニズムが明らかになりました。『ビタミンDの作用により、SREBPの結合パートナーであるSCAPがプロテアーゼによるプロセシングを受け、SCAP-SREBP複合体が壊れる。その後SCAPはユビキチン・プロテアソーム系による分解を受け、それに伴い結合パートナーを失って不安定化したSREBPも分解する。これによりSREBPの活性化が抑えられている。』
今後の展開
今回見つけた三種類の水酸化ビタミンDの中で、特に25-Hydroxyvtiamin D (25OHD)が最も高いSREBP阻害活性を示します。この25OHDは、腎臓でCyp27b1による代謝を受けて1α,25-dihydroxyvitamin D (1,25(OH)2D) に変換されることが知られています。1,25(OH)2DはVitamin D receptor (VDR) の強力なアゴニストであるため、25OHDをSREBPの活性抑制目的で用いた場合、VDRを介した作用の影響が過剰に出てしまうおそれがあります。そこで現在、今後の治療薬展開やツール開発を視野に入れ、VDR活性化能を持たずにSREBPの活性抑制のみを示す誘導体の探索を行っています。より選択性の高いSREBP阻害分子を合成することは、脂質代謝疾患の解明、及び治療に対する新たなアプローチを見出すことにつながると期待できます。
なお、本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出」研究開発領域(研究開発総括:清水孝雄)における研究開発課題「ケミカルバイオロジーによる脂質内因性分子の新機能研究」(研究開発代表者:上杉 志成)の一環で行われました。なお、本研究開発領域は、平成27年4月の日本医療研究開発機構の発足に伴い、国立研究開発法人科学技術振興機構(JST)より移管されたものです。
用語解説
- (*1)転写因子:
- DNA上の特定の塩基配列に結合し、DNAからRNAへの転写の過程を促進または抑制する働きを持ったタンパク質の一群
- (*2)SREBP:
- 細胞の中の小胞体膜上に局在する膜タンパク質の一種。脂肪酸、トリグリセリド、コレステロールの生合成を制御する転写因子として働く。
- (*3)SCAP:
- ステロール量を感知するセンサーとして働く膜タンパク質の一種。SCAPとSREBPの結合が、小胞体膜状のSREBPの安定な存在に必須であることが知られている。
論文タイトル・著者
(参考訳:ビタミンD代謝物25-ヒドロキシビタミンDはSREBP/SCAPを分解することで脂質代謝を制御する)
著者全員の名前:
浅野理沙、渡邉瑞貴、領田優太、薄田晃祐、 山口卓也、Bilon Khambu、高嶋恵美、佐藤慎一、酒井寿郎、長澤和夫、上杉志成
掲載誌:Cell Chemical Biology
iCeMSについて
詳しくはウェブサイトをご覧下さい。
世界トップレベル研究拠点プログラム(WPI)について
詳しくはウェブサイトをご覧下さい。
問い合わせ先
研究内容に関すること
上杉 志成(ウエスギ モトナリ)
京都大学 物質-細胞統合システム拠点(iCeMS)副拠点長・教授
Tel:0774-38-3225|Fax:0774-38-3226|Eメール:uesugi"AT"scl.kyoto-u.ac.jp
京都大学iCeMSに関すること
髙宮 泉水(タカミヤ イズミ)
京都大学 高等研究院等事務部 国際企画・広報掛
Tel:075-753-9755|Eメール:ias-oappr"AT"mail2.adm.kyoto-u.ac.jp
AMEDに関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 研究企画課
Tel:03-6870-2224|Fax:03-6870-2243|Eメール:kenkyuk-ask"AT"amed.go.jp
※Eメールは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成29年1月27日
最終更新日 平成29年1月27日


