プレスリリース 患者さん由来iPS細胞を用いて、筋強直性ジストロフィーの病因である遺伝子変化を詳細に解析
プレスリリース
国立大学法人京都大学
国立研究開発法人日本医療研究開発機構
ポイント
- 筋強直性ジストロフィーの病因であるCTG繰り返し配列(注1)が伸長するという現象を、患者さん由来iPS細胞で再現した。
- CTG繰り返し配列の伸長は、未分化iPS細胞を継代培養する過程で主に認められ、神経、心筋、骨格筋への分化の過程では、それほど認められなかった。
- CTG繰り返し配列付近のクロマチン(注2)構造が、健常者と比較して変化していることが明らかになった。
1.要旨
植木絢子元大学院生(現京都大学医学部附属病院 糖尿病・内分泌・栄養内科 医員)、櫻井英俊准教授(京都大学CiRA臨床応用研究部門)らの研究グループは、大阪大学医学部神経内科学講座の中森雅之講師らの研究グループとともに、筋強直性ジストロフィー1型(DM1)患者さんから作製したiPS細胞を用いて、この疾患の病因であるCTG繰り返し配列(CTGリピート)の伸長という現象を再現することに成功しました。DM1は、DMPK(DM protein kinase)という遺伝子にあるCTGリピートが数百~数千リピートにまで伸長してしまうために発症しますが、どうやってCTGリピートが伸長するかはいまだ解明されていません。
本研究では、DM1患者さんからiPS細胞を作成し、CTGリピートの伸長という病的な現象を解析することを目指しました。DM1患者さん由来iPS細胞では、培養を続けることでCTGリピートが伸長することが明らかとなりました。しかしiPS細胞から、神経、心筋、骨格筋といった組織に分化させたときには、それほどCTGリピートが伸長しないことが分かりました。さらにはDM1患者さん由来iPS細胞を心筋細胞に分化誘導した際、健常者由来の心筋細胞と比較して、CTGリピート付近のクロマチン構造が変化していることも発見しました。現段階では、この変化がCTGリピート伸長の原因であるのか結果であるのかは不明ではありますが、今後、DM1患者さん由来iPS細胞を用いて研究を進めることで、CTGリピート伸長のメカニズムが解明されれば、CTGリピート伸長抑制や、CTGリピート短縮という新規治療法開発に役立つと期待されます。
この研究成果は2017年2月13日午前10時(英国時間)に英科学誌「Scientific Reports」で公開されました。
2.研究の背景
DM1は常染色体優性遺伝形式をとる比較的患者数の多い筋ジストロフィーのタイプで、DMPK遺伝子の非翻訳領域にあるCTGリピートが、健常者では50リピート程度までのところが数百~数千リピートにまで伸長してしまうために発症します。DMPK遺伝子は全身で発現するため、筋ジストロフィーの症状だけではなく、白内障、不整脈、神経障害、糖尿病といった全身での症状が現れます。伸長したCTGリピートが、様々な遺伝子のスプライシング(注3)異常を引き起こし症状が出ますが、どうやってCTGリピートが伸長するかはいまだ解明されていません。
DM1患者さんからの血液や生検サンプルなどを用いた研究で、年齢を経るごとにCTGリピートが伸長すること、組織ごとに異なったCTGリピート数を呈することが明らかとなっていますが、生検組織を使った研究では、どうやってCTGリピートが伸長するかを解明することは困難でした。そこで我々はDM1患者さんから作製したiPS細胞を用いて、このリピート伸長という病的な状態を解析しました。
3.研究結果
1.実験デザイン
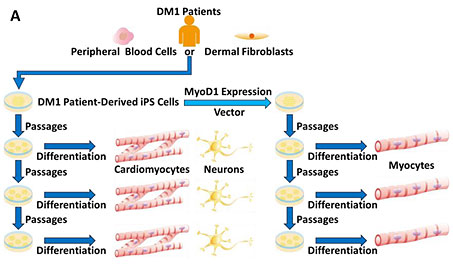 Fig.1 実験デザインのイメージ
Fig.1 実験デザインのイメージ
2.未分化iPS細胞の継代培養でリピート数の増加が顕著に認められた
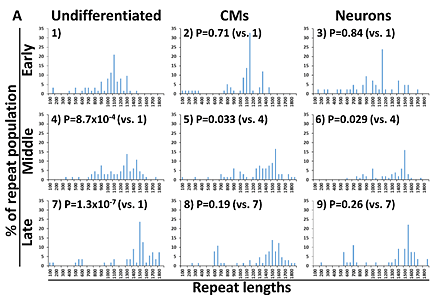
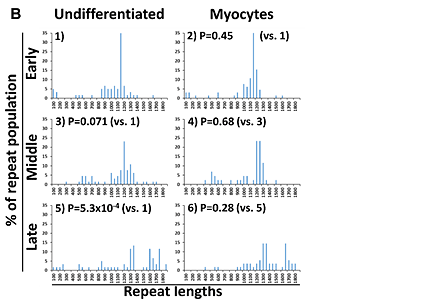 Fig.2 CTGリピート数解析の結果
Fig.2 CTGリピート数解析の結果
横軸はリピート数、縦軸はサンプル全体の中でその長さのDNAが認められた割合を表している。
- 未分化状態(Undifferentiated)で10継代経過ごとの様子を表した左列の1),4).7)を見ると、ピークを示すリピート数が右にシフトしているのが分かる。一方、未分化状態から心筋細胞(CMs)や神経細胞(Neurons)に分化させた場合は、それほどピークを示すリピート数が変わらないことも分かる。
- 骨格筋細胞分化のため、MyoD1遺伝子を導入後のiPS細胞の解析結果。未分化状態(Undifferentiated)では、最も継代培養の進んだLateの時期でリピート数が増大している。一方、未分化状態から骨格筋細胞(Myocytes)に分化させた場合には、有意なリピート数の増大は認めなかった。
3.DMPK遺伝子のCTGリピート付近のクロマチン状態がDM1患者では閉じている。
最後に、このCTGリピート伸長が起こるメカニズムに関して、エピゲノム解析を実施しました。ATAC-seqと呼ばれるクロマチン構造を解析する手法を用いました。この方法は生きている細胞がないと実施できないため、患者さんの生検サンプルで行うことは困難であり、iPS細胞を用いる利点の一つでもあります。Fig.3の「(CTG)n」と記載のある部分がCTGリピート部です。健常コントロールのiPS細胞由来心筋細胞では、CTGリピート付近に赤で示されるクロマチン構造が開いているバーが高く出ているのが見えますが、DM1患者さん由来の心筋細胞ではバーの山が低く、クロマチン構造が閉じていることが分かりました。
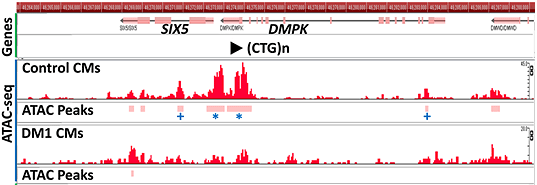 Fig. 3 ATAC-seqによるクロマチン構造の解析
Fig. 3 ATAC-seqによるクロマチン構造の解析
ATAC-seqと記載の列において、赤いバーが高いほどクロマチン構造が開いていることを示す。*印は健常コントロールとの比較で、DM1患者さん由来心筋細胞で極めて有意にクロマチン構造が閉じていた部分(p<10-5)、+印は有意にクロマチン構造が閉じていた部分(p<0.01)。
4.まとめ
本研究により、DM1患者さん由来iPS細胞はCTGリピートの伸長というDM1の病因を解析するのに非常に適したツールであることが示されました。今回報告したクロマチン構造の変化はこれまでに報告はなく、現段階ではこの変化がCTGリピート伸長の原因であるのか結果であるのかは不明です。今後は、CTGリピートが伸長するメカニズムに迫ります。こうした知見の積み重ねにより、CTGリピートの伸長を抑えるような治療法の開発や、さらにはCTGリピートを短くするような手法の開発につながることが期待されます。
5.論文名と著者
- 論文名
- Myotonic dystrophy type 1 patient-derived iPSCs for the investigation of CTG repeat instability
- ジャーナル名
- Scientific Reports
- 著者
- Junko Ueki1, 2, Masayuki Nakamori3*, Masahiro Nakamura1, Misato Nishikawa1, Yoshinori Yoshida1, Azusa Tanaka1, Asuka Morizane1, Masayoshi Kamon4, Toshiyuki Araki4, Masanori P. Takahashi3, Akira Watanabe1, Nobuya Inagaki2 and Hidetoshi Sakurai1*
- 著者の所属機関
-
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院医学研究科
- 大阪大学大学院医学系研究科
- 国立精神・神経医療研究センター
*責任著者
6.本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- AMED 再生医療実現拠点ネットワークプログラム「疾患特異的iPS細胞を活用した難病研究」
- AMED 再生医療実現拠点ネットワークプログラム「iPS細胞研究中核拠点」
- JSPS 科研費
- 厚生労働省 難治性疾患政策研究事業
- 国立精神・神経医療研究センター「精神・神経疾患研究開発費(24-9、27-7)」
7.用語説明
- (注1)CTG繰り返し配列
- 遺伝子はDNAの塩基(ATGC)配列で記載できる。CTGという順番でならんだ3塩基が何度も何度も繰り返されている状態。
- (注2)クロマチン
- 細胞内に存在するDNAとタンパク質の複合体のこと。ヒトの細胞1つの内に含まれているDNAは伸ばすとおよそ2mに達するため、通常はタンパク質に巻き取られた状態で存在している。使用する部分のみが開いて遺伝子が働いている。
- (注3)スプライシング
- 一般的な真核生物のDNAから転写されたmRNA前駆体には、イントロンと呼ばれる直接タンパク質のアミノ酸配列に関わらない領域が在る。このイントロンを除き、残ったエクソンと呼ばれる領域からなるmRNAが作られる過程をスプライシングという。スプライシングを受けたmRNAの情報をもとにタンパク質が合成される。
- (注4)Small pool PCR
- Small pool PCR法で1つの容器に2~3ゲノムだけが含まれるように希釈した上でPCRを行うため、各ゲノムのCTGリピート数を調べることが出来る。従来の単純なPCR法ではCTGリピート数の最も存在確率の高い長さのみが増幅されてしまい、CTGリピート数のばらつきまでは解析できない。
お問い合わせ先
内容に関するお問い合わせ
国立大学法人京都大学
iPS細胞研究所 国際広報室
〒606-8507 京都府京都市左京区聖護院河原町53
TEL:075-366-7005
FAX:075-366-7185
E-mail:media“AT”cira.kyoto-u.ac.jp
AMED事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課
〒100-0004 東京都千代田区大手町一丁目7番1号
TEL:03-6870-2220
FAX:03-6870-2242
E-mail:saisei“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成29年2月13日
最終更新日 平成29年2月13日


