プレスリリース がんの原因となる遺伝子変異が発症を引き起こす動的分子メカニズムを解明
プレスリリース
国立大学法人東京大学
次世代天然物化学技術研究組合
国立研究開発法人日本医療研究開発機構
がんは、その遺伝子に変異が生じてタンパク質の機能が異常になり発症する疾患で、その治療には異常となったタンパク質と正常なタンパク質との構造の違いを見分ける分子標的薬が使用されます。しかし、多くのがんの原因となるGタンパク質に起きる変異は、従来の方法では構造の違いを見いだすことはできませんでした。
次世代天然物化学技術研究組合及び東京大学大学院薬学系研究科嶋田一夫のグループは、動的構造変化を精度よく検出することができるNMR測定法「多量子緩和解析法」を開発し、がん発症の原因となる変異Gタンパク質が正常なGタンパク質と動的構造が異なっていることを明らかにしました。これにより静的な立体構造に違いを見いだせない創薬標的タンパク質においても、動的構造の変化を標的部位することにより薬剤設計が可能になり、医薬品開発が加速されることが期待されます。
研究開発のポイント
- NMRシグナルの単純な比較だけでは捉えることが困難な構造平衡を精度よく検出するため、新たなNMR測定法「多量子緩和解析法」を開発した。
-
発がん性変異体Gタンパク質では構造平衡が亢進し、リガンドがない条件下でも活性化した状態へ移行するため、がん化が引き起こされることを明らかにした。
- この構造平衡は、生体内においてGタンパク質の活性化を抑制するRGSタンパク質の模倣ペプチドにより抑制されることを明らかにした。
-
動的構造に着目することで、従来薬剤設計が困難だった分子標的についても創薬アプローチが可能になり、新たな医薬品開発が加速されると期待される。
研究概要
本研究ではまず、構造平衡を精度よく検出するための新たなNMR測定法「多量子緩和解析法」を開発しました。本解析法を用いることにより、複数の構造を取り得る部位をタンパク質のNMRシグナルの緩和速度の増大から同定することが可能となります。この手法を用いて、正常なGタンパク質と発がん性変異体の緩和速度をそれぞれ測定し、構造平衡の状態を比較しました。
その結果、発がん性変異体ではβ1ストランドと呼ばれるグアニンヌクレオチド結合部位近傍の構造平衡が顕著に亢進し、複数の構造を取っていることが明らかになりました(図3)。さらに、生体内においてGタンパク質の活性化を抑制するRGSタンパク質を模倣したペプチドを結合させると、β1ストランドの構造平衡が抑制されていることが確認されました。以上の結果は、Gタンパク質の活性化には構造平衡の存在が重要な役割を果たしており、発がん性変異体では構造平衡が亢進し、正常なタンパク質よりも活性化した状態へ移行しやすくなることで、がん化が引き起こされることを示しています。
本成果は、タンパク質に内在する構造平衡が機能と密接に関連していることを具体的に解析する手段を提供するものであり、他の生理的に重要なタンパク質の機能解明への応用が期待されます。また、静的な立体構造の違いだけでは活性の違いを説明できない創薬標的タンパク質においても、構造平衡状態の変化を指標とした化合物の評価、ならびに構造平衡が存在する部位を標的部位とした薬剤設計が可能になることにより、医薬品開発が加速されることが期待されます。
注釈
- 1)Gタンパク質
- グアニンヌクレオチド結合タンパク質 (Gタンパク質) は、細胞膜上に存在する受容体タンパク質と共役し、細胞外からの刺激(リガンド分子の受容体への結合刺激)を細胞内に伝える役割をもつタンパク質。生命活動に必須な多様な生理応答を担っている。
図
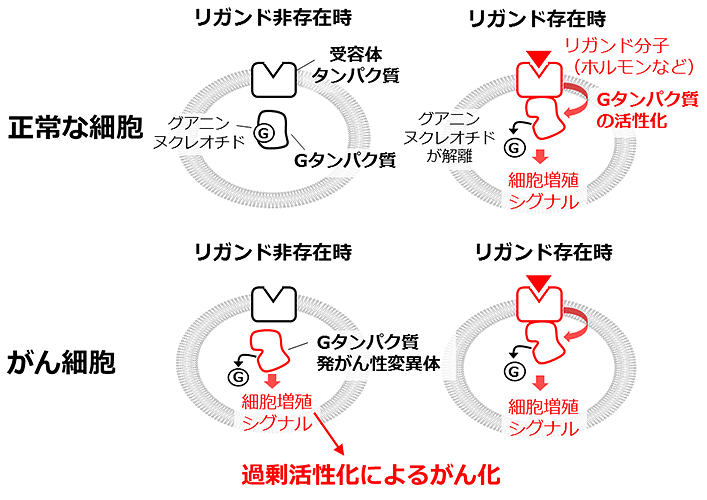
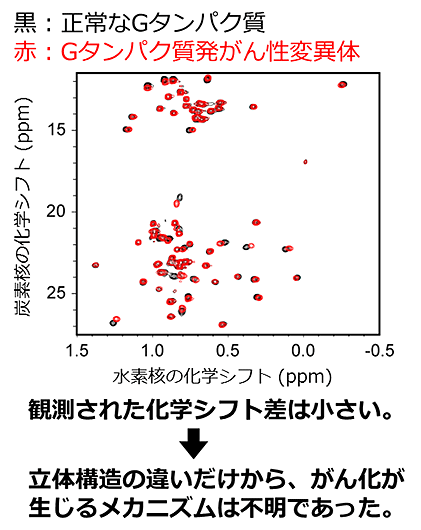 図2.正常なGタンパク質と発がん性変異体のNMRスペクトルの比較。
図2.正常なGタンパク質と発がん性変異体のNMRスペクトルの比較。
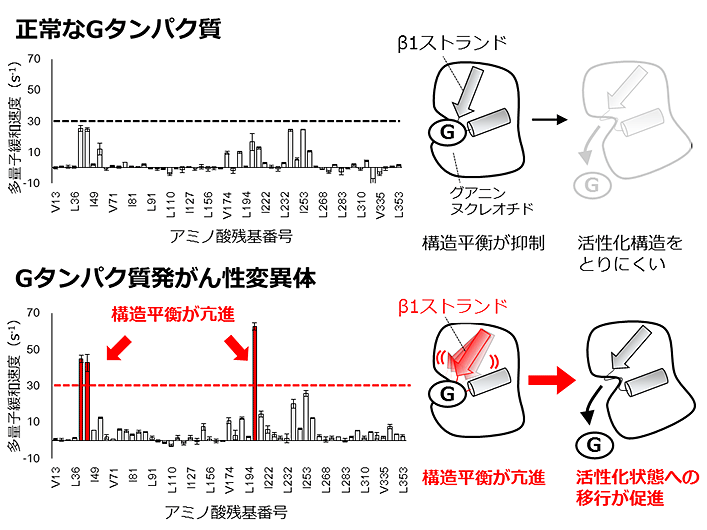
図3.正常なGタンパク質と、Gタンパク質の発がん性変異体の多量子緩和速度の大きさを比較したプロット、ならびに構造平衡が亢進することで活性化が促進することを示す模式図。
特記事項
※この研究は、日本医療研究開発機構(AMED)次世代治療・診断実現のための創薬基盤技術開発事業「天然化合物及びITを活用した革新的医薬品創出技術」、経済産業省の研究補助金によって行われました。
お問い合わせ先
本資料の内容に関するお問い合わせ先
教授 嶋田 一夫(しまだ いちお)
Tel:03-5841-4810 Fax:03-5841-4818
E-mail:shimada“AT”iw-nmr.f.u-tokyo.ac.jp
取材対応窓口、資料請求など
東京大学 大学院薬学系研究科 薬科学専攻
教授 嶋田 一夫(しまだ いちお)
Tel:03-5841-4810 Fax:03-5841-4818
E-mail:shimada“AT”iw-nmr.f.u-tokyo.ac.jp
事業に関するお問い合わせ
日本医療研究開発機構 戦略推進部 医薬品研究課
〒100-0004 東京都千代田区大手町1-7-1
Tel:03-6870-2219 Fax:03-6870-2244
E-mail: jisedai-med“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成29年2月22日
最終更新日 平成29年2月22日


