プレスリリース 免疫細胞を若返らせ、強い抗腫瘍効果をもつ細胞の作製に成功―がん免疫療法における新たな細胞移入療法の開発―
プレスリリース
慶應義塾大学医学部
国立研究開発法人日本医療研究開発機構
慶應義塾大学医学部の吉村昭彦教授らと武田薬品工業のグループは、AMED革新的先端研究開発支援事業の一環として、疲弊した免疫細胞(T細胞)を若返らせ再活性化する技術を開発し、より効果的ながん治療へ応用することに成功しました。
細胞移入療法(注1)は、がん患者の腫瘍組織などから分離したがんに特異的なT細胞を試験管内で大量に培養し、患者へ再び戻す療法です。しかしながら、がん組織に集積しているT細胞の多くは何度も刺激を受けることで疲弊状態に陥っています(注2)。また、長期間培養することでも疲弊状態になります。このような疲弊状態に陥ったT細胞を患者体内に戻しても、がん細胞を攻撃する力が弱く、十分な治療効果を得ることが出来ないという問題を抱えていました。
研究グループはがん特異的なT細胞にNotchと呼ばれる、ある特殊な刺激を入れることで、疲弊状態に陥ったT細胞を若返った状態、すなわち抗原にさらされて活性化される前の未感作に近い状態へと転換できることを見出しました。この細胞は幹細胞とメモリー(記憶)細胞の両方の性質を持ち、再度の刺激によって急速に増殖し、かつ長期生存が可能でした。また、ヒトT細胞からも作成することができ、強い抗腫瘍効果を発揮することを確認しました。研究グループは、この細胞を「誘導性ステムセルメモリーT細胞(iTSCM)」と命名しました。
今回の成果は、遺伝子導入技術を用いずに、がんに特異的に反応するT細胞を増やすことを可能にするもので、早期にがん治療へ応用できることが期待されます。また免疫細胞に限らず一般的な細胞の「若返り」の方法の開発とメカニズムの解明につながることも期待されます。
本研究成果は2017年5月22日(英国時間)に英科学雑誌「Nature Communications」のオンライン速報版に公開されます。
1.研究の背景と概要
1)背景
免疫細胞、特にT細胞は体内でウイルスや細菌などの病原体だけでなく、異常ながん細胞を排除するために非常に重要な細胞です。最近、抗PD1抗体(オプジーボなど)のような免疫チェックポイント分子(注3)を阻害することが、ある種のがん治療に有効であることに注目が集まっています。またがん患者の腫瘍組織などから分離したがんに特異的なT細胞を試験管内で大量培養し、患者へ再び戻す細胞移入療法もきわめて有用な治療法であると考えられています。しかしながら、がん組織や試験管内で何度も刺激を受けることで、T細胞は疲弊状態に陥ってしまいます。疲弊状態に陥ったT細胞を患者体内に戻しても、がん細胞を攻撃する力が弱く、十分な治療効果を得ることができないと考えられています。
T細胞を疲弊状態から回復させる方法として、山中伸弥教授が開発した、一度分化した細胞を初期化する山中4因子をT細胞に導入してiPS細胞へ生まれ変わらせたのちにT細胞へ再分化させて体内に戻す方法(注4)が報告され、実用化が進められています(図1)。しかしながら、一度iPS細胞を作製するステップを踏むため、時間・コスト・手間がかかるという難点がありました。
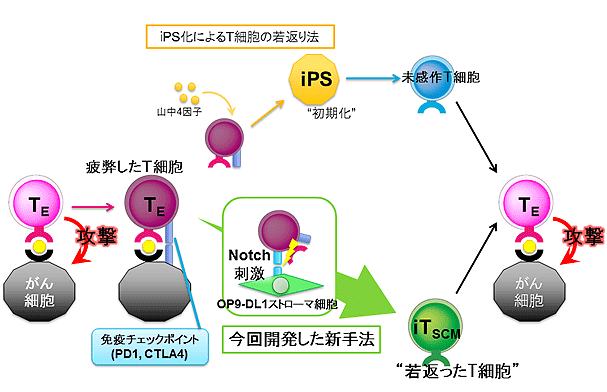 【図1】「iPS化によるT細胞の若返り法」(図上)と、今回開発された方法(図下)の比較
【図1】「iPS化によるT細胞の若返り法」(図上)と、今回開発された方法(図下)の比較
2)概要
今回の研究では長時間活性化されすぎて疲弊化してしまったT細胞を1段階若返らせて生まれたてのT細胞である未感作T細胞(ナイーブT細胞とも呼ばれる)に近い状態に戻す方法の開発をめざしました(図1)。近年メモリーT細胞の中に、幹細胞様メモリーT細胞(ステムセルメモリーT細胞=TSCM)(注5)という新たな細胞が発見されました。TSCMは抗原による刺激をうけたものの、疲弊状態にない若いT細胞で、寿命が長く、また再度の抗原刺激に対して素早く応答するので、がん治療やワクチンへの応用が期待されています。これまでに未感作T細胞に薬剤を用いてTSCMを誘導する方法は報告されていますが、得られる細胞数は少なく、またがんを認識させるために人工的な遺伝子を導入することが必要でした。
そこで利便性・安全性の観点から、簡単なステップで、がんに特異的なTSCM細胞を大量に得る方法が求められていました。
研究グループは効果的ながん特異的T細胞を用いた、細胞移入療法の確立をめざして、一旦活性化され疲弊したT細胞を未感作に近い状態(若返った状態)に戻す方法を探索しました。その結果、活性化したT細胞をOP9-DL1と呼ばれるストローマ細胞(注6)と共培養すると活性化T細胞にNotchと呼ばれる特殊な刺激が入ることでより未感作状態に近いT細胞が生まれることがわかりました(図2)。この未感作状態に近いT細胞は、疲弊状態を示す免疫チェックポイント分子であるPD1とCTLA4の発現がほぼ消滅し、より若返った状態でした。さらにこの未感作状態に近いT細胞は、迅速に大量の活性化T細胞を生み出し、マウス体内において長期生存・自己複製する能力を示しました。これらの性質はステムセルメモリーT細胞によく似ています。そこで本培養法で得られるT細胞を『誘導性ステムセルメモリーT細胞 (iTSCM)』と名付けました。
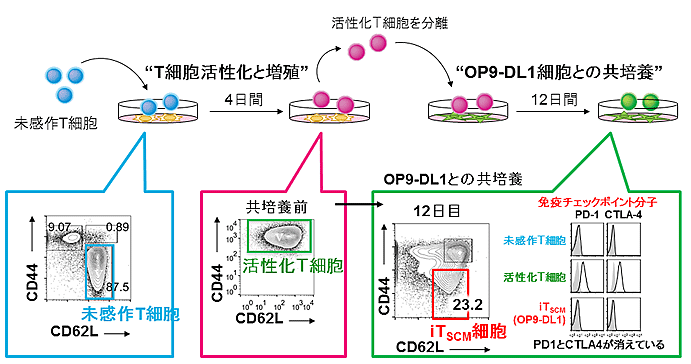
【図2】マウスの誘導性ステムセルメモリーT細胞(iTSCM)作成方法。まず未感作T細胞を分離後、T細胞の活性化を行った。4日後未分化T細胞は、ほぼすべて活性化T細胞に分化した。活性化T細胞をOP9-DL1ストローマ細胞と共培養を行ったところ、共培養12日後にステムセルメモリーT細胞様の細胞(iTSCM)が出現した。この細胞は疲弊状態を示す免疫チェックポイント分子の発現がなくなっていた。
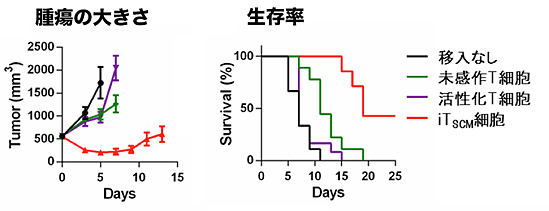
がんを認識するiTSCMを、がん細胞を移植したマウスに移入したところ、期待通り、他の種類のT細胞よりもきわめて強くがんの増大を抑制しました(図3)。一部のマウスでは、がんの症状や兆候が見られなくなる完全寛解まで達しました。
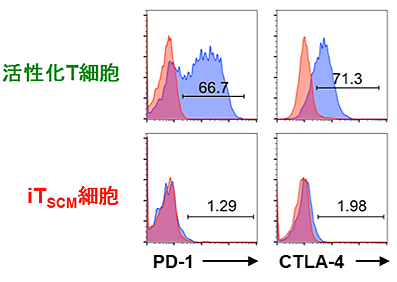
さらにヒト末梢血のメモリーT細胞から同じ方法でiTSCMを誘導できることがわかりました。このヒトiTSCM細胞も疲弊状態を示すPD1やCTLA4の発現レベルが低下しており、再刺激でよく増殖するとともに、ウイルスによってがん化した細胞を攻撃する能力を持つことが確認されました(図4)。
2.研究の成果と意義・今後の展開
研究グループは、活性化したT細胞からより未分化のiTSCM細胞を誘導する方法を確立しました。そして、この細胞は疲弊状態から回復し、生体内できわめて高い抗腫瘍効果を持つことが明らかになりました。本研究成果は、より効果的な細胞移入療法によるがん治療法の開発につながるものと期待されます。
次の課題は、実際にヒト腫瘍内のT細胞からiTSCM細胞を作製し、対象となるがんを死滅させることができるかです。すでにヒト化マウスを用いた実験ではヒトiTSCM細胞に強い抗腫瘍効果があることを確認しています。
また本法は老化した細胞が条件によっては『若返る』可能性があることを示しています。このメカニズムを明らかにできれば、体内で免疫システムを若返らせることが可能になるかもしれません。さらにT細胞だけではなく神経細胞や生殖細胞など他種類の細胞も若返らせる方法の発見につながる可能性があります。
3.特記事項
4.論文
- タイトル:
- “Notch-mediated conversion of activated T cells into stem cell memory-like T cells for adoptive immunotherapy”
(日本語訳:Notchシグナルによる活性化T細胞からステムセルメモリーT細胞への転換と免疫療法への応用) - 著者名:
- 近藤泰介、森田林平、奥薗夕海、中司寛子、関谷高史、竹馬俊介、七田崇、 金森光広、久保允人、古賀敬子、宮崎宇広、葛西義明、吉村昭彦
- 掲載誌:
- Nature Communications オンライン速報版
-
用語解説
(注1)細胞移入療法: - がん患者から取り出したT細胞を試験管内で培養してがん特異的T細胞だけを増幅し、これを再びがん患者に戻す治療法。免疫チェックポイント阻害薬と共に注目を浴びている免疫療法のひとつ。
- (注2)T細胞の疲弊:
- T細胞の疲弊:T細胞は慢性的に活性化され続けると免疫チェックポイント分子を発現して増殖できなくなったり、標的細胞を攻撃できなくなったりする。この現象を疲弊化という。疲弊状態に陥ったT細胞は、生体内に戻しても増殖能力やがんを攻撃する能力が弱く、高い治療効果を期待できない。
- (注3)免疫チェックポイント:
- 人間の体内では免疫系が病原体に感染した細胞やがん細胞を攻撃し、排除する。その一方で免疫機構には適正に免疫反応を終息させ正常な組織を攻撃しないように、過剰な応答を抑えるシステムが存在する。がん細胞は免疫細胞に攻撃から逃れるために、このシステムを悪用して免疫応答にブレーキをかける。免疫チェックポイントと呼ばれるたんぱく質は、このようなブレーキの役割を果たしており、その代表的なものがPD1やCTLA4である。免疫チェックポイント分子は若い免疫細胞では発現しておらず、刺激を受け続けて疲弊化すると増加する。PD1やCTLA4の機能を抗体により阻害することで腫瘍内の免疫反応を回復する免疫チェックポイント阻害剤に近年注目が集まっている。
- (注4)iPS細胞からT細胞の作製:
- 山中伸弥教授が特定した4個の遺伝子(山中4因子と呼ばれる)を導入してiPS細胞を作製する技術を用いて、がん患者から取り出したT細胞から一度iPS化して大量に増殖した後に再びがんを攻撃できるT細胞へ分化する手法。がん患者からがんを攻撃できるT細胞を十分な量増幅できれば有効な治療法になると期待される。
- (注5)ステムセルメモリーT細胞:
- 未感作T細胞は病原体やがん細胞などの異物に触れると活性化されてエフェクターT細胞(TE)になる。TEは短命で異物の排除が終わると死滅する。しかし異物を認識したT細胞の一部は体内に生き残こり、再感染や再発時にいち早く異物排除に働いて病気の発症や悪化を防ぐ。すなわち一度罹った病原体を「記憶」していることからメモリーT細胞と呼ばれ、分化段階の事なる複数の種類が存在する(図5参照)。このなかで最も未感作T細胞に近く、最も長寿であり、終生にわたって免疫記憶を保持すると考えられているメモリーT細胞がステムセルメモリーT細胞である(図5参照)。TSCMは(1)自己複製能力が高く、長寿であり、(2)他のメモリーT細胞やエフェクターT細胞を生み出すことができ、(3)再感染時には素早く活性化して、免疫応答を引き起こす。などの性質がある。
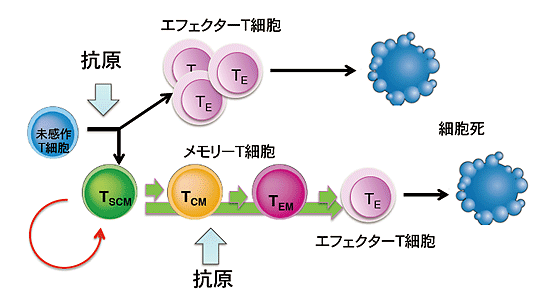
【図5】T細胞の運命とメモリー細胞の分化
- (注6)ストローマ細胞:
- 間質細胞とも呼ばれ、幹細胞や前駆細胞が生存を維持や分化する環境を提供する細胞である。具体的には細胞同士の接触刺激や栄養因子を提供、産生すると考えられている。マウス由来のストローマ細胞の一種であるOP9-DL1細胞は試験管内で免疫細胞の発生や iPSからT細胞を誘導するのによく使われる。
お問い合わせ先
本発表資料のお問い合わせ先
慶應義塾大学医学部微生物・免疫学教室
教授 吉村 昭彦(よしむら あきひこ)
TEL:03-5363-3483 FAX:03-5360-1508
E-mail:yoshimura"AT"a6.keio.jp
本リリースの発信元
慶應義塾大学
信濃町キャンパス総務課:鈴木・吉岡
〒160-8582 東京都新宿区信濃町35
TEL:03-5363-3611 FAX:03-5363-3612
E-mail:med-koho"AT"adst.keio.ac.jp
http://www.med.keio.ac.jp/
事業に関するお問い合わせ
(革新的先端研究開発支援事業)
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
TEL:03-6870-2224
E-mail:kenkyuk-ask"AT"amed.go.jp
※Emailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成29年5月22日
最終更新日 平成29年5月22日


