抗病原体分子をバランスよく配置して、免疫反応を効率化! ―寄生虫「トキソプラズマ」など病原体に対する免疫反応に重要な因子を同定―
プレスリリース
国立研究開発法人日本医療研究開発機構
研究成果のポイント
- 正常細胞ではインターフェロン※1に依存して働く抗病原体因子GBP※2が細胞内に均一に配置され、病原体に対し効率的に免疫反応を誘導していることを明らかに。
- GBPの細胞内配置は宿主分子Gate-16が制御しており、Gate-16がないとGBPが不均一に配置されトキソプラズマやサルモネラなどの感染に対して劇的に脆弱になることを発見。
-
病原体の迅速な排除のために進化した免疫系の巧妙な戦略の一つが明らかに。
概要
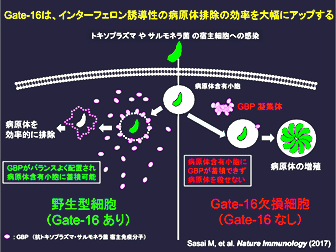
大阪大学微生物病研究所の山本雅裕教授(免疫学フロンティア研究センター兼任)らの研究グループは、Gate-16(ゲート16)と呼ばれる宿主分子が、病原体含有小胞を形成する寄生虫「トキソプラズマ」や細菌「サルモネラ」のインターフェロンによる効率的な排除に必須であることを発見しました。
トキソプラズマやサルモネラなどの多くの病原体は、感染した宿主(しゅくしゅ)細胞内ではまず「病原体含有小胞」という膜構造体に包まれた状態で存在し、宿主による分解を逃れています。そのような病原体に対してわれわれ宿主はインターフェロンに依存した免疫反応を起こし、病原体含有小胞を破壊して対抗しています。山本教授らのグループは2012年にインターフェロンによって誘導されるGBPが病原体含有小胞を破壊し、トキソプラズマの発病を抑えていることを明らかにしました。しかし、この免疫反応がどのように効率的に制御されているのかについては良く分かっていませんでした。
今回山本教授らのグループは、
- 正常細胞内では抗病原体因子GBPが細胞内にバランス良く配置されていること
- ゲノム編集法で作製したGate-16欠損細胞ではGBPが細胞内で凝集し不均一な配置となることで、トキソプラズマやサルモネラの病原体含有小胞上への蓄積率が低下し、病原体の効率的な排除が出来ないこと
- Gate-16欠損マウスでは、GBPの病原体含有小胞への蓄積が低下し、トキソプラズマ感染に劇的に弱くなること
を明らかにしました。
本研究成果は、近年我が国においても症例報告が増加しているトキソプラズマ症やサルモネラを原因とする食中毒に対して、Gate-16を標的とした新規治療戦略を提供できるものとして期待されます。
本研究成果は、英国の科学雑誌 『Nature Immunology』(6月12日付け:日本時間6月13日午前0時)にオンライン掲載されました。
研究の背景
寄生虫「トキソプラズマ」は原虫(単細胞の寄生虫)の一つであり、世界人口の約3割に感染しているとされています。免疫機能が正常な健常人ではトキソプラズマに感染してもほとんど症状はありませんが、エイズや抗癌剤投与下のガン患者あるいは免疫抑制剤を投与されている免疫不全者において致死性の脳症や肺炎を引き起こします。また妊婦が初感染した際に胎盤を通じて胎児に感染し、流産や死産あるいは感染したまま新生児が生まれ水頭症や網脈絡膜炎などを主症状とする先天性トキソプラズマ症を発病している例が近年マスコミなどでも取り上げられています。また「サルモネラ」は食中毒を起こす代表的な細菌であり、平成28年には我が国で31件のサルモネラが関係する食中毒が起き、704人の患者が出ています。以上のように、日本においても「トキソプラズマ」や「サルモネラ」は依然として病気を引き起こす病原体です。
トキソプラズマやサルモネラは我々宿主の体内に入りマクロファージなどの免疫細胞の中に「病原体含有小胞」で総称される膜状の特殊な構造体を作って感染して増殖します(図1)。トキソプラズマの細胞内感染に対して宿主はインターフェロンが誘導する様々なタンパク質群が病原体含有小胞に蓄積した上で、病原体含有小胞を破壊してトキソプラズマやサルモネラを細胞内で殺傷しています。しかし、インターフェロン誘導性タンパク質がどのようにして効率よくトキソプラズマやサルモネラの「病原体含有小胞」に蓄積しているのかについては良くわかっていませんでした。
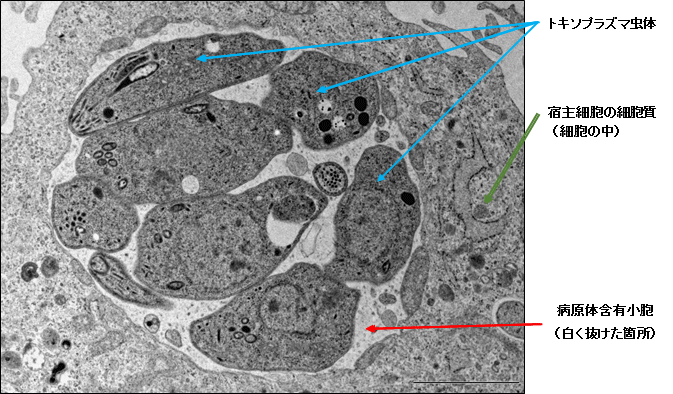
宿主の細胞の中に感染し、病原体含有小胞内に存在しているトキソプラズマの電子顕微鏡写真。尚、トキソプラズマの病原体含有小胞は「寄生胞」とも呼ばれている。
研究成果
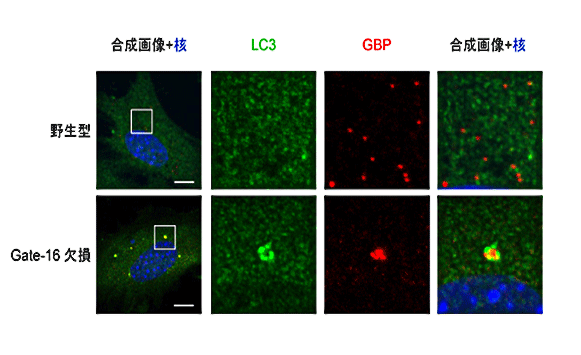
GBPは通常、インターフェロン刺激した未感染細胞では粒状で細胞質に均一に「遍在」しています。一方、Gate-16欠損細胞では、細胞質内の数箇所に凝集し「偏在」していることがわかりました(図2)。つまり、GBPがGate-16依存的に細胞質内に均一に「遍在」することが、抗病原体応答に重要であることがわかりました。
さらに、マウスの実験においても、Gate-16欠損マウスはトキソプラズマに対して劇的に高い感受性を示し、原虫の数が野生型に比べ劇的に増加していました。このことから、個体レベルでもGate-16が抗病原体応答に重要であることがわかりました。
以上の結果から、Gate-16は抗トキソプラズマ・サルモネラ宿主免疫分子GBPを細胞質内であらかじめバラバラと(バランスよく)配置することによって、それらの病原体がどこから侵入してきてもGBPと遭遇するように用意し、抗病原体応答を効率的に引き起こしていると考えられます(図3)。
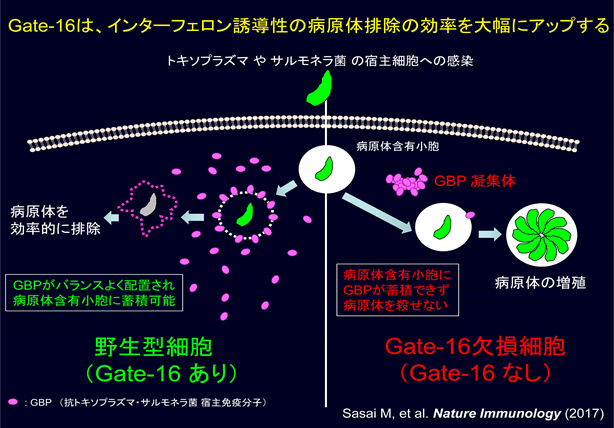
Gate-16がある野生型細胞では、GBPは細胞質内にバラバラに均一に「遍在」しており、トキソプラズマやサルモネラなどの病原体が感染しても、GBPが病原体含有小胞上に蓄積できる。一方Gate-16欠損細胞においては、GBPが凝集体を形成し不均一に「偏在」しているため病原体含有小胞とGBPが効率的に出遭えず、その結果、病原体の増殖が起きてしまっている。
本研究成果が社会に与える影響(本研究成果の意義)
特記事項
本研究成果は、英国の科学雑誌 『Nature Immunology』(6月12日付け:日本時間6月13日午前0時)にオンライン掲載されました。
- タイトル:
- “Essential role for GABARAP autophagy proteins in interferon-inducible GTPase-mediated host defense”
Nature Immunology 2016, doi: 10.1038/ni.3767 - 著者名:
- Sasai M, Sakaguchi N, Ma JS, Nakamura S, Kawabata T, Bando H, Lee Y, Saitoh T, Akira S, Iwasaki A, Standley DM, Yoshimori T, Yamamoto M.
本研究は、日本医療研究開発機構(AMED)の新興・再興感染症に対する革新的医薬品等開発推進研究事業「トキソプラズマ症の総合的対策に向けた開発研究」の支援により行われました。
用語説明
- ※1 インターフェロン
- 病原体や腫瘍細胞などに応答して分泌され、病原体に抵抗できるよう免疫系や炎症反応を制御するタンパク質。アルファ、ベータ、ガンマなど複数のサブタイプが発見されており、それぞれ異なる生理機能を持つ。今回の抗病原体分子GBPはインターフェロンガンマによって誘導される。
- ※2 GBP(p65 GTP分解酵素)
- インターフェロンによって誘導され、トキソプラズマなどの病原体が作る病原体含有小胞を破壊してトキソプラズマの発病を抑制する。トキソプラズマ破壊のための最も重要な宿主免疫分子。2012年に山本教授らのグループがこのGBPの機能を明らかにした(Immunity 2012, 37(2):302-13)。
お問い合わせ先
研究内容に関する問い合わせ先
大阪大学 微生物病研究所 感染病態分野 教授
(免疫学フロンティア研究センター 免疫寄生虫学教室 兼任)
山本 雅裕(やまもと まさひろ)
TEL:06-6879-8333 FAX:06-6879-8332
E-mail:myamamoto"AT"biken.osaka-u.ac.jp
新興・再興感染症に対する革新的医薬品等開発推進研究事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構 (AMED)
戦略推進部 感染症研究課
TEL:03-6870-2225 FAX:03-6870-2243
E-mail:shinkou-saikou"AT"amed.go.jp
報道に関する問い合わせ先
大阪大学 微生物病研究所 広報室
中込 咲綾(なかごみ さや)
TEL:06-6879-8357 FAX:06-6879-8357
E-mail:nakagomi"AT"biken.osaka-u.ac.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 平成29年6月13日
最終更新日 平成29年6月13日


