プレスリリース ノックアウトマウスを短期間で作製する技術の開発 ―CRISPR/Casゲノム編集を応用した疾患モデルマウスの短期間作製法―
プレスリリース
国立研究開発法人日本医療研究開発機構
本研究成果のポイント
- 疾患モデルマウスを作製するには、まず対象臓器だけで標的の遺伝子を破壊できる(条件付きノックアウト)マウスを作製する必要があるが、従来の技術では作製に数年を要した。
- 今回、CRISPR/Casゲノム編集を2段階に分けて行うことにより、マウスの交配なしに、条件付きノックアウトマウスを1ヵ月で作製できる技術を開発した。
- 本技術は、疾患モデルマウス作製に必要な期間を大幅に短縮させ、病態の解明や創薬研究に貢献するものである。
概要
創薬研究において創薬標的遺伝子のノックアウトマウス*1作製技術を用いた疾患モデル作出は必要不可欠です。しかしながら、ある機能を担う遺伝子が全身から除去されると、多くの場合、そのノックアウトマウスは生まれる前に死亡してしまいます。このため全身ではなく、対象とする臓器だけで標的の遺伝子がノックアウトされる、条件付きノックアウトマウス*2が用いられることとなります。また薬剤の効果や副作用が起こる臓器を特定するためにも、条件付きノックアウトマウスの作出は重要です。しかし従来の技術では条件付きノックアウトマウスの作出には数年間を要しました。近年CRISPR/Casゲノム編集*3技術が著しく発達したことから、ノックアウトマウス作製にも応用されましたが、期待された成果はなかなか得られていませんでした。
このたび、群馬大学生体調節研究所ゲノム科学リソース分野の畑田出穂教授、堀居拓郎助教らのグループは、迅速に、条件付きノックアウトマウスを作製できる方法を開発しました。これまでのCRISPR/Casゲノム編集技術を用いる方法は、1回で遺伝子を切断したために上手く行かなかったのですが、新方法では、2回に分けて切ることにより染色体欠失が起こらず効率よく、条件付きノックアウトマウスを作製することができるようになりました。
この新しい技術により、疾患モデル動物を用いた病態解明や創薬における標的妥当性評価などへの応用が大きく広がることが期待されます。
本成果は国際科学雑誌『Scientific Reports』(英国時間 8月11日10時:日本時間 8月11日18時)に掲載されます。
背景
成果
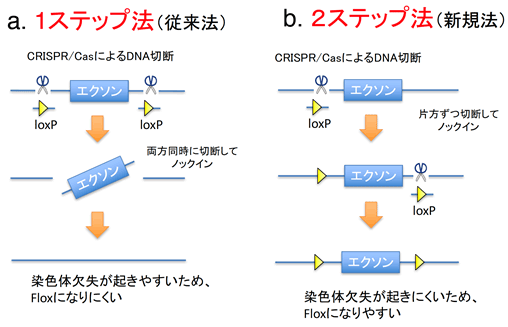 図1 条件付きノックアウトマウス作製におけるCRISPR/Casゲノム編集技術を用いる従来法と新規法の比較
図1 条件付きノックアウトマウス作製におけるCRISPR/Casゲノム編集技術を用いる従来法と新規法の比較
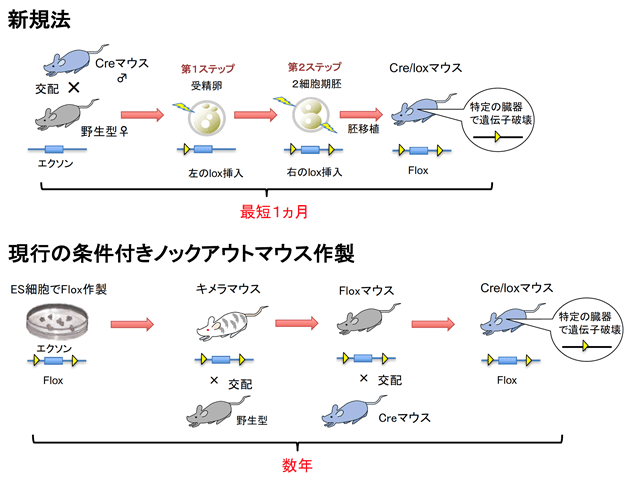 図2 Cre受精卵を用いた条件付きノックアウトマウスの直接作製
図2 Cre受精卵を用いた条件付きノックアウトマウスの直接作製
社会的意義とこれからの展望
本研究は、文部科学省(2014年度)・日本医療研究開発機構(AMED)(2015年度以降)革新的バイオ医薬品創出基盤技術開発事業「新規CRISPR-Cas9システムセットの開発とその医療応用」(研究代表者:濡木 理)等の一環で行われました。
発表雑誌
- 雑誌名:
- 「Scientific Reports」(英国時間 8月11日付:日本時間 8月11日)
- 論文タイトル:
- Efficient generation of conditional knockout mice via sequential introduction of lox sites
- 著者:
- Takuro Horii, Sumiyo Morita, Mika Kimura, Naomi Terawaki, Mihiro Shibutani and Izuho Hatada* *責任著者
- DOI 番号:
- 10.1038/s41598-017-08496-8
用語解説
- *1 ノックアウトマウス:
- 人為的に特定の遺伝子の機能を破壊されたマウス。正常個体と比較することで遺伝子の機能を明らかにすることができます。全身で遺伝子が破壊されるため、生まれるまでに死んでしまうこと(胎性致死)が遺伝子の数の6割でみられます。
- *2 条件付きノックアウトマウス:
- 特定の遺伝子について、臓器や時期特異的に遺伝子の機能を破壊されたマウス。全身性のノックアウトマウスでは胎性致死となり形質解析できない場合に用いられます。
- *3 CRISPR/Casゲノム編集:
- ゲノム中の特定の遺伝子のみを切断する技術をゲノム編集といいます。特定の遺伝子を破壊したり改変したりすることができます。いくつかの方法がありますが、その中で2012年に開発されたCRISPR/Casゲノム編集法は、Cas9タンパク質が標的遺伝子の一部の配列を組み込んだガイドRNA(gRNA)と複合体を形成することで標的遺伝子を切断することができます。また、今回のように切断箇所に新たな配列を挿入することもできます。
- *4 Cre/loxシステム:
- 条件付きノックアウトマウス作製に最も利用されているシステム。まず、欠損させたい遺伝子の両端にlox配列をもつ(Flox)マウスを作製します。次に、臓器や時期特異的な活性をもつプロモーターの制御下でDNA組換え酵素(Cre)を発現するトランスジェニックマウス(Creマウス)とFloxマウスを交配します。得られたCre/loxマウスではCreが発現する組織のみでエクソンの両側のloxの間で組換えが起こり遺伝子が破壊されます。
- *5 Floxマウス:
- 欠損させたい遺伝子の両端にそれぞれ34塩基からなるlox配列が組み込まれたマウス。loxに挟まれた領域は、DNA組換え酵素(Cre)により組換えが起こり除去され、遺伝子が破壊されます。
- *6 ノックイン:
- 生物の染色体の特定の遺伝子座にDNA配列を挿入する遺伝子工学的手法。
問い合わせ先
研究に関すること
群馬大学生体調節研究所
生体情報ゲノムリソースセンター ゲノム科学リソース分野
教授 畑田出穂
E-mail:hatada“AT”gunma-u.ac.jp
報道に関すること
群馬大学生体調節研究所
庶務係長 金子友和
TEL:027-220-8822
国立研究開発法人日本医療研究開発機構(AMED)
経営企画部 企画・広報グループ
TEL:03-6870-2245
AMED 事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
創薬戦略部 医薬品研究課
〒100-0004 東京都千代田区大手町1-7-1 読売新聞ビル
TEL:03-6870-2219 FAX:03-6870-2244
E-mail:kaku-bio27“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 平成29年8月11日
最終更新日 平成29年8月11日


