プレスリリース 100年来の謎・がんの代謝を解明―慶大先端生命研などの研究グループ、大腸がんの代謝が変化する仕組みを解明
プレスリリース
慶應義塾大学先端生命科学研究所
国立研究開発法人日本医療研究開発機構
慶應義塾大学先端生命科学研究所(以下慶大先端生命研、山形県鶴岡市)の曽我朋義教授、佐藤清敏特任助教、香川大学医学部消化器外科鈴木康之教授、国立がん研究センター谷内田真一ユニット長、愛知県がんセンター研究所青木正博部長らの研究グループは、100年来のがんの謎であった、がんの代謝が変化する仕組みを解明した。
この研究は、日本医療研究開発機構(以下AMED)の革新的先端研究開発支援事業AMED-CREST「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出(清水孝雄 研究開発総括)」および山形県と鶴岡市の支援によるものであり、この研究成果は2017年8月29日、米国科学アカデミー紀要(Proceeding of National Academy of Sciences of the United States of America)電子版に掲載された。
がん細胞は、正常細胞と異なる代謝を使って生存に必要なエネルギーを産生していることが知られている。この現象は、1920年代にドイツの生理学者Otto Warburg(オットー ワールブルグ)によって発見され、ワールブルグは、この成果によって1931年にノーベル生理学・医学賞を受賞している。
この発見が起点となり、がんの代謝研究が盛んに行われたが、代謝と発がんの関係は解明されず、その後の数十年間はがんの代謝研究は下火になっていた。
21世紀に入り、ワールブルグが発見した代謝以外にも、がんに特異的な代謝が幾つか見つかり、がん細胞はこれらの代謝を使って増殖に必要な生体分子をつくり出していることが判明した。
現在、がんが示す代謝を阻害してがん細胞を死滅させようとする抗がん剤の開発が世界中で精力的に行われている。しかし、がん細胞がどのようなメカニズムで代謝を変化させるかについては、よくわかっていなかった。
研究グループは、大腸がん患者275名から採取された正常組織とがん組織に存在する生体分子をメタボローム解析技術などの最先端の分析技術で手当たり次第に測定した。
その結果、(1)大腸がんの代謝は良性腫瘍の段階から変化し、がんのステージによらないこと、(2)がん遺伝子産物であるMYCタンパク質が215の代謝反応を介して大腸がんの代謝を変化させていること、を臨床検体で初めて証明した。さらに(3)MYCおよびMYCが制御している代謝酵素の抑制が大腸がん細胞の増殖を抑えることを示し、(4)MYCが制御しているピリミジン代謝経路が有望な大腸がんの治療法の標的になることを示した。
この研究は、AMEDの革新的先端研究開発支援事業(AMED-CREST)「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出(清水孝雄 研究開発総括)」研究開発領域における研究開発課題「代謝産物解析拠点の創成とがんの代謝に立脚した医療基盤技術開発」(研究開発代表者:曽我 朋義)※、および山形県と鶴岡市の支援によるものであり、この研究成果は2017年8月29日、米国科学アカデミー紀要(Proceeding of National Academy of Sciences of the United States of America)電子版に掲載された。(※平成27年4月の日本医療研究開発機構の発足に伴い、国立研究開発法人科学技術振興機構(JST)より移管された。)
研究内容の詳細
次に、DNAマイクロアレイを用いて、3万2千の遺伝子発現解析を行ったところ、代謝に関与する遺伝子も、良性腫瘍(アデノーマ)の段階に発現が変動し、ステージが進行しても遺伝子発現に変化はないことが判明した(図3)。
同様に大腸に良性腫瘍を形成するApc変異マウス(愛知県がんセンター研究所青木正博部長より提供)の組織を解析したところ、臨床検体(ヒト大腸がん患者の組織)と同様に代謝物も遺伝子の変化も良性腫瘍で起きていた。
大腸がんは、がん遺伝子、がん抑制遺伝子であるAPC、KRAS、TP53に変異が入ることにより発症することが知られている(図4)。そこで、大腸がんの組織のがん遺伝子、がん抑制遺伝子の変異の有無を次世代シーケンサにより解析した。その結果、APC、KRAS、TP53など幾つかのがん遺伝子、がん抑制遺伝子の変異が見つかった。次にこれらの変異が代謝物の濃度に影響を与えるか検証したところ、これらの変異は、代謝物の濃度の変動には影響を与えないことが判明した(図5)。
そこで何が大腸がん組織の代謝を制御しているかを解明するため、臨床検体およびApc変異マウスの遺伝子発現の結果を精査したところ、がん遺伝子であるMYCが臨床検体の大腸がん組織で7倍(図6)、Apc変異マウスの良性腫瘍で3倍、正常組織に比べて高発現していることが判明した。
続いて、大腸がん細胞を用いた実験によって、MYC遺伝子が、160種類の代謝関連酵素遺伝子の発現を介して215の代謝反応を制御していることが判明した(図7)。MYC遺伝子の発現を抑制すると、160種類の代謝関連酵素遺伝子の発現変動がリセットされるとともに(図8)、大腸がん細胞の増殖も著しく抑制された(図9)。さらにMYCによって制御されている代謝酵素の遺伝子発現を抑制しても大腸がん細胞の増殖が抑制された(図9)。
これらの実験結果から、大腸がんの代謝はMYCによって制御されており、MYCは良性腫瘍の段階で発現し、それによって代謝が劇的に変動していることが判明した。この代謝の変動つまり栄養源の供給が、細胞ががん化し増殖するためには不可欠であると思われる。したがって、MYCおよびMYCの標的の代謝酵素遺伝子の発現を抑制すると、代謝の変動(栄養源の供給)が抑制されるため、がんの増殖が著しく低下することが示唆された。
本研究は、100年来のがんの謎であったがんの代謝を制御する因子を、臨床検体を用いた実験によって初めて明らかにするとともに、MYCおよびMYCの標的のCADなどのピリミジン代謝酵素遺伝子が大腸がんの治療標的であることを示したものである。この研究成果は、今後の大腸がんの予防法や治療法の開発に有用な情報となるはずである。
曽我朋義教授は、「AMED-CRESTでの多くの研究機関との共同研究によって、がんの謎であったがんが代謝をシフトするメカニズムを、臨床検体を用いてはじめて解き明かすことができた。この成果によって大腸がんの予防法や治療法の開発が進展すればうれしい。」と話している。
国立国際医療研究センターの清水孝雄AMED-CREST研究開発総括は、「がん組織で代謝が変わるという研究は多いが、多数の大腸がん患者検体を用いてがん部と非がん部における数百の代謝物を系統的に調べた研究は少ない。代謝パターンの解析からMYCに至った研究経緯も本領域の目指す目標の成功例の一つと言えよう。腫瘍形成の初期から代謝変化が起きており、診断及び治療への応用の期待は高い」と語った。
図の説明
 CE-MS測定装置
CE-MS測定装置
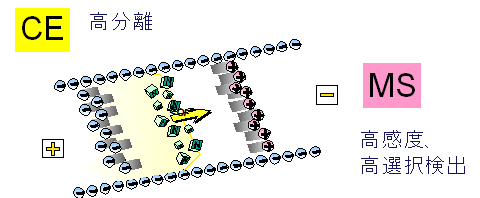 図1 キャピラリー電気泳動-質量分析計(CE-MS)によるメタボローム測定法
図1 キャピラリー電気泳動-質量分析計(CE-MS)によるメタボローム測定法
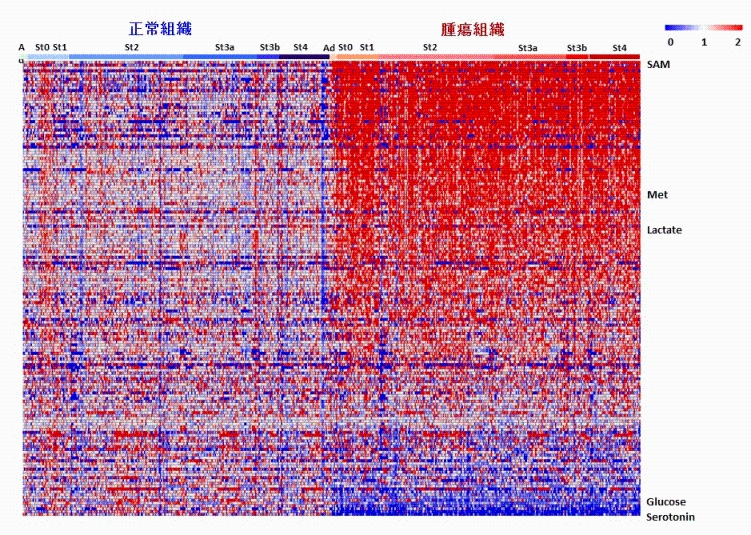 図2 大腸がん患者(275例)の正常および腫瘍組織の代謝物の濃度
図2 大腸がん患者(275例)の正常および腫瘍組織の代謝物の濃度
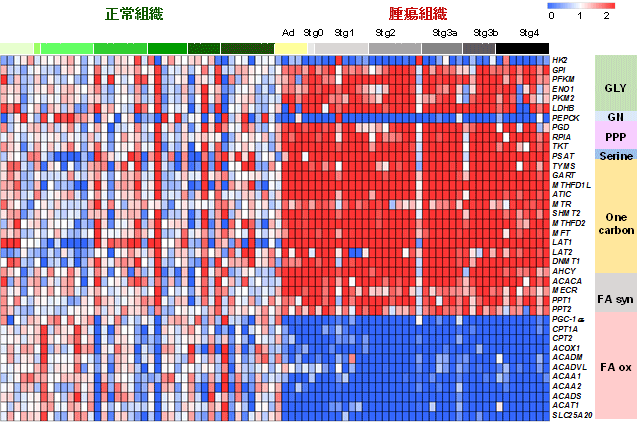 図3 大腸がん患者の正常および腫瘍組織の代謝関連遺伝子の発現
図3 大腸がん患者の正常および腫瘍組織の代謝関連遺伝子の発現
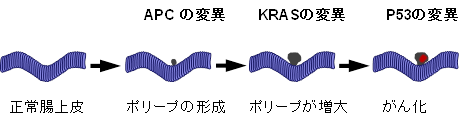 図4 大腸がんの発がん
図4 大腸がんの発がん
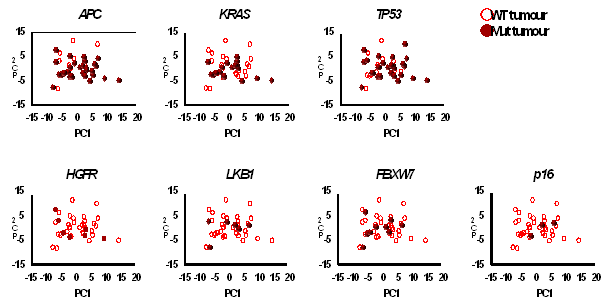 図5 大腸がん組織で見られる遺伝子変異が代謝に与える影響
図5 大腸がん組織で見られる遺伝子変異が代謝に与える影響
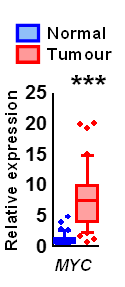
図6 大腸の正常組織とがん組織のMYCの発現
大腸の正常組織に対してがん組織ではMYC遺伝子が平均で7倍高く発現していた。
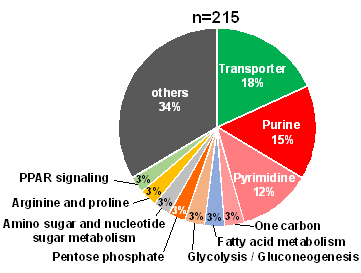
図7 MYCによる大腸がんの代謝制御
大腸がんでは、MYCが160種類の代謝関連遺伝子を介して215の代謝反応を制御する。
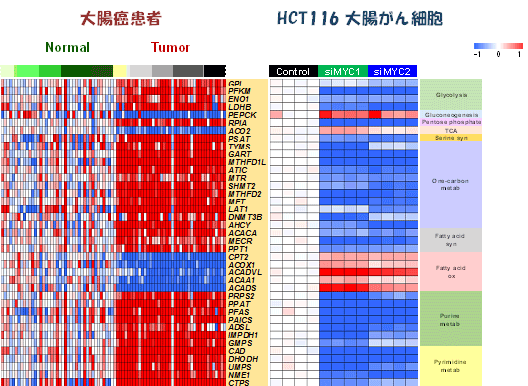
図8 MYCの発現を抑制すると大腸がん細胞の遺伝子発現がリセットされる
大腸がん患者のがん組織での遺伝子(左)は、大腸がん細胞(HCT116)を用いて、MYCの発現を抑制すると、高発現の遺伝子(赤)は低発現(青)に、低発現の遺伝子(青)は高発現(赤)に遺伝子発現が反対になった。このことは、これらの遺伝子は、MYCによって制御されていることを示す。
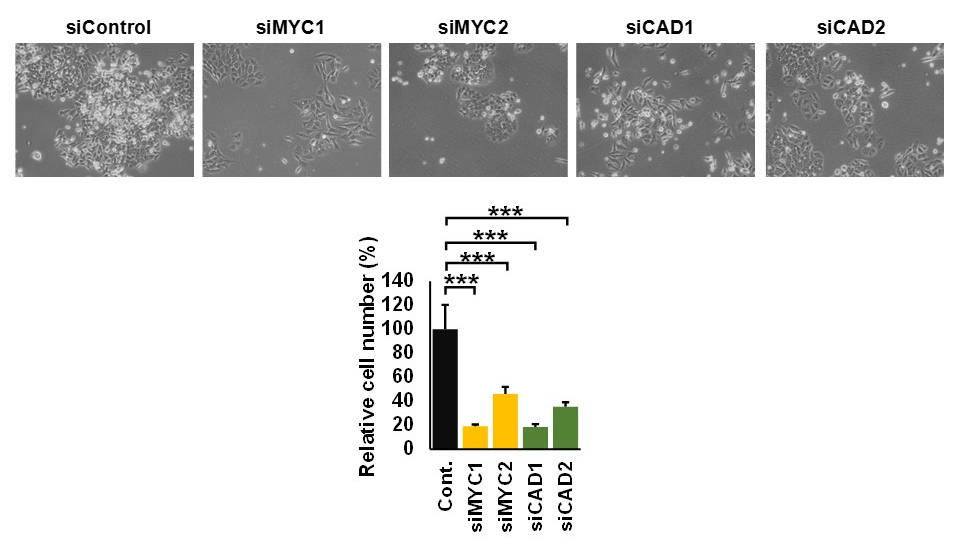
図9 MYCおよびMYCパスウェイの遺伝子抑制による大腸がん細胞の増殖試験
大腸がん細胞(左)に対して、MYC遺伝子を抑制(左から2番目と3番目)、あるいはMYCの標的であるピリミジン代謝経路のCAD遺伝子(左から4番目と5番目)を抑制すると大腸がん細胞の増殖が抑制された。
お問い合わせ先
研究に関すること
慶應義塾大学先端生命科学研究所
渉外担当 塩澤
TEL:0235-29-0802 FAX:0235-29-0809
Eーmail:office“AT”ttck.keio.ac.jp
AMEDに関すること
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
TEL:03-6870-2224 FAX:03-6870-2243
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成29年8月29日
最終更新日 平成29年8月29日


