プレスリリース 発達期の脂肪酸不足が統合失調症発症に関連―核内受容体を標的とした新しい治療薬へ期待―
プレスリリース
理化学研究所
日本医療研究開発機構
理化学研究所(理研)脳科学総合研究センター分子精神科学研究チームの吉川武男チームリーダー、前川素子研究員らの共同研究グループ※は、マウスを用いた研究により、脳発達期の脂肪酸[1]の摂取不良が統合失調症発症リスクに関与する可能性があることを示しました。
統合失調症は、幻覚、妄想、認知機能異常など、さまざまな症状が現れる精神疾患です。その生涯罹患率は人口の約1%と高く注1,2)、一旦発症すると、完全な回復は困難であることが少なくないため、より効果的な治療法や予防法の開発が望まれています。統合失調症は主に思春期以降に発症しますが、発症しやすさには遺伝要因に加えて環境要因が関わることが知られています。オランダと中国における独立した二つの大飢饉の期間に妊娠期を迎えた母親から生まれた子どもは、将来の統合失調症発症率が約2倍なったという疫学的知見注3,4)をもとに、「妊娠期の一時的な栄養不良」が環境要因の一つとなり得ると考えられています。しかし、このような環境要因と精神疾患をつなぐ分子や生物学的メカニズムの手がかりは不明でした。
共同研究グループは、統合失調症の臨床的・分子遺伝学的知見から、多価不飽和脂肪酸[1]の欠乏が特に重要であると考え、マウスの脳発達期に多価不飽和脂肪酸(特にアラキドン酸とドコサヘキサエン酸)の摂取制限を行い、成長後にどのような異常が現れるかを詳しく調べました。その結果、アラキドン酸/ドコサヘキサエン酸欠乏食を投与したマウスでは、①統合失調症の前駆状態に類似する行動変化、②脳内神経活動の変化、③大脳皮質前頭前野[2]におけるオリゴデンドロサイト[3]とGABA(γ-アミノ酪酸)[4]関連遺伝子群の発現低下(統合失調症の死後脳研究で観察されている結果と類似)、④ ③の遺伝子群の上流制御遺伝子として同定した核内受容体[5]遺伝子(特にRxra、Ppara)の発現低下と遺伝子のプロモーター領域[6]のDNAメチル化[7]状態の亢進、などが生じていることを見いだしました。これらは、①脳発達期の不飽和脂肪酸欠乏が将来の精神疾患発症リスク増大につながる可能性、②そのメカニズムとして核内受容体遺伝子のエピジェネティック変化[8]が関与する可能性、③核内受容体作動薬[9]が統合失調症の新しい治療薬になる可能性を示しています。
本成果は、統合失調症の発症機序解明と核内受容体を標的とした新しい創薬につながるものと期待できます。
本研究成果は、米国のオンライン科学雑誌『Translational Psychiatry』(9月5日付け:日本時間9月5日)に掲載されます。
本研究は、日本医療研究開発機構(AMED)「脳科学研究戦略推進プログラム」事業、日本学術振興会科学研究費補助金基盤研究(C)「オリゴデンドロサイト関連遺伝子発現制御に着目した初期精神病状態介入法の開発」の支援を受けて行われました。
- 注1):
- Saha et al: J. A systematic review of the prevalence of schizophrenia. PLoS Med. 2(5): e141,2005
- 注2):
- Chang et al:Lifetime Prevalence and Correlates of Schizophrenia-Spectrum, Affective, and Other Non-affective Psychotic Disorders in the Chinese Adult Population. Schizophr Bull. 2017 [Epub ahead of print] doi:10.1093/schbul/sbx056.
- 注3):
- Susser et al:Schizophrenia after prenatal famine. Further evidence. Arch Gen Psychiatry. 53(1):25-31, 1996.
- 注4):
- St Clair et al:Rates of adult schizophrenia following prenatal exposure to the Chinese famine of 1959-1961. JAMA. 294:557-562, 2005.
※共同研究グループ
- 理化学研究所 脳科学総合研究センター
- 分子精神科学研究チーム
- チームリーダー: 吉川 武男(よしかわ たけお)
- 副チームリーダー:大西 哲生(おおにし てつお)
- 研究員:前川 素子(まえかわ もとこ)
- 研究員:豊島 学(とよしま まなぶ)
- 訪問研究員:シャビーシュ バラン(Shabeesh Balan)
- 基礎科学特別研究員:島本 知英(しまもと ちえ)
- テクニカルスタッフⅡ:渡邉 明子(わたなべ あきこ)
- テクニカルスタッフⅠ:岩山 佳美(いわやま よしみ)
- テクニカルスタッフⅠ:大羽 尚子(おおば ひさこ)
- テクニカルスタッフⅠ:久野 泰子(ひさの やすこ)
- テクニカルスタッフⅠ:野崎 弥生(のざき やよい)
- 研究基盤センター 動物資源開発支援ユニット
- 支援ユニットリーダー:高橋 英機(たかはし えいき)
- 国立長寿医療研究センター アルツハイマー病研究部
- 室長:木村 哲也(きむら てつや)
- 富山大学医学部 公衆衛生学講座
- 准教授:浜崎 景(はまざき けい)
- 熊本大学大学院生命科学研究部 分子脳科学分野
- 教授:岩本 和也(いわもと かずや)
- 准教授:文東 美紀(ぶんどう みき)
- 東北大学大学院医学系研究科 発生発達神経科学分野
- 教授:大隅 典子(おおすみ のりこ)
- 学習院大学理学部生命化学科 神経生物学
- 教授:高島 明彦(たかしま あきひこ)
1.背景
精神疾患の発症には、遺伝要因と環境要因の両方が関係すると考えられています。精神疾患(特に統合失調症)と環境要因との関連については、脳の発達期におけるさまざまな体への影響が発症しやすさの基盤になっている可能性が考えられてきました。これを“神経発達障害仮説”といいます。この説を支持する事象として、①妊婦の栄養不良、②妊婦のウィルス感染、③産科合併症、周産期障害、④母子間のRh血液型不適合などにおいて子どもの将来の統合失調症発症率が上昇する、という疫学的データがあります。特に①に関しては、第二次世界大戦末期にオランダのアムステルダムで起こった“オランダ飢餓の冬”が有名です。アムステルダムでは、戦争中にナチスドイツによって陸路が封鎖された影響で一時的に極端な食糧不足に陥り、食糧配給は最悪の時期で1人あたり1日約400kcalだったといわれています。この大飢饉の時期に母親の胎内にいた子どもが思春期に達したとき、子どもの統合失調症発症率は通常の約2倍になったと報告されています。同様の事象は中国でも報告されています。このように疫学研究からは、胎児期の栄養不良が統合失調症の発症しやすさの基盤形成に関連すると考えられています。しかし、このような疫学的データと精神疾患をつなぐ「分子」や「介在する生物学的メカニズム」の手がかりは不明でした。
統合失調症と栄養との関連については、脂肪酸が要因の一つといわれています。脂肪酸は生体にとって必要不可欠な栄養素であり、あらゆる生命現象に関与します。特に多価不飽和脂肪酸であるリノール酸(n-6系)、α-リノレン酸(n-3系)は必須脂肪酸として知られ、不足すると皮膚障害や不妊、免疫力の低下など、さまざまな障害を引き起こすといわれています。中枢神経系、さらに精神疾患においても、多価不飽和脂肪酸は重要な働きをすると考えられています。例えば、精神疾患患者に対してドコサヘキサエン酸(docosahexaenoic acid、DHA)や(エ)イコサペンタエン酸((e)icosapentaenoic acid、EPA)(両方ともα-リノレン酸から合成することができる)を既存の精神疾患治療薬と共に投与すると症状緩和の増強効果が認められること、統合失調症では赤血球膜や死後脳で多価不飽和脂肪酸が低下していること、気分障害では血中のn-3系多価不飽和脂肪酸が低い患者ほど自殺の危険性が増すことなどが知られています。
一方、共同研究グループは過去に、マウスを用いた研究から、統合失調症患者の一部で障害されていることが知られる「プレパルス抑制[10]」という生理学的な現象を調節する責任遺伝子の一つとして、脂肪酸結合タンパク質の一つをコードする「Fabp7遺伝子[11]」を同定しました注5)。また、ヒトサンプルを用いた解析から、FABP7遺伝子がヒト統合失調症の感受性遺伝子の一つであることを明らかにしました注6)。日本人統合失調症患者で見つかったアミノ酸変化を伴う一塩基多型(SNP)[12]の場所は、多価不飽和脂肪酸が結合する部位の近傍にあることから、アミノ酸変化によって多価不飽和脂肪酸に対する結合能が変わる可能性が考えられました。これらの結果は、FABP7タンパク質と親和性が高い多価不飽和脂肪酸のアラキドン酸(arachidonic acid、AA)およびDHAが疾患感受性に影響を与える可能性があることを示しています。
そこで、共同研究グループは、上述した統合失調症の臨床的・分子遺伝学的知見から、統合失調症の発症しやすさに脳発達期の多価不飽和脂肪酸摂取不良が関与する可能性に着目して解析を行いました。
- 注5):
- Braff et al: Prestimulus effects on human startle reflex in normals and schizophrenics. Psychophysiology, 15(4): 339-343, 1978.
- 注6):
- Watanabe et al: Fabp7 maps to a quantitative trait locus for a schizophrenia endophenotype. PLoS Biol, 5(11): e297, 2007.
2.研究手法と成果
共同研究グループはまず、母マウスに対して、妊娠2週間前から離乳期の生後3週間まで、AAとDHAを欠乏させた食餌(AA/DHA欠乏食)またはAA/DHA含有食餌(AA/DHA含有食)を投与し、仔に対する影響を多角的に検討しました。仔は母親の胎盤や母乳を介して、間接的にこれらの特別食に影響されます。実際に、特別食の影響は、母マウスの母乳中や生後の仔マウス脳内の多価不飽和脂肪酸濃度の変化として現れていました。離乳後は通常食を摂取させました。仔が成体になった段階(8週齢以降)で、AA/DHA欠乏食群とAA/DHA含有食群との比較を行いました(図1A)。
精神疾患に関連する行動実験を系統的に行った結果、AA/DHA欠乏食群では、AA/DHA含有食群と比較して、自発活動量の低下や、尾懸垂テスト[13]での無動時間の延長など、意欲の低下や抑うつ状態を示す行動変化がみられました。さらに、ヒトに投与した場合に精神疾患でみられるような幻覚を引き起こす物質(NMDA受容体阻害薬[14])を両群のマウスに投与したところ、AA/DHA欠乏食群ではこの薬剤に対する感受性が著しく高まっていました。これらの行動変化は、意欲の低下や抑うつ状態を伴った統合失調症の前駆状態(統合失調症のごく初期の状態)に類似したものと考えられました(図1B)。
このようなAA/DHA欠乏食群における行動変化が、マウス脳内のどの領域の異常によって起きるのかを調べるために、マウスの行動中に活動する脳領域を可視化できるマンガン造影MRI[15]を行ったところ、AA/DHA欠乏食群では、AA/DHA含有食群と比較して、統合失調症との関連が報告されている大脳皮質前頭前野や側坐核[16]といった脳の領域で神経活動が亢進していました(図1C)。さらに、神経活動の変化が見られた大脳皮質前頭前野について網羅的遺伝子発現解析を行ったところ、AA/DHA欠乏食群では、AA/DHA含有食群と比較して、「オリゴデンドロサイト系遺伝子群およびGABA系遺伝子群の発現低下」が認められました。これらの変化は統合失調症患者の死後脳解析による報告に類似しています(図1D)。
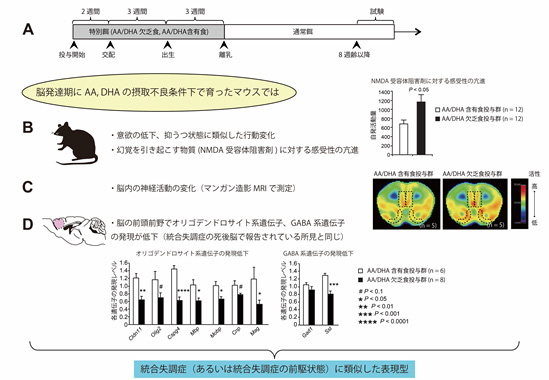 図1 AA/DHA欠乏食投与マウスが示した統合失調症に類似した表現型
図1 AA/DHA欠乏食投与マウスが示した統合失調症に類似した表現型
B.Aの2群に精神疾患に関連する行動実験(自発活動量、尾懸垂テスト)を行った結果と、幻覚を引き起こす物質(NMDA受容体阻害薬)を投与した結果。
C.Aの2群にマンガン造影MRIを行ったところ、AA/DHA欠乏食群では、AA/DHA含有食群と比較して、黒の破線で囲まれた大脳皮質前頭前野や側坐核で神経活動が亢進していた。
D.大脳皮質前頭前野(ピンク色の部分)についての網羅的遺伝子発現解析により、AA/DHA欠乏食群では、AA/DHA含有食群と比較して、オリゴデンドロサイト系遺伝子群およびGABA系遺伝子群の発現低下が認められた。
共同研究グループは、AA/DHA欠乏食群の大脳皮質前頭前野において数多くの遺伝子の発現変化が認められたことから、これらの遺伝子の上流に共通の転写因子[17]が働く可能性を考えました。そこで、オリゴデンドロサイト系遺伝子およびGABA系遺伝子のプロモーター領域の配列を調べたところ、転写因子の一種である核内受容体(Rxr、Ppar)が認識する共通配列があることが分かりました(図2 ④)。AA/DHA欠乏食群の前頭前野において核内受容体遺伝子の発現を調べると、核内受容体遺伝子(RxrサブタイプのRxra, RxrbおよびPparサブタイプのPpara, Pparb/d)の発現が低下していること(図2 ②、②’および③、③’)、これらの核内受容体遺伝子の発現とオリゴデンドロサイト系遺伝子およびGABA系遺伝子の発現が強く相関していることが分かりました(図2 ⑤)。
また、培養細胞に核内受容体の作動薬(Rxrの一連のサブタイプを活性化するbexarotene、Pparの一連のサブタイプを活性化するbezafibrate)を添加すると、オリゴデンドロサイト系遺伝子およびGABA系遺伝子の発現が誘導されることが明らかになりました。さらに、Rxr作動薬bexaroteneを野生型マウスに投与すると、大脳皮質前頭前野で一部のオリゴデンドロサイト系遺伝子の発現が誘導されることも明らかになりました。これらの結果は、マウスの大脳皮質前頭前野において、核内受容体(Rxra、Ppara)が、オリゴデンドロサイト系遺伝子およびGABA系遺伝子の発現を制御していることを示しています。また、bexaroteneをあらかじめ投与したマウスでは、幻覚を引き起こす物質(NMDA受容体阻害薬)に対する感受性が抑えられることも分かりました(図2)。
核内受容体遺伝子の中でもAA/DHA欠乏食群で特に変化が大きかったRxra、Pparaの発現低下のメカニズムを検討する目的で、AA/DHA欠乏食群の大脳皮質からDNAを抽出し、両核内受容体遺伝子のプロモーター領域のCpGサイト[7]におけるDNAメチル化状態を調べたところ、AA/DHA含有食群と比較して、DNAメチル化の程度が高いことが分かりました(図2 ①、①’)。一般に、遺伝子のプロモーター領域がメチル化されると、当該遺伝子の発現が低下すると考えられています。
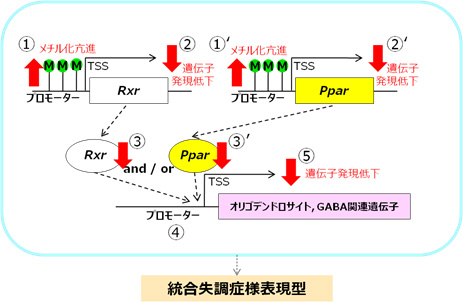 図2 核内受容体パスウェイと統合失調症様表現型の関連
図2 核内受容体パスウェイと統合失調症様表現型の関連
- ①、①’:AA/DHA欠乏食投与マウスでは、Rxr遺伝子、Ppar遺伝子のプロモーター領域でDNAメチル化の程度が高くなっていることが分かった(赤↑)。
- ②、②’および③、③’:AA/DHA欠乏食投与マウスでは、Rxr遺伝子、Ppar遺伝子の発現が低下していた(赤↓、②,②’はmRNA, ③,③’はタンパク)。
- ④:オリゴデンドロサイト系遺伝子およびGABA系遺伝子のプロモーター領域に、転写因子の一種である核内受容体(Rxr、Ppar)の認識共通配列(破線矢印の先の部分)がある。TSSは転写開始点を示す。
- ⑤:AA/DHA欠乏食投与マウスでは、Rxr遺伝子、Ppar遺伝子の発現低下に相関してオリゴデンドロサイト系遺伝子およびGABA系遺伝子の発現も低下していること(赤↓)も分かった。
また、統合失調症患者から採取した毛根細胞[18](脳の細胞と発生学的な起源が同一であり、多くの遺伝子が脳と共通して発現している)を用いて遺伝子発現解析を行い、健常者の毛根細胞と比較して核内受容体遺伝子(RXRA、PPARA)の発現が低いことも確認しました。これらの結果は、統合失調症の病態メカニズムに、核内受容体遺伝子(RXRA、PPARA)が深く関与することを示していると考えられました。
これらのマウスとヒトの研究結果を総合して考えると、「脳発達期のAA/DHA摂取不足は、核内受容体遺伝子(RXRA、PPARA)のプロモーター領域のメチル化レベル上昇とそれに伴う核内受容体遺伝子機能の低下を引き起こすことで、下流のオリゴデンドロサイト系遺伝子およびGABA系遺伝子の発現を低下させ、結果として統合失調症のなりやすさの基盤を形成する」というメカニズムが強く示唆されます。
3.今後の期待
胎児期に低栄養状態を経験すると、成人後に統合失調症が生じやすくなることが知られていますが、その分子メカニズムを明らかにした報告はこれまでありませんでした。本研究により、初めて栄養(多価不飽和脂肪酸)と精神疾患発症メカニズムの関係を分子レベルから説明する手がかりを得られたと考えられ、学問的に大きな意義があるといえます。
また、今回の研究により、今まで精神疾患に対する創薬の対象となってこなかった核内受容体(RXR、PPAR)が統合失調症のメカニズムと関連している可能性が浮上しました。実際、動物レベルでは、RXR作動薬であるbexaroteneの投与が統合失調症モデルマウスの行動変化を改善したことから、今後、核内受容体(RXR、PPAR)を標的とした新しい統合失調症治療薬あるいは予防薬の開発が期待できます。
4.論文情報
- タイトル:
- Polyunsaturated fatty acid deficiency during neurodevelopment in mice models the prodromal state of schizophrenia through epigenetic changes in nuclear receptor genes
- 著者名:
- Motoko Maekawa, Akiko Watanabe, Yoshimi Iwayama, Tetsuya Kimura, Kei Hamazaki, Shabeesh Balan, Hisako Ohba, Yasuko Hisano, Yayoi Nozaki, Tetsuo Ohnishi, Manabu Toyoshima, Chie Shimamoto, Kazuya Iwamoto, Miki Bundo, Noriko Osumi, Eiki Takahashi, Akihiko Takashima, Takeo Yoshikawa
- 雑誌:
- ATranslational Psychiatry
- DOI:
- 10.1038/tp.2017.182
5.補足説明
- [1]脂肪酸、多価不飽和脂肪酸:
- 脂肪酸は長鎖炭化水素の1価のカルボン酸である。二重結合の数により大きく三つに分類されるが、二重結合がないものを飽和脂肪酸、二重結合が一つのものを一価不飽和脂肪酸、二重結合を二つ以上含むものを不飽和脂肪酸と呼ぶ。多価不飽和脂肪酸は、二重結合の位置によってn-6系多価不飽和脂肪酸(メチル基末端から6番目の結合が二重結合になっている)、n-3系多価不飽和脂肪酸(メチル基末端から3番目の結合が二重結合になっている)に分類される。アラキドン酸(arachidonic acid, AA)はn-6系多価不飽和脂肪酸で、別のn-6系多価不飽和脂肪酸のリノール酸から合成される。ドコサヘキサエン酸(docosahexaenoic acid, DHA)はn-3系多価不飽和脂肪酸で、別のn-3系多価不飽和脂肪酸のα-リノレン酸から合成される。
- [2]大脳皮質前頭前野:
- 前頭葉の一部で、認知機能、作業記憶に関する部位といわれている。統合失調症ではこの部位が適切に活動していない可能性が指摘されている。
- [3]オリゴデンドロサイト:
- 神経細胞の軸索に巻き付いて、髄鞘(ミエリン鞘)を形成するグリア細胞。神経細胞の正常な機能維持に寄与している。
- [4]GABA(γ-アミノ酪酸):
- 神経細胞の軸索や樹状突起の先端に観察される扇状の構造物。神経突起のガイダンスにおいて主要な役割を果たすことが知られ、軸索先端の成長円錐はやがて、標的となる神経細胞の樹状突起に接近して形態変化を引き起こし、シナプスを形成することが知られています。
- [5]核内受容体:
- 低分子の脂溶性物質が結合することにより、転写因子([17]参照)として働く細胞内タンパク質のファミリーで、共通するタンパクドメイン構造を持っている。ヒト核内受容体の一種であるRXR、PPARについては、脂肪酸がリガンドの一つになることが分かっている。
- [6]プロモーター領域:
- 各遺伝子の上流に存在する転写開始に関与するDNA上の領域。転写因子群が結合することにより、各遺伝子の転写が開始される。
- [7]DNAメチル化、CpGサイト:
- DNA中のCpGサイト(シトシンの次にグアニンが現れる2塩基配列、5'-CG-3')のシトシン塩基に、メチル基(-CH3)が付加する化学反応。遺伝子のプロモーター領域が高メチル化状態となった場合、プロモーターは不活性化状態となり、その遺伝子の転写が抑制される。
- [8]エピジェネティック変化:
- DNAの塩基配列の変化を伴わない遺伝子の分子修飾のことを指す。この変化が起こることにより、遺伝子の発現量が変化することが知られている。DNAメチル化は、エピジェネティク変化の一つである。
- [9]核内受容体作動薬:
- リガンド依存的な転写因子である核内受容体を活性化する物質を指す。本研究では、RXRの作動薬としてbexarotene、PPARの作動薬としてbezafibrateを用いた。Bexaroteneは皮膚T細胞生リンパ腫の治療薬として、bezafibrateは高脂血症の治療薬として臨床で使用されている。
- [10]プレパルス抑制:
- 周囲の不必要な雑音などを意識に上がらないようにシャットアウトする感覚フィルター機能を反映する指標と考えられている。プレパルス抑制は、統合失調症患者で低下していることが知られているが、げっ歯類でもヒトと同様の評価方法で測定できることから、統合失調症モデル動物の評価によく用いられている。
- [11]Fabp7遺伝子:
- 脂肪酸結合タンパク質(fatty acid binding protein, Fabp)は、14-15kDaの低分子タンパク質で、主に細胞質に存在し、多価不飽和脂肪酸の取り込みや輸送、核内受容体と複合体を形成して他の遺伝子の発現調節に関わるといわれている。特にFabp7は別名「脳型」脂肪酸結合タンパク質と呼ばれ、胎生期から生後初期の脳に多く発現することが分かっている。
- [12]一塩基多型(SNP):
- ヒトゲノムの個人間の違いのうち、集団での頻度が1%以上のものを遺伝子多型と呼ぶ。代表的なものとして、ヒトゲノム塩基配列上の一カ所が変化して生じる一塩基多型(Single Nucleotide Polymorphism:SNP)がある。
- [13]尾懸垂テスト:
- 7分間、マウスの尾を固定してぶら下げ、不動時間の長さを測り、回避意欲の程度を評価するテスト。
- [14]NMDA受容体阻害薬:
- NMDA(N-methyl-D-aspartate)型受容体はグルタミン酸受容体の一つで、記憶や学習などの脳機能に深く関わることが知られている。NMDA受容体阻害薬をヒトに投与すると統合失調症に類似した症状を引き起こすことから、NMDA受容体阻害薬を投与したマウスを「統合失調症モデルマウス」として使用することがある。
- [15]マンガン造影MRI:
- 神経細胞の活性化を検出する脳機能の核磁気共鳴画像法。マウスにマンガンを投与すると、神経細胞が活性化する際に、事前に投与したマンガンイオンが細胞内に流入する。神経細胞に流入したマンガンイオンは細胞内に一定時間止まるため、MRI撮影することにより活性化した脳領域を可視化できる。MRIはmagnetic resonance imagingの略。
- [16]側坐核:
- 大脳辺縁系の一部であり、意欲などに関与しているといわれている。大脳皮質前頭前野皮質から側坐核にグルタミン酸作動性神経が投射している。
- [17]転写因子:
- 遺伝子の発現を制御するタンパク質。多くはDNAとの結合部位を持ち、標的遺伝子のエンハンサー、プロモーター、サイレンサーなどの配列に結合して、標的遺伝子の発現を増強または抑制する。
- [18]統合失調症患者から採取した毛根細胞:
- ヒト毛根細胞は、脳の細胞と発生学的な起源が同一であり、多くの遺伝子が共通して発現していることから、統合失調症診断法開発のための新たな生体試料として期待されている。共同研究グループは、過去にヒト毛根細胞を用いて、統合失調症診断マーカーの検索を行った実績がある。
- 詳細は2014年9月12日プレスリリース
6.発表者・機関窓口
発表者 ※研究内容については発表者にお問い合わせ下さい
理化学研究所 脳科学総合研究センター 分子精神科学研究チーム
チームリーダー 吉川 武男(よしかわ たけお)
研究員 前川 素子(まえかわ もとこ)
TEL:048-467-5968(直通)または048-462-1111(内線7634)
FAX:048-467-7462
E-mail:mmaekawa“AT”brain.riken.jp(前川)
E-mail:takeo“AT”brain.riken.jp(吉川)
機関窓口
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press“AT”riken.jp
AMED事業について
日本医療研究開発機構 戦略推進部 脳と心の研究課
〒100-0004 東京都千代田区大手町1-7-1 読売新聞ビル22F
TEL:03-6870-2222 FAX:03-6870-2244
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成29年9月5日
最終更新日 平成29年9月5日


