酸化還元制御因子システインパーサルファイド及び グルタチオンパーサルファイド生合成経路の解明―精神・神経疾患治療等応用に期待―
プレスリリース
国立研究開発法人国立精神・神経医療研究センター
国立研究開発法人日本医療研究開発機構
国立研究開発法人国立精神・神経医療研究センター(NCNP、東京都小平市 理事長:水澤英洋)神経研究所(所長:武田伸一)の木村英雄らのグループは、明治薬科大学教授小笠原裕樹、ルイジアナ州立大学教授David Leferとの共同研究により、新規酸化還元制御因子システインパーサルファイド(Cys-SSH)とグルタオンパーサルファイド(GSSH)が、3-メルカプトピルビン酸転移酵素(3MST)によって生合成されることを明らかにしました。これまで、細胞内還元環境恒常性を担う分子はシステイン(Cys-SH)やグルタチオン(GSH)と考えられていました。最近では、これら分子にさらにS原子が付加(過硫化)されたCys-SSHやGSSHがより強力な還元作用を持つことから、これら過硫化体が還元環境恒常性を担っていると考えられるようになってきました。しかし、その生合成酵素については不明でした。本研究において、硫化水素(H2S)やその過硫化体であるポリサルファイド(H2S2, H2S3)を生合成する3MSTが、Cys-SSHやGSSH、さらには、タンパクの過硫化(R-SSH)も行うことが明らかとなりました。
シグナル分子H2Sの過硫化体H2S2、H2S3がシグナル分子に加わり、近年、過硫化物の生理的役割が注目されています。必須アミノ酸Cys-SHや生体内抗酸化物質GSH、そしてタンパク質も例外ではありません。最初に提案されたのはGSHでした。呼吸における電子伝達系に不可欠な因子チトクロムcは、電子の授受によって還元型と酸化型を行き来します。その酸化型を還元するのはGSHと考えられていました。ところが、GSSHやCys-SSHがより効率よく還元することがわかったのです。その生合成については、2つの経路が提案されましたが、いずれも生理的に機能することが困難であると指摘され、生合成経路の同定が待たれていました。
過硫化によって活性が制御されているタンパクの例として、パーキンソン病の原因タンパク、パーキンが挙げられます。過硫化によって活性が上昇し、神経細胞を保護します。健常人脳では、パーキンは過硫化されており、患者脳では過硫化が減少していることが報告されています。
3MST欠損はヒトでは精神遅滞が起こり、動物モデルではセロトニン系神経異常と不安症状が認められています。また、3MSTはtRNA合成に関わっていることが報告されています。
今後、抗不安薬・抗精神薬、パーキンソン病などの神経疾患への応用も期待されます。
本研究成果は、日本時間2017年9月5日午後6時(報道解禁日時:イギリス時間9月5日午前10時)に、Nature Publishing の英国オンライン科学雑誌「Scientific Reports(サイエンティフィック・リポーツ誌)」に掲載されます。
硫化水素(H2S)の研究経緯について
研究の背景
本研究グループは、H2SよりもS数の多いH2SnがTRPチャネルを活性化する新規シグナル分子であることを2006年に発見し、2015年にその生合成酵素が3MSTであることを報告しました(*1、2、3、4)。3MSTは、本研究グループがH2S合成酵素として2009年に発表したもので、このとき細胞内の過硫化分子レベルが高くなることも報告していました(*5)。
1971年にMassay らは、強力な還元力を示すCys-SSH、GSSHが、これまでCys-SHやGSHが担っていると考えられていた細胞内酸化還元反応を行う分子実態である可能性を指摘していました(*6)。その生合成については、1960年にCavalliniらが、現在ではH2S合成酵素の1つとして知られているcystathionine g-lyase (CSE)がシスチンを基質としてCys-SSHを合成することを報告していました(*7)。その後、Idaらは、もう1つのH2S合成酵素cystathionine b–synthase (CBS)もシスチンを基質としてCys-SSHを合成することを2014年に報告しました(*8)。しかし、CSEもCBSも共に細胞質に局在する酵素であり、細胞質にシスチンは存在せず、システインとして存在することから、CSEとCBSがCys-SSHを合成するとは考えにくいとBanerjeeらが反論し(*9)、生合成酵素の同定が待たれていました。
- *1(引用元)
- Nagai, Y., Tsugane, M., Oka, J.-I., Kimura, H. Polysulfides induce calcium waves in rat hippocampal astrocytes. J Pharmacol Sci 100, 200 (2006).
- *2(引用元)
- Oosumi, K., Tsugane, M., Ishigami, M., Nagai, Y., Iwai, T., Oka, J-I., Kimura, H. Polysulfide activates TRP channels and increases intracellular Ca2+ in astrocytes. Neurosci Res 68, e109-e222 (2010).
- *3(引用元)
- Kimura, Y., Mikami, Yl, Osumi, K., Tsugane, M., Oka, J-I., Kimura, H. Polysulfides are possible H2S-derived signaling molecules in rat brain. FASEB J 27, 2451-2457 (2013).
- *4(引用元)
- Kimura, Y., Toyofuku, Y., Koike, S., Shibuya, N., Nagahara, N., Lefer, D., Ogasawara, Y., Kimura, H. Identification of H2S3 and H2S produced by 3-mercaptopyruvate sulfurtransferase in the brain. Sci. Rep. 5: 14774 (2015).
- *5(引用元)
- Shibuya, N., Tanaka, M., Yoshida, M., Ogasawara, Y., Togawa, T., Ishii, K., Kimura, H. 3-Mercaptopyruvate sulfurtransferease produces hydrogen sulfide and bound sulfane sulfur in the brain. Antioxid Redox Signal 11, 703-714 (2009).
- *6(引用元)
- Massey V, Williams CH, Palmer G. The presence of S0-containing impurities in commercial samples of oxidized glutathione and their catalytic effect in the reduction of cytochrome c. Biochem Biophys Res Commun 42, 730-738 (1971).
- *7(引用元)
- Cavallini, D., Marco, C.D., Mondavi, B., Mori, B.G. The cleavage of cystine by cystathionase and the transulfuration of hypotaurine. Enzymologia 22, 161-173 (1960).
- *8(引用元)
- Ida T, Sawa T, Ihara H, Tsuchiya Y, Watanabe Y, Kumagai Y, Suematsu M, Motohashi H, Fujii S, Matsunaga T, Yamamoto M, Ono K, Davarie-Baez NO, Xian M, Fukuto JM, Akaike T. Reactive cysteine persulfides and S-polythiolation regulate oxidative stress and redox signaling. Proc Natl Acad Sci USA 111: 7606-7611 (2014).
- *9(引用元)
- Yadav, P.K., Martinov, M., Vitvitsky, V., Seravalli, J., Wedmann, R., Filipovic, M.R., Banerjee, R. Biosynthesis and reactivity of cysteine persulfides in signaling. J. Am. Chem. Soc. 138, 289-299 (2016).
研究内容
今後の展望
用語説明
- システインパーサルファイド、グルタチオンパーサルファイド:
- システイン、グルタチオンのチオール(-SH)が過硫化され(-SSH)となっている化合物。それぞれシステイン、グルタチオンよりも還元力が強く、生体中では、これら過硫化体が酸化還元反応に関わっている分子実態である可能性が示唆されている。
- ポリサルファイド(H2Sn):
- H2SよりもSの数が多い化合物。常温ではH2Sのようなガスとしては存在しない。ポリサルファイドが脳内でも微量に生成されていることが分かっている。ポリサルファイドはH2Sが酸素によって酸化されても生成される(2nH2S + 1/2(2n-1)O2 H2S2n + (2n-1)H2O )。この経路も3MSTによって触媒される。また、ニューロンを取り囲むアストロサイトのカルシウムイオンチャネルを活性化して、カルシウム流入を促進させ、神経伝達物質を生成することで神経伝達活性化を調整している。
アストロサイトを活性化するポリサルファイドはSが2個から7個まで直鎖状に繋がったもの。この状態で水溶性であるが、8個つながると環状になり不溶性になり機能しないと考えられる。
HS- ↔ HSS- ↔ HSSS- ↔….. HS7- → S8
- Nrf2:
- 転写因子。Keap1と複合体を形成し細胞質に存在するが、刺激により、Keap1から離れて核内に移行し、抗酸化遺伝子群の転写亢進を誘導する。
- TRPA1チャネル:
- Ca2+透過性チャネルで、疼痛などに関わる。
- PTEN:
- 癌抑制因子。
- 3MST:
- 細胞質およびミトコンドリアに存在し、3MPを基質としてH2SやH2Snを合成する酵素。
tRNA合成にも関与している。
挿入図と解説
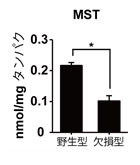
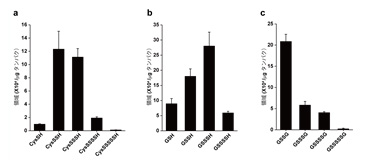
3MST欠損マウス脳内Cys-SSH, GSSH, R-SSH, H2Snレベルは、野生型マウス脳に比較して、顕著に低い。
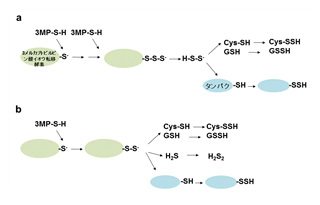
生合成メカニズムとして、3MSTが基質3メルカプトピルビン酸(3MP)からH2S2やH2S3を生合成し、それがCys-SH, GSH, R-SHと反応し、Cys-SSH, GSSH, R-SSHができる。3MSTが3MPから直接H2S2, H2S3, Cys-SSH, GSSH, R-SSHを合成するというメカニズムと、この両者を混合したメカニズムも考えられる。
原論文情報
- 論文名:
- 3-Mercaptopyruvate sulfurtransferase produces potential redox regulators cysteine- and glutathione-persulfide (Cys-SSH and GSSH) together with signaling molecules H2S2,H2S3 and H2S.
- 著者:
- Yuka Kimura, Shin Koike, Norihiro Shibuya, David Lefer, Yuki Ogasawara, Hideo Kimura.
- 掲載誌:
- Scientific Reports
- DOI:
- 10.1038/s41598-017-11004-7
助成金
本研究は、木村英雄:JPSP科研費(26460115, 17K08331)、AMED(脳プロ)、上原記念生命科学財団助成金、渋谷典広:JPSP科研費(16K15123)、木村由佳:JPSP科研費(26460352, 17k08613)の助成を受けて行われました。
お問い合わせ先
研究に関するお問い合わせ
木村英雄(きむら ひでお)
国立研究開発法人 国立精神・神経医療研究センター 神経研究所
〒187-8502 東京都小平市小川東町4-1-1
TEL:042-341-2711(代表)
E-mail:kimura“AT”ncnp.go.jp
報道に関するお問い合わせ
国立研究開発法人 国立精神・神経医療研究センター
総務課 広報係
〒187-8551 東京都小平市小川東町4-1-1
TEL:042-341-2711(代表) FAX:042-344-6745
AMED事業に関するお問い合わせ
国立研究開発法人 日本医療研究開発機構(AMED)
戦略推進部 脳と心の研究課
TEL:03-6870-2222 FAX:03-6870-2244
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成29年9月5日
最終更新日 平成29年9月5日


