プレスリリース アルツハイマー病の血液診断法の開発―血液中の極微量のリン酸化タウ蛋白の高感度・精密定量システムを世界で初めて開発―
プレスリリース
日本医療研究開発機構
研究の概要
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の認知症研究開発事業からの委託研究開発費によって行われました(補助事業課題名「アルツハイマー病の既存髄液バイオマーカーの血液および脳由来エクソソームへの展開とそれらを応用した多項目血液マーカーによる診断システムの実用化」、研究代表者: 京都府公立大学法人京都府立医科大学分子脳病態解析学・教授・徳田隆彦)。また、本研究成果の実用化については、グローバルレベルの国内診断機器・試薬メーカーと実用化に向けた共同研究を検討しています。
本研究成果は、オンラインジャーナルである「Molecular Neurodegeneration」誌に、2017年9月4日(月曜日)午後(英国時間)に公開されます。
本研究成果のポイント
- 建部・徳田らは、超高感度デジタルアッセイ技術であるSimoa(Single molecular array; 米国Quanterix社)(注1)を導入して、抗tau抗体を用いたp-tau定量系の測定感度をフェムト(10-15)グラム/mLのオーダー(従来のELISA法の1000倍の感度)まで向上させることに成功し、これまで脳脊建髄液中でしか定量ができなかったp-tau(注2)を、実際のヒト血液中で検出・定量できる定量システムを、世界で初めて開発・報告しました。
- この新規に開発したp-tau定量システムを用いて、実際の患者血液中のp-tauを測定したところ、アルツハイマー病患者およびダウン症候群(注3)患者では、正常対照者と比較して、血液中のp-tauが有意に増加しており、アルツハイマー病の診断に有用であることが判りました。さらに年齢別のダウン症候群患者の検討で、血液p-tauが患者脳に出現する神経原線維変化を反映する可能性が高いことが判りました。以上の結果も、今回の論文で報告しました。
- この数年で、世界的にもアルツハイマー病の診断に有用な血液バイオマーカーの開発研究が非常な競争のもとに行われており、従来脳脊髄液中でしか測定できなかった総タウ蛋白(t-tau)を、血液中で定量できるSimoaのシステムは既に2015年に報告されていました。しかし、血液t-tauでは患者と正常者の間のオーバーラップが大きく診断には使えないことが明らかになっており、よりアルツハイマー病に特異的なp-tauを、血液中で定量できる定量系の開発が世界中で求められていました。今回の報告は、その世界的な開発競争をリードする、最先端の画期的な報告です。
- 今回我々が開発した新規のp-tau定量システムは、採血によってアルツハイマー病の診断が迅速かつ正確にできるようになる可能性があり、日常診療から臨床研究までのすべての局面で、アルツハイマー病の診断過程を革新的に進歩させると考えられます。
研究の背景
研究の内容
1)超高感度のp-tau定量型の開発
2)実際のアルツハイマー病患者、正常対照者の血液サンプルでp-tau定量系の有用性を検討
3)ダウン症候群患者の血液サンプルでのp-tau定量
我々は、さらに、新規のp-tau定量系を用いてダウン症候群患者の血液中p-tauを測定しました。研究代表者の徳田と研究協力者の京都府立医大神経内科の笠井高士講師は、京都府立医大神経内科の外来で30名以上の成人ダウン症候群患者を診療しています。ダウン症候群患者では、アミロイドβ蛋白の遺伝子を正常人の1.5倍保有しているために、成人期になって大脳にアルツハイマー病理が出現することが遺伝的に決定されています。ダウン症候群患者では、一般的に小児期から大脳にアミロイドβ蛋白の蓄積が始まりますが、40歳代でその蓄積量が急に増加し、それによって大脳にp-tauから構成される神経原線維変化が出現し始めると、臨床的に認知症が始まります。我々は、年齢別のダウン症候群患者の血液を調べることで、このような脳病理の進展状況と血液中p-tauの関係を検討しました。その結果、ダウン症候群患者グループでは、年齢を合致させた正常対照グループと比較して、血液p-tau値が統計学的に有意に高値でした(p=0.0332)。また、血液p-tau値はダウン症候群患者の年齢と正の相関がありました(R2=0.4451, p=0.0013)(図6)。さらに、血液p-tau値が非常に高い値(> 1.0 pg/mL)を示したダウン症候群患者は全員が40歳以上でした。これらの結果から、我々が新規に開発したp-tau定量系で測定した血液p-tau値は、認知症の責任病変となる大脳のアルツハイマー病理(神経原線維変化の出現)を反映するバイオマーカーになると考えられました。
以上の1)2)3)の結果を主な内容として、「Molecular Neurodegeneration」誌(オンラインジャーナル, 2016/2017 Impact Factor: 6.78)に、今回の研究成果を発表しました。
まとめと今後の展開
今回の研究は、アルツハイマー病に特徴的な脳病理であり、また認知症発症の10年以上前から蓄積しはじめるAβ42とは異なり、より認知症の発症が近づいてきた時期から脳に蓄積し始め、その大脳内での広がりが認知症の発症と直接的に関連していることがわかっている大脳でのリン酸化タウの蓄積を、血液バイオマーカーを用いて診断できることを世界で最初に示した画期的な研究成果です。この数年、世界的にもアルツハイマー病研究の領域では、血液バイオマーカーの開発研究が活発かつ非常な競争のもとに行われています。その一つの結果として、従来髄液中でしか測定できなかった総タウ蛋白(t-tau)を、血液中で定量できるSimoaの定量系は既に2015年に報告されていました。しかし、血液t-tauではアルツハイマー病患者と正常者での測定値にオーバーラップが大きく、それが実際のアルツハイマー病の診断には使えないことが明らかになっています。したがって、よりアルツハイマー病に特異的なp-tauを、血液中で定量できる測定系の開発が世界中で求められていました。今回の報告は、AMEDからの研究費の支援を受けて行ったアルツハイマー病の血液バイオマーカーを開発・検証する研究プロジェクト(長寿・障害総合研究事業[認知症研究開発事業]: 「アルツハイマー病の既存髄液バイオマーカーの血液および脳由来エクソソームへの展開とそれらを応用した多項目血液マーカーによる診断システムの実用化」研究[研究代表者: 徳田隆彦])の最初の成果であり、世界的な血液バイオマーカー開発競争をリードする、最先端の画期的な報告です。
今後は、今回開発した血液p-tau定量系の有用性を、より大規模な患者コホートで、横断的・縦断的に採取した多数の血液検体で検証する必要があります。このような、今後の大規模試験で我々の血液p-tau定量系の有用性が検証されれば、それによってアルツハイマー病の診断を、客観的・効率的に、かつ、これまでとは比較にならないくらい非侵襲的かつ安価に行うことが可能になります。例えば、我々の定量系は、一般人口の多数の高齢者を対象にした認知症健診においては、煩雑な記憶テストなどの神経心理学的検査を行う前に施行できる迅速スクリーニング検査として用いることができます。また、今後開発されることが予想される新規の根本治療薬の開発研究でもその臨床治験においては、治験にエントリーする患者のより客観的なスクリーニング検査が可能になり、PET検査などの高額な診断用検査の適用患者数を減らすことができるために、新薬の開発コストを大幅に減少させることができます。これら応用例のように、今回我々が開発したヒト血液でp-tauの定量が可能な新規定量系は、認知症の日常診療から臨床研究までのすべての局面で、アルツハイマー病の診断過程を革新的に進歩させることが可能になると考えられます。
用語解説
- (注1)Simoa:
- Single molecular arrayの略で、2010年に発表された極微量タンパク質の定量技術(図4も参照)。従来からバイオマーカーの定量に用いられていたELISA法などと同様に、捕捉抗体と検出抗体のサンドイッチ法により標的抗原を検出するが、捕捉抗体がビーズに固定化されており、そのビーズが一分子だけ入るような微小なウェルにビーズを導入して、検出抗体に結合した酵素による光反応の減衰を最小限にして、極微量の抗原を検出する。この方法により、従来のサンドイッチELISA法で用いていた同じ捕捉抗体と検出抗体のセットを用いても検出の感度を500倍から1000倍に増強することができる。米国Quanterix社がこの技術を製品化している。
- (注2)p-tau:
- phosphorylated tauの略でリン酸化タウ蛋白を意味する。アルツハイマー病患者の脳に出現する異常構造で、その蓄積量と認知症の重症度が相関する神経原線維変化(アミロイド沈着量は認知症と相関しない)は、異常にリン酸化されたタウ蛋白(p-tau)を主成分としている(図2も参照)。とくに、これまでの研究から、タウ蛋白の181番目のアミノ酸であるスレオニン181のリン酸化部位がリン酸化されたp-tau181がアルツハイマー病に特異的であり、アルツハイマー病患者の髄液中では高値になって、アルツハイマー病の診断に高い感度・特異度を有していることが多くの研究で証明されている。これに対して、髄液中の総タウ蛋白(total-tau: t-tau)濃度は、アルツハイマー病患者でも増加するが、その他の疾患(脳梗塞・無酸素脳症や末梢神経障害)でも増加することが知られており、t-tauは非特異的な神経細胞障害を反映する。
- (注3)ダウン症候群:
- ダウン症候群患者はアミロイドβ蛋白の前駆体蛋白遺伝子が存在する21番染色体がトリソミーになっているために、アミロイドβ蛋白を正常人の1.5倍産生する。そのために、ダウン症候群患者では、成人期になって大脳にアルツハイマー病理が出現することが遺伝的に運命づけられている。歴史的に見ても、アルツハイマー病研究では、このようなダウン症候群に出現するアルツハイマー病の脳病理を研究の対象にして、ヒト脳に出現するアルツハイマー病理変化の時系列を決定できた、という事実がある。ダウン症候群患者では、一般的に小児期から大脳にアミロイドβ蛋白の蓄積が始まるが、40歳代でその蓄積量が急に増加し、それによって大脳にp-tauから構成される神経原線維変化が出現し始めると、臨床的に認知症が出現する。本研究で我々は、これまでのアルツハイマー病研究の歴史にならい、年齢別のダウン症候群患者の血液を調べることで、このようなアルツハイマー病関連脳病理の進展状況と血液中p-tauの関係を検討した。
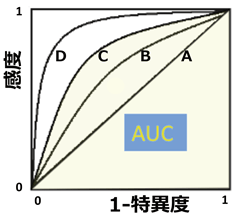
- (注4)ROC曲線、AUC値:
- ROC曲線(Receiver Operating Characteristic curve)は、もともとレーダーシステムの通信工学理論として開発されたものであるが、臨床研究では、しばしば診断検査の有用性を検討する手法として利用されている。具体的には、ROC曲線は縦軸に陽性率(=感度)、横軸に偽陽性率(=[1-特異度])をプロットして線で結んだもので、AUCはArea under the curve の略で曲線下の面積を示しており0.5-1.0の値を取る(下図)。診断用検査の結果判定において、感度が上がるようにカットオフ値を低く設定すると特異度は下がるので、感度と特異度は相殺する。ROC曲線では、全く診断能がなく結果がランダムな検査は下図のAのように対角線となりAUC値は0.5であり、感度・特異度ともに高い場合にはROC曲線は左上方に位置することになり、AUCは1に近い値を取る。一般的には、このAUC値の大きさで、検査の診断能の優劣を判定する(下図での診断能はA<B<C<D)。
参考図
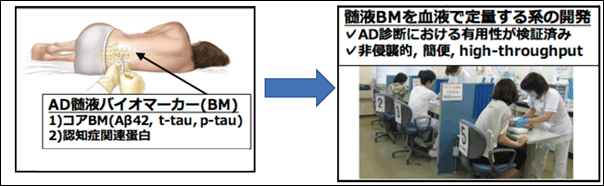
図1.確立されたアルツハイマー病の髄液コア・バイオマーカーを血液バイオマーカーへ応用
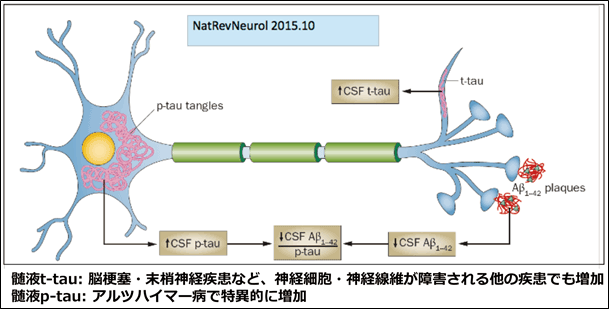
図2.バイオマーカーとしてのt-tau, p-tauが反映するアルツハイマー病の病理変化
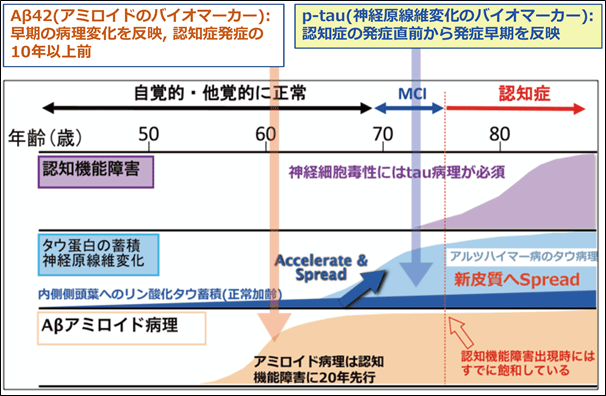
図3.アルツハイマー病の病理変化の時間経過とAβおよびp-tauが異常値を呈するタイミング
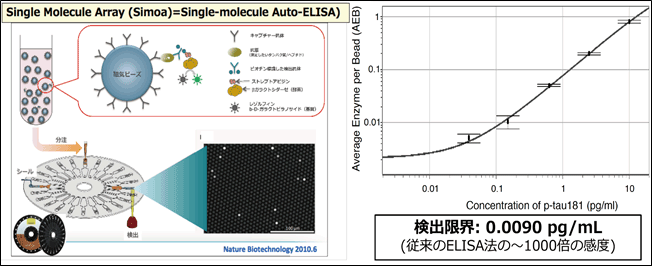
図4.Simoaの原理(左図)と我々が開発したp-tau定量系の標準曲線・検出限界(右図)
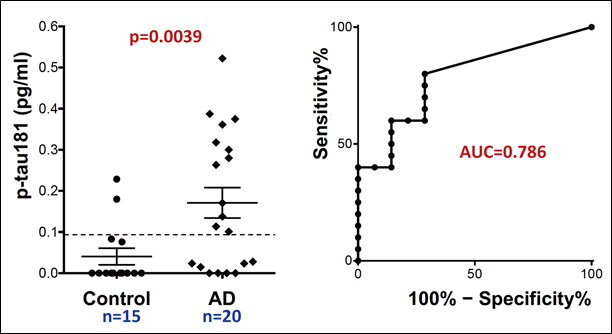
図5.我々が開発したp-tau定量系で測定したアルツハイマー病患者(AD)および正常対照者(Control)の血液中p-tau濃度(左図)、およびp-tau定量系による診断能力を検討するROC曲線(右図)
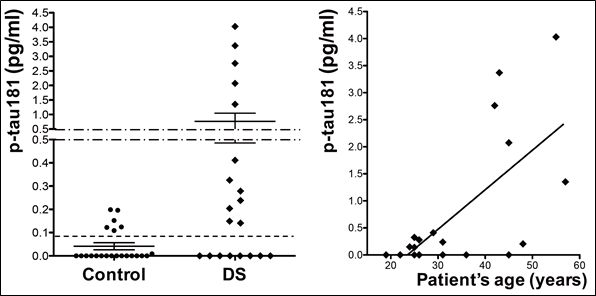
図6.我々が開発したp-tau定量系で測定したダウン症候群患者(DS)および正常対照者(Control)の血液中p-tau濃度(左図)、および患者の年齢と血液中p-tau値の相関(右図)
- 論文名:
- Quantification of plasma phosphorylated tau to use as a biomarker for brain Alzheimer
pathology: pilot case-control studies including patients with Alzheimer's disease andDown syndrome. - ジャーナル名:
- Molecular Neurodegeneration
Impact Factor=6.78 - 著者:
- Harutsugu Tatebe, Takashi Kasai, Takuma Ohmichi, Yusuke Kishi, Tomoshi Kakeya, Masaaki Waragai, Masaki Kondo, David Allsop, Takahiko Tokuda(以上、全員記載)
お問い合わせ先
研究について
京都府立医科大学 分子脳病態解析学
徳田 隆彦(とくだ たかひこ)
TEL:075-251-5793 FAX:075-211-8645
その他:大学広報部門
京都府立医科大学 研究支援課
中尾 麻悠子
TEL:075-251-5275、5208 FAX:075-251-5275
AMED事業について
国立研究開発法人日本医療研究開発機構
戦略推進部 脳と心の研究課
TEL:03-6870-2222 FAX:03-6870-2244
関連リンク
掲載日 平成29年9月5日
最終更新日 平成29年9月5日


