プレスリリース ヒトiPS細胞から3次元的な心臓組織を作製し、致死性不整脈の複雑な特徴を培養下に再現することに成功
プレスリリース
国立研究開発法人日本医療研究開発機構
ポイント
- ヒトiPS細胞から分化誘導した心筋細胞および間葉系細胞(注1)を用いて3次元的な心臓組織を作製した。
- 同3次元心臓組織を使って、致死性不整脈であるトルサード・ド・ポアント(Torsade de Pointes:TdP)(注2)の複雑な特徴を培養下に再現することに初めて成功した。
- これまで不可能であった不整脈の発生を培養下に再現・解析したことにより、新しい安全性薬理試験や創薬研究のほか、難治性不整脈の治療法開発への応用が期待される。
要旨
1.研究の背景
TdPは心臓突然死の原因となる不整脈の一種で、薬の副作用としてしばしば現れることがあります。TdPが副作用として現れたために、薬の開発が中断されたり、既に上市された薬が市場から回収されたりすることもあります。そのため、開発の早い段階で薬の毒性を評価できるヒトの心臓のモデルが求められていました。
これまでiPS細胞から心筋の細胞を誘導し、利用する研究が行われてきました。しかし、単一の細胞では、TdPが起こる前段階であるQT延長(活動電位持続時間の延長)(注3)は再現できましたが、TdPの発生を再現することはできませんでした。そこで本研究グループは、3次元的な心臓組織を作製し組織レベルで病態を模倣することにより、TdPの発生を再現することを目指して研究に取り組みました。
2.研究結果
1)ヒトiPS細胞から3次元の心臓組織モデルを作製した

2)TdPの発生をヒトiPS細胞由来3次元心臓組織で再現した
➀試薬の投与によってTdP様の細胞外電位を得ることに成功した
3次元心臓組織に、細胞表面のイオンチャネル(注7)に作用してQT延長やTdPなどの心臓毒性を呈する試薬E-4031をいろいろな濃度で与えたところ、100nM(注8)までは濃度に比例してQT延長に相当する現象が認められ、100nM以上の濃度ではTdPに特徴的な、形が変化する多形性の頻脈波形を得ることができました(図2)。
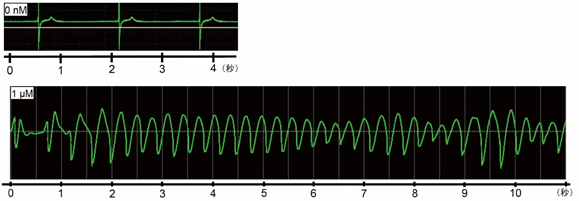
図2 正常な細胞外電位波形(上)および1μM(注9)のE-4031を与えたときに3次元心臓組織モデルが示した細胞外電位波形(下)E-4031を与えたモデルにおいては、通常の心電図波形に類似した一定間隔の均一な波形(上)ではなく、波の数が多くなり(=頻脈)幅広く形や大きさが様々(=多形性)な波形が認められる。
➁TdPに特徴的な興奮波の旋回を可視化した
頻脈性不整脈においては、心臓の電気的な興奮が渦巻き状に旋回し、特にTdPにおいては、その旋回の中心が台風の目のように動き回ると考えられています。この特徴的な動きを捉えて可視化するために、ライブセルモーションイメージングシステム(注10)を用いて細胞の動きを観察し、➀の細胞外電位との同時測定により、実際に興奮波の旋回が起こり、さらにその中心が移動しているかを検討しました。
3次元心臓組織にE-4031を与えたところ、TdP様の細胞外電位波形とともに、興奮波の旋回が起こり、その中心が不規則に移動していることが確認されました(図3)。
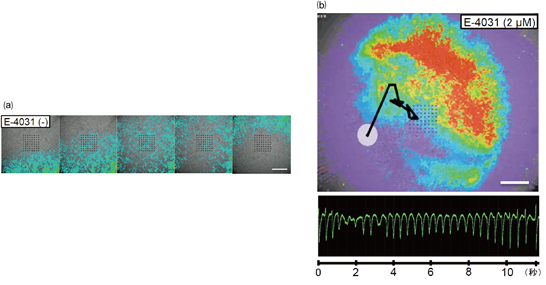
図3 E-4031投与前の心臓の興奮状態の経時変化(a)と、E-4031を2μM投与した後の心臓の興奮状態の軌跡(b)。スケールバーは(a)、(b)ともに1mm。(b)の白円は測定開始時の興奮波の中心、黒線は中心が移動した軌跡を示す。
➂異なる細胞株や試薬でもTdPの発生を再現
上述の3次元心臓組織モデルの作製に使用したものとは異なる、市販のiPS細胞由来心筋細胞を使って同様のモデルを作製しいろいろな濃度のE-4031を投与したところ、同様にTdP様の細胞外電位波形や興奮旋回の中心の不規則な移動が認められました。また、副作用として心臓毒性を呈することが知られているシサプライドという市販薬を投与したところ、TdP様の細胞外電位波形が見られました。
➃TdP発生の必要十分条件-細胞の不均一性と3次元構造-
純粋な心筋細胞だけでは、たとえ3次元的な構造を作ってもTdPは発生しませんでした。心筋細胞と間葉系細胞のような性質の異なる細胞が混在した不均一な構造がTdP発生には必須と考えられました。さらに心筋細胞-間葉系細胞の混合培養においても、2次元培養よりも3次元心臓組織の方がTdPは明らかに高率に発生しました。3次元的になり興奮旋回の中心が動き回れる環境を作ることによって、TdPが長く維持されるようになると考えられました。このように、細胞の不均一性と3次元構造が共存するときにTdPという生理現象が再現されやすくなることが初めて明らかとなりました。
3.まとめ
本研究では、iPS細胞由来の心筋細胞と間葉系細胞を混合してシート状に培養するという簡便な方法で最小限の3次元的心臓組織を作製することに成功しました。それにより従来の細胞レベルでは不可能であった病態モデル、すなわち心臓突然死の原因となる不整脈のTdPを培養下に再現するモデルの構築に成功しました。この成果は、TdPのより詳細なメカニズムの解明や、様々な薬の毒性評価に役立つと期待されます。
4.論文名と著者
- 論文名:
- Modelling Torsade de Pointes arrhythmias in vitro in 3D human iPS cell-engineered heart tissue
- ジャーナル名:
- Nature Communications
- 著者:
- Masahide Kawatou1,2, Hidetoshi Masumoto1,2, Hiroyuki Fukushima1, Gaku Morinaga1,3, Ryuzo Sakata2, Takashi Ashihara4, Jun K Yamashita1*
*責任著者 - 著者の所属機関:
- 京都大学iPS細胞研究所 増殖分化機構研究部門
- 京都大学大学院医学研究科心臓血管外科学
- 日本ベーリンガーインゲルハイム株式会社 神戸医薬研究所
- 滋賀医科大学 循環器内科
5.本研究への支援
本研究は、下記機関より資金その他の支援を受けて実施されました。 国立研究開発法人日本医療研究開発機構(AMED)医薬品等規制調和・評価研究事業における研究開発課題「ヒトiPS分化細胞技術を活用した医薬品の次世代毒性・安全性評価試験系の開発と国際標準化に関する研究」(研究開発代表者:諫田泰成) iHeart Japan株式会社(国立研究開発法人新エネルギー・産業技術総合開発機構(NEDO)イノベーション実用化ベンチャー支援事業) タカラバイオ株式会社 日本ベーリンガーインゲルハイム株式会社
6.用語解説
- (注1)間葉系細胞:
- 組織どうしの間を埋めて結合させるはたらきをもつ細胞。
- (注2)トルサード・ド・ポアント(TdP):
- 心臓突然死の原因となる不整脈の一種。棘のように鋭く尖った心電図波形が連続的に捻れて見えることが特徴。心臓の電気的な異常によって発症するほか、薬の副作用として現れることもある。
- (注3)QT延長(活動電位持続時間の延長):
- 心臓では、心筋の収縮に伴って活動電位が発生する。通常、活動電位は一定の時間をおいて静止電位に戻るが、薬剤などの影響で活動電位の持続時間が長くなると、不整脈が起きやすくなる。
- (注4)温度感受性培養皿:
- 東京女子医科大学 岡野光夫教授、清水達也教授らにより開発された、細胞シート回収技術。独自のナノ表面設計により、温度応答性ポリマー(PIPAAm)を培養皿表面に固定(共有結合)している。この温度応答性ポリマーは32℃以上で疎水性、32℃以下で親水性になるため、培養後32℃以下にすることによりトリプシン処理を行うことなく細胞を回収することができ、細胞生存に必要な細胞外マトリックスを保持したまま(細胞シートのまま)回収することが出来る。このシステムを用いて、すでに心臓・角膜上皮・食道上皮など様々な器官において臨床研究が行われている。
- (注5)線維組織:
- 組織間を満たして、それらを結合・支持する組織の一種。
- (注6)細胞外電位:
- 細胞外電位は、細胞によって生成される細胞の外側の電位であり、電気生理学では、細胞外の微小電極を用いてこの電位を記録する。心電図は、心臓の収縮に伴って発生する心筋の細胞外電位(活動電位)の時間的変化をグラフに記録した波形をいう。
- (注7)イオンチャネル:
- 細胞表面にあるタンパク質で、細胞内外へのイオンの出入りを調節している。心臓の収縮は細胞内外へのイオンの出入りによって引き起こされるので、イオンチャネルがうまく働かないと正常な心臓拍動が維持できなくなる。
- (注8)nM(ナノモーラー):
- 濃度を表す単位。1nMは、1Lに1nmol(ナノモル:分子6.02×1014個)が含まれていることを表す。
- (注9)μM(マイクロモーラー):
- 濃度を表す単位。1μMは、1Lに1μmol(マイクロモル:分子6.02×1017個)が含まれていることを表す。
- (注10)ライブセルモーションイメージングシステム:
- 映像を解析することで、細胞の動きを生きたまま観察する方法。
お問い合わせ先
本研究成果に関するお問合せ先
京都大学iPS細胞研究所(CiRA)
研究支援部門 国際広報室
TEL:075-366-7005
FAX:075-366-7185
E-mail:cira-pr“AT”cira.kyoto-u.ac.jp
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
創薬戦略部 医薬品等規制科学課
TEL:03-6870-2235
FAX:03-6870-2246
E-mail:kiseikagaku“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 平成29年10月23日
最終更新日 平成29年10月23日


