プレスリリース 多能性幹細胞を用いて胎児腎臓の高次構造を再現ー腎臓の再生に向け前進ー
プレスリリース
熊本大学
国立研究開発法人日本医療研究開発機構
ポイント
- 胎児の腎臓を構成する3種類の細胞集団、「ネフロン前駆細胞」、「尿管芽」、「間質前駆細胞」のうち、ネフロン前駆細胞以外は多能性幹細胞からの作製法が確立されておらず、これまで腎臓本来の「高次構造」を再現することは困難であった。
- マウスを用いて尿管芽の発生過程を詳細に解析することによって、マウスES細胞およびヒトiPS細胞から尿管芽を人工的に誘導する方法を確立した。
- マウスES細胞から別々に誘導した尿管芽とネフロン前駆細胞を、マウス胎仔の間質前駆細胞と組み合わせることで、胎児の腎臓に特徴的な「高次構造」をもつ腎組織が再現された。
- 遺伝子変異を導入したヒトiPS細胞から尿管芽を作製することによって特定の遺伝子変異による尿管芽の形成異常が観察された。
- 多能性幹細胞からの腎臓作製・再生応用研究に向けた基盤戦略を示すとともに、ヒトの遺伝子異常による病態解析に貢献することが期待される。
要旨
胎児の腎臓は、「ネフロン前駆細胞」、「尿管芽」、「間質前駆細胞」と呼ばれる大きく分けて3種類の前駆細胞群※1が互いに作用しあうことによってその立体構造(高次構造)を形成します。熊本大学発生医学研究所の研究グループ(太口敦博助教、西中村隆一教授ら)はこれまでに、マウスES細胞※2およびヒトiPS細胞※3といった多能性幹細胞※4からネフロン前駆細胞を誘導する方法を確立していました。これにより、多能性幹細胞からネフロン前駆細胞を経て、糸球体や尿細管を含むネフロンと呼ばれる腎臓を構成する「小構造」を作製することに成功していましたが、その他の前駆細胞が含まれないために腎臓本来の「高次構造」の再現はできていませんでした。そこで、同グループは今回、特にネフロン同士の接続や配置といった腎臓の立体構造の秩序形成に特に重要な役割を果たす「尿管芽」に注目し、多能性幹細胞から尿管芽を誘導する方法の開発を行い、腎臓の高次構造の再現に成功しました。
これらの成果は、腎臓という複雑な臓器の形を試験管内でどのように再現するかという課題に対する基盤的戦略を提示するとともに、その実現可能性を示したものです。また、この技術を用いることで、先天性腎疾患を中心とした遺伝子異常に伴う腎臓の病態を再現できる可能性があり、病因の解明と創薬開発に繋がることも期待されます。
本研究成果は、科学雑誌「Cell Stem Cell」オンライン版に11月9日 正午(アメリカ東部時間)【日本時間の11月10日 2:00 AM】に掲載されます。
本研究は、文部科学省科学研究費補助金(基盤研究(S)、若手研究(B))及びAMED再生医療実現拠点ネットワークプログラムの支援を受けました。
これらの成果は、腎臓という複雑な臓器の形を試験管内でどのように再現するかという課題に対する基盤的戦略を提示するとともに、その実現可能性を示したものです。また、この技術を用いることで、先天性腎疾患を中心とした遺伝子異常に伴う腎臓の病態を再現できる可能性があり、病因の解明と創薬開発に繋がることも期待されます。
本研究成果は、科学雑誌「Cell Stem Cell」オンライン版に11月9日 正午(アメリカ東部時間)【日本時間の11月10日 2:00 AM】に掲載されます。
本研究は、文部科学省科学研究費補助金(基盤研究(S)、若手研究(B))及びAMED再生医療実現拠点ネットワークプログラムの支援を受けました。
研究の背景
現在、腎臓病の悪化によって人工透析を必要とする患者の数は30万人を超え、これらの患者は週に数回、数時間におよぶ治療を一生涯継続する必要があることから生活の質の低下を余儀なくされています。しかしながら、腎移植の機会は限られており、山中教授らによるiPS細胞の発明を契機に腎臓の再生医療への期待が高まっています。これまで網膜や心筋細胞など、臓器の組織の一部を多能性幹細胞から作成し、臨床応用する研究が進む一方で、臓器そのものを作るといった研究はその複雑な成り立ちを背景にほとんどの臓器で達成されていません。すなわち、いかにして臓器の全体構造を再現するのかということは様々な臓器再生研究における共通の課題といえます。
腎臓は血液をろ過することによって尿を産生しますが、このろ過機能はネフロンと呼ばれる多数の「小構造」(ヒトでは腎臓あたり100万個)によってまかなわれています。ネフロンで産生された尿は集合管と呼ばれる排泄路を通って尿管へと集められ膀胱へと流されます。つまり腎臓が機能するためには個々のネフロンが集合管によって束ねられるという「高次構造」が必須となります。
これまでの研究によって、この腎臓の高次構造の形成には胎児期の腎臓における3つの前駆細胞集団の相互作用が必須であることが明らかにされていました。すなわち、ネフロンの元になる「ネフロン前駆細胞」、集合管の元になる「尿管芽」、さらにこれらの構造の間を埋めて支持組織を形成する「間質前駆細胞」です。中でも、尿管芽は1つの突起の先端から分岐を繰り返す特有の「樹状分岐」を繰り返すことで、腎臓の構造全体を組織化しており、腎臓の形態形成における中心的役割を果たすことが知られていました(図1)。
熊本大学発生医学研究所の研究グループ(太口敦博助教(当時大学院生)、西中村隆一教授ら)は2013年末に、マウスES細胞およびヒトiPS細胞からネフロン前駆細胞の誘導法を確立して3次元のネフロン構造を含んだ腎臓組織の一部を作製することに世界に先駆けて成功し、報告していました。その後、世界中のさまざまな研究室からネフロンを作製する方法が発表されてきた一方で、ネフロン同士を接続する集合管の構造を再現したものはありませんでした(図2)。
そこで今回は、尿管芽を多能性幹細胞から誘導する方法を確立し、ネフロン前駆細胞や間質前駆細胞と組み合わせることで腎臓固有の高次構造を再現することを目的としました。
腎臓は血液をろ過することによって尿を産生しますが、このろ過機能はネフロンと呼ばれる多数の「小構造」(ヒトでは腎臓あたり100万個)によってまかなわれています。ネフロンで産生された尿は集合管と呼ばれる排泄路を通って尿管へと集められ膀胱へと流されます。つまり腎臓が機能するためには個々のネフロンが集合管によって束ねられるという「高次構造」が必須となります。
これまでの研究によって、この腎臓の高次構造の形成には胎児期の腎臓における3つの前駆細胞集団の相互作用が必須であることが明らかにされていました。すなわち、ネフロンの元になる「ネフロン前駆細胞」、集合管の元になる「尿管芽」、さらにこれらの構造の間を埋めて支持組織を形成する「間質前駆細胞」です。中でも、尿管芽は1つの突起の先端から分岐を繰り返す特有の「樹状分岐」を繰り返すことで、腎臓の構造全体を組織化しており、腎臓の形態形成における中心的役割を果たすことが知られていました(図1)。
熊本大学発生医学研究所の研究グループ(太口敦博助教(当時大学院生)、西中村隆一教授ら)は2013年末に、マウスES細胞およびヒトiPS細胞からネフロン前駆細胞の誘導法を確立して3次元のネフロン構造を含んだ腎臓組織の一部を作製することに世界に先駆けて成功し、報告していました。その後、世界中のさまざまな研究室からネフロンを作製する方法が発表されてきた一方で、ネフロン同士を接続する集合管の構造を再現したものはありませんでした(図2)。
そこで今回は、尿管芽を多能性幹細胞から誘導する方法を確立し、ネフロン前駆細胞や間質前駆細胞と組み合わせることで腎臓固有の高次構造を再現することを目的としました。
研究の内容
太口敦博助教らは、まずマウスを用いて尿管芽の発生過程の機能解析と網羅的遺伝子解析を行いました。その結果、胎生8.75日目から11.5日目にかけて尿管芽のもとになるウォルフ管が徐々に機能的に成熟し、樹状分岐能力を獲得すること、また、その成熟過程をモニターできるマーカー遺伝子群が明らかになりました。次に実際に胎生8.75日目のウォルフ管細胞を体外で培養実験することによって、尿管芽に成熟させるのに必要な成長因子の組み合わせと濃度(成熟培養条件)を決定しました。さらに、胎生8.75日目のウォルフ管の表面に存在する分子群の中から、ウォルフ管細胞の選別・純化に有用なマーカー分子を見出しました(図1、図6)。
次に、マウスES細胞からこの胎生8.75日目のウォルフ管に相当する細胞を誘導する方法を検討し、細胞表面マーカーによってウォルフ管細胞を純化した後に、前出の成熟培養条件によって尿管芽を誘導する方法を確立しました。この結果、ネフロン前駆細胞誘導に必要なシグナルと尿管芽誘導に必要なシグナルが各誘導ステップにおいて大きく異なることが明らかになりました。つまりネフロン前駆細胞と尿管芽はそれぞれ個別に最適化された誘導条件が必要であることが示唆されました(図6)。
次にマウスES細胞から誘導した尿管芽の機能性を確認するために、誘導ネフロン前駆細胞、さらにマウス胎仔由来の間質前駆細胞と混ぜ合わせて組織培養を行いました。胎児の尿管芽には、①樹状分岐形成能力、②分岐の先端でネフロン前駆細胞からネフロンを分化させる能力、③ネフロン前駆細胞の一部を前駆細胞のまま維持させる能力の3つの機能的特徴があることが知られています。検証の結果、1つの誘導尿管芽から、6~7世代におよぶ樹状分岐が形成されること、その各先端に分化したネフロンが接続すること、さらに未分化なネフロン前駆細胞も維持されることが確認され、典型的な胎児腎臓の高次構造が再現されることが確認できました(図3,4)。また、このマウス誘導尿管芽を、分岐に必要な成長因子を混ぜたゲルの中で培養することによっても分岐形成することが観察されました。これらの結果からマウスES細胞から誘導した尿管芽は生体の尿管芽と同様の機能特性を備えていることが示されました。
つづいて、マウスES細胞から尿管芽を誘導する方法を一部改変することで、ヒトiPS細胞から尿管芽を誘導する方法を確立しました。ヒト胎児の間質前駆細胞は入手が難しいことから、誘導尿管芽を成長因子入りのゲルの中で培養したところ、樹状分岐能を確認することができました。そこでマウスの尿管芽形成およびヒトの腎臓形成に必須であることが報告されているPAX2という遺伝子がはたらかないようにしたiPS細胞を用いて尿管芽誘導を行ったところ、正しく尿管芽が形成されず、樹状分岐能力も誘導されないことが観察されました(図5)。このことから、遺伝子変異による腎臓の形態形成異常が、ヒトiPS細胞から誘導した尿管芽を用いて研究し得る可能性が示されました。
これらの研究成果は、臓器を構成する各前駆細胞をその発生過程に応じて多能性幹細胞から作り分け、さらに適切に組み合わせることで、臓器の高次構造をある程度再現し得る可能性を示すもので、腎臓の臓器再生研究の基盤戦略を示すだけでなく、臓器の形が出来る仕組みの解明に大きく寄与することが期待されます。
次に、マウスES細胞からこの胎生8.75日目のウォルフ管に相当する細胞を誘導する方法を検討し、細胞表面マーカーによってウォルフ管細胞を純化した後に、前出の成熟培養条件によって尿管芽を誘導する方法を確立しました。この結果、ネフロン前駆細胞誘導に必要なシグナルと尿管芽誘導に必要なシグナルが各誘導ステップにおいて大きく異なることが明らかになりました。つまりネフロン前駆細胞と尿管芽はそれぞれ個別に最適化された誘導条件が必要であることが示唆されました(図6)。
次にマウスES細胞から誘導した尿管芽の機能性を確認するために、誘導ネフロン前駆細胞、さらにマウス胎仔由来の間質前駆細胞と混ぜ合わせて組織培養を行いました。胎児の尿管芽には、①樹状分岐形成能力、②分岐の先端でネフロン前駆細胞からネフロンを分化させる能力、③ネフロン前駆細胞の一部を前駆細胞のまま維持させる能力の3つの機能的特徴があることが知られています。検証の結果、1つの誘導尿管芽から、6~7世代におよぶ樹状分岐が形成されること、その各先端に分化したネフロンが接続すること、さらに未分化なネフロン前駆細胞も維持されることが確認され、典型的な胎児腎臓の高次構造が再現されることが確認できました(図3,4)。また、このマウス誘導尿管芽を、分岐に必要な成長因子を混ぜたゲルの中で培養することによっても分岐形成することが観察されました。これらの結果からマウスES細胞から誘導した尿管芽は生体の尿管芽と同様の機能特性を備えていることが示されました。
つづいて、マウスES細胞から尿管芽を誘導する方法を一部改変することで、ヒトiPS細胞から尿管芽を誘導する方法を確立しました。ヒト胎児の間質前駆細胞は入手が難しいことから、誘導尿管芽を成長因子入りのゲルの中で培養したところ、樹状分岐能を確認することができました。そこでマウスの尿管芽形成およびヒトの腎臓形成に必須であることが報告されているPAX2という遺伝子がはたらかないようにしたiPS細胞を用いて尿管芽誘導を行ったところ、正しく尿管芽が形成されず、樹状分岐能力も誘導されないことが観察されました(図5)。このことから、遺伝子変異による腎臓の形態形成異常が、ヒトiPS細胞から誘導した尿管芽を用いて研究し得る可能性が示されました。
これらの研究成果は、臓器を構成する各前駆細胞をその発生過程に応じて多能性幹細胞から作り分け、さらに適切に組み合わせることで、臓器の高次構造をある程度再現し得る可能性を示すもので、腎臓の臓器再生研究の基盤戦略を示すだけでなく、臓器の形が出来る仕組みの解明に大きく寄与することが期待されます。
今後の展開
本研究は、腎臓のような複雑な臓器の「形」を人工的にどのように再現するかという課題に1つの道筋を示したものです。しかしながら、これを全て多能性幹細胞から作成するには、間質前駆細胞を誘導する方法の開発が必須です。さらに、腎臓が機能し、大きく成長するためには、この腎臓の構造の中を貫流する血管系組織の組み込みも欠かせません。また、今回作成した尿管芽から腎臓の外の組織である尿管の形成を促すためには、尿管の発達に欠かせない周囲組織の取り込みも必要となります。したがって、移植して尿を作りうる腎臓組織の作製にはまだ多くの課題が残りますが、今回の報告をもとにさらなる腎臓再生研究の進展が見込まれるものと考えられます。また、これまで誘導できていなかった集合管組織の作製が可能になることで、集合管に先天性の形成異常をきたすような疾患の病態再現および解明が前進することが期待されます。
用語解説
- ※1 前駆細胞:
- 特定の体細胞の元になる細胞。発生過程で受精卵のような多能性細胞から最終分化した細胞に至る中途段階の細胞。
- ※2 ES細胞:
- 受精卵から作られた多能性幹細胞。胚性幹細胞。
- ※3 iPS細胞:
- 皮膚や血液などの体細胞に遺伝子を導入して作られた多能性幹細胞。人工多能性幹細胞。
- ※4 多能性幹細胞:
- ES細胞やiPS細胞など、様々な体細胞に分化し得る細胞
参考図
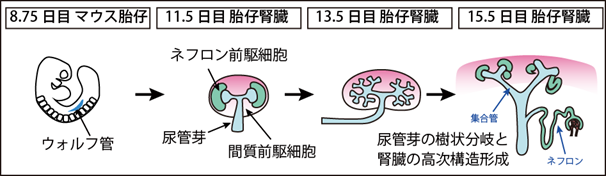
図1 生体における腎臓の形態形成過程
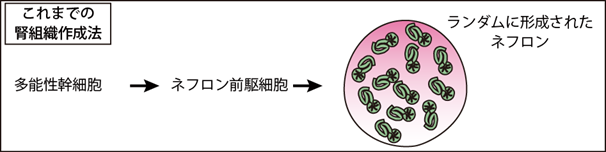
図2 これまでの多能性幹細胞から腎臓組織作製法
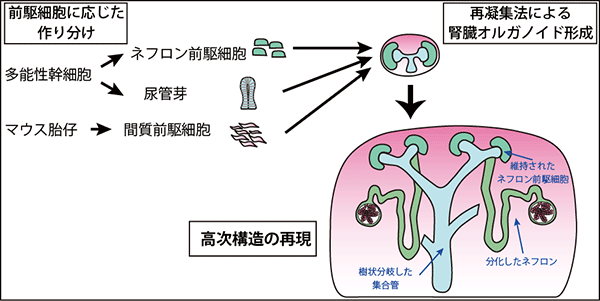
図3 今回の多能性幹細胞から胎児腎臓の高次構造の再現法
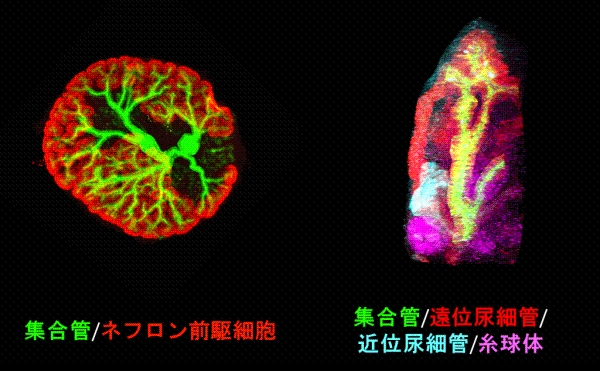
図4 マウスES細胞から再構築された腎臓の高次構造(弱拡大:左)と集合管の先端に接続されたネフロン(強拡大:右)
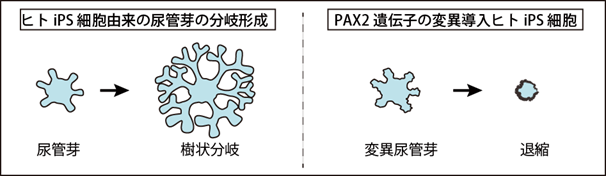
図5 ヒトiPS細胞から作成した尿管芽の樹状分岐形成とPAX2遺伝子の変異導入iPS細胞に見られた形態形成異常
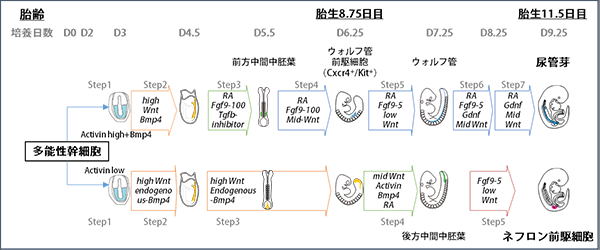
図6 尿管芽とネフロン前駆細胞の発生モデルとそれぞれの分化誘導条件
論文名
Higher-order kidney organogenesis from pluripotent stem cells Cell Stem Cell, in press (2017)
Atsuhiro Taguchi and Ryuichi Nishinakamura.
Atsuhiro Taguchi and Ryuichi Nishinakamura.
お問い合わせ先
熊本大学発生医学研究所 腎臓発生分野
元助教 太口 敦博(たぐち あつひろ)
E-mail:ataguchi777"AT"gmail.com
電話:+49-30-8413-1892
(9月からドイツのMax Planck Institute for Molecular Geneticsに異動)
教授 西中村 隆一(にしなかむら りゅういち)
電話:096-373-6615
E-mail:ryuichi"AT"kumamoto-u.ac.jp
戦略推進部 再生医療研究課
〒100-0004 東京都千代田区大手町一丁目7番1号
電話:03-6870-2220 FAX:03-6870-2242
E-mail:saisei"AT"amed.go.jp
※E-mailは上記アドレス"AT"の部分を@に変えてください。
元助教 太口 敦博(たぐち あつひろ)
E-mail:ataguchi777"AT"gmail.com
電話:+49-30-8413-1892
(9月からドイツのMax Planck Institute for Molecular Geneticsに異動)
教授 西中村 隆一(にしなかむら りゅういち)
電話:096-373-6615
E-mail:ryuichi"AT"kumamoto-u.ac.jp
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)戦略推進部 再生医療研究課
〒100-0004 東京都千代田区大手町一丁目7番1号
電話:03-6870-2220 FAX:03-6870-2242
E-mail:saisei"AT"amed.go.jp
※E-mailは上記アドレス"AT"の部分を@に変えてください。
関連リンク
掲載日 平成29年11月10日
最終更新日 平成29年11月10日


