がん遺伝子変異の高速評価を可能とするハイスループット機能解析法の開発ーがんゲノム医療への応用に期待ー
プレスリリース
東京大学
日本医療研究開発機構
発表者
高阪 真路 (東京大学大学院医学系研究科 分子細胞生物学専攻 ゲノム医学講座 特任助教)
発表のポイント
- 次世代シークエンサー(注1)によるがん遺伝子探索研究の結果、がんとの関連性などの臨床的意義不明遺伝子変異(variants of unknown significance: VUS、注2)が大量に見つかっています。今回、それらが、がんを起こす原因となるのか、さらに、発がん原因となるならどんながん治療薬が効くのかを簡便かつ短期間に効率よく解析する手法である「MANO法」を開発したので報告します。
- 肺腺がん(注3)のがん遺伝子変異で最も多いのはEGFR遺伝子(注4)ですが、タンパク質を構成しているあるアミノ酸が別のアミノ酸に変わってしまう非同義変異(注5)が1000種類以上も報告されていて、本当に発がんに関係する変異かどうか不明のものが大部分でした。今回、100種類以上の変異をMANO法で調べ、これまで知られていなかった、発がん遺伝子変異や、抗がん薬が効かなくなる遺伝子変異を、多数見つけ出すことに成功しました。さらに肺腺がんにおいて最も多くみられるEGFR(L858R)変異(注6)は、EGFRの858番目のアミノ酸がロイシン(L)からアルギニン(R)に置き換わるものですが、この変異のあるがん患者のうち約20%では、同じ染色体上のEGFR遺伝子内にL858R変異と他の変異が共存すること(重複変異、注7)、そしてこれが発がんの強さや抗がん薬の効き目に影響を与えていることを明らかにしました。
- 今後は、MANO法を用いることで様々な遺伝子のVUSの網羅的機能解析が可能となり、個々の患者ごとにどの治療薬が有効であるか、あるいは他の患者には有効であってもその患者には効かない薬であるなど、個別化医療・ゲノム医療の加速されることが予想され、さらに新薬開発にもつながると考えられます。
発表概要
大規模ながんゲノム研究によって、多数の臨床的意義不明な遺伝子変異(variants of unknown significance: VUS)が報告されましたが、それらが、がんと関連性を持つかは不明のままです。
東京大学大学院医学系研究科の高阪真路特任助教および間野博行教授らのグループは、革新的なハイスループット遺伝子変異機能解析手法(mixed-all-nominated-mutants-in-one method: MANO法)を構築しました。
この手法を用いて、肺腺がんで高頻度に見られる101種類のEGFR遺伝子変異を評価したところ、64種類ががん化能をもつ遺伝子変異であることが判明しました。さらに、医療現場で使用されている、EGFRのチロシンキナーゼ阻害剤(注8)に対して耐性を起こさせる変異を数多く発見しました。特に、EGFRエクソン19番内の非同義変異やL833V、A839T、V851I、A871T、G873Eなどが、チロシンキナーゼ阻害剤であるゲフィチニブやエルロチニブ等のがん治療薬への耐性を生じさせるのに関係する重要な変異であるということを今回明らかにしました。また最も多い変異であるEGFR (L858R)変異のある患者では、約20%で、EGFR (L858R)変異の存在する同じ染色体上に重複変異の存在することがわかり、12.8%では、変異があることによりゲフィチニブへの感受性が減弱することが明らかになりました。さらにMANO法を用いた解析で、いくつかのEGFR変異では、試験に用いた全てのEGFRチロシンキナーゼ阻害剤への耐性が生じていたにもかかわらず、EGFRを標的とするモノクローナル抗体であるセツキシマブへの感受性は保たれ、有効な治療薬となり得ることが判明しました。
本研究は、これまで意義不明であったEGFR遺伝子のマイナー変異(稀な遺伝子変異)を検査し、それぞれのがん化能、および薬剤感受性を明らかにしたと同時に、今後のゲノム医療を実装する際には、マイナー変異もシークエンス解析し同定することの重要性をも示唆した画期的な成果です。MANO法は、今後がん化関連遺伝子のVUSを網羅的に評価することで、個別化医療を実現するための基盤的な手法になると期待されるとともに、一度に多数の遺伝子変異に対してがん治療薬の効果を評価できることから、新しい分子標的治療法の研究開発にも大きな貢献をするものと考えられます。
発表内容
次世代シークエンサーの登場によりがんのゲノム異常と発がんのメカニズムが明らかになりつつありますが、同時に数多くの臨床的意義不明の変異(variants of unknown significance: VUS)が同定されました。このようなVUSは発がんにどのように関わっているのか、治療標的になり得るのか、あるいは抗がん剤の感受性にどのような影響を及ぼすのかということについてはわかっていません。例えば肺腺がんのがん遺伝子変異で最も多いEGFR遺伝子の非同義変異は1000種類以上も存在するとの報告がありますが、その機能の詳細が明らかになっているものは30種類位しかありませんでした。その原因としては従来の変異遺伝子機能解析法は一つ一つずつの変異遺伝子の機能を調べるために多くの時間と労力を要することから、次々と報告される変異遺伝子に対して機能解析が追い付いていないということが考えられます。
東京大学大学院医学系研究科の高阪真路特任助教および間野博行教授らのグループは、この問題を解決するために革新的なハイスループット遺伝子変異機能解析手法(mixed-all-nominated-mutants-in-one method: MANO法)を構築しました。MANO法はレトロウイルスベクターを用いて遺伝子を細胞株に導入して機能解析を行いますが、それぞれの遺伝子に固有の6塩基からなるバーコード配列を組み込み、遺伝子導入細胞を全て混和した上で、例えば任意の分子標的薬とともに一定期間培養します。その後培養細胞のゲノムDNAを抽出しバーコード配列をPCR増幅して次世代シークエンサーで解析し、バーコードの相対量を計測します。その値から各遺伝子導入細胞の相対細胞数を算出することで、各遺伝子の薬剤感受性や細胞増殖に与える影響を一度の解析で多数評価できます(図1)。
この手法を用いて101種類のEGFR変異を評価したところ、64種類ががん化能をもつ遺伝子変異であることが判明しました。さらに6種類のEGFR阻害剤に対する感受性を評価すると、多くのEGFR阻害剤耐性変異が発見され、特にEGFRエクソン19番内の非同義変異やL833V、A839T、V851I、A871T、G873Eなどがゲフィチニブやエルロチニブに耐性変異であるということが、今回新たに判明しました(図2)。
また、EGFRのマイナー変異は一般的に薬剤感受性の低いことがMANO法により明らかになったため、マイナー変異がEGFR阻害剤耐性の原因になっているのではないかと予想しました。そこで従来から知られていたEGFRチロシンキナーゼ阻害剤耐性変異のT790M変異(注9)を有しないにもかかわらず、ゲフィチニブ耐性になった11症例の肺腺がんにおけるEGFR遺伝子配列を解析すると、驚くべきことにそのうちの3例はL858RとE709AあるいはE709Gとの重複変異を有するがんでした。培養細胞を用いて重複変異の薬剤耐性に及ぼす影響を実験してみると、L858Rに加えてE709A/K/G/Vの重複変異があると、L858R変異単独のがんに比べて、ゲフィチニブの効果は20分の1から80分の1にも減弱することが判明しました。さらにEGFR(L858R)変異陽性の肺腺がん195例を検査すると、約20%にはEGFR遺伝子内の同一アレル上に重複変異が存在し、MANO法を用いて薬剤感受性を網羅的に評価すると12.8%の症例では重複変異がゲフィチニブ耐性を誘導していることが明らかになりました。さらにMANO法を用いることで、いくつかのEGFR変異が全てのEGFRチロシンキナーゼ阻害剤に耐性である一方で、EGFRのモノクローナル抗体であるセツキシマブに感受性を示すことが判明しました。
本研究は、これまで意義不明であったEGFR遺伝子のマイナー変異のがん化能および薬剤感受性を簡便に明らかにすることに成功したと共に、今後のがんゲノム医療において、マイナー変異を正確に評価することの重要性を示唆した画期的な成果です。MANO法は今後がん関連遺伝子のVUSを網羅的に評価することでがんゲノム医療の基盤的な手法になると期待されるとともに、阻害剤の効果を一度に多数の遺伝子変異に対して評価できるため、新しい分子標的治療法開発にもつながると考えられます。
本研究は高阪真路特任助教が研究開発代表者を務める国立研究開発法人 日本医療研究開発機構(AMED)の革新的がん医療実用化研究事業と間野博行教授が研究開発代表者を務める国立研究開発法人 日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(LEAP)の研究が連携して行ったものです。
発表雑誌
- 雑誌名
- 「Science Translational Medicine」(2017年11月15日オンライン版:日本時間:2017年11月16日(木)午前4時)
- 論文タイトル
- A method of high-throughput functional evaluation of EGFR gene variants of unknown significance in cancer
- 著者
- Shinji Kohsaka, Masaaki Nagano, Toshihide Ueno, Yoshiyuki Suehara, Takuo Hayashi, Naoko Shimada, Kazuhisa Takahashi, Kenji Suzuki, Kazuya Takamochi, Fumiyuki Takahashi & Hiroyuki Mano
用語解説
- (注1)次世代シークエンサー
- DNA全体の配列を、従来法と比べ桁違いに短時間で決定する技術。
- (注2)VUS
- Variants of unknown significanceの略で疾患との関連が不明の変異のこと。既知のがん化遺伝子変異の多くは変異のパターンが特定のアミノ酸に領域に集中し高頻度に見つかるため、これまでに機能解析され発がんとのつながりが明らかになり、治療標的として分子標的薬の開発がされてきた。一方で低頻度の変異の多くは新薬開発における治療標的にしづらいという側面もあり機能解析が進んでいない。
- (注3)肺腺がん
- 肺がんの中で最も多いがん。
- (注4)EGFR
- Epidermal growth factor receptor:上皮増殖因子レセプターの略。細胞の増殖や成長を制御する上皮成長因子(EGF) を認識し、シグナル伝達を行うレセプター型チロシンキナーゼ受容体である。日本人の肺腺がんの約50%にEGFR遺伝子変異がみられる。
- (注5)非同義変異
- 遺伝子の構成単位であるDNAの塩基は4種類存在し、塩基3つで1つのアミノ酸をコードしている。アミノ酸の種類の置換をもたらすような塩基変異のことを非同義変異と呼ぶ。
- (注6)EGFR(L858R)変異
- EGFRのエクソン21の858番目のアミノ酸であるロイシン(L)をアルギニン(R)に置換するEGFR遺伝子変異のこと。EGFR変異の中で最も頻度の高い変異であり、発がんとの関与が知られている。この変異を有する EGFR は恒常的に活性化され二量体を形成しており、下流のシグナル伝達経路を常に活性化することで発がんやがん細胞増殖および生存を誘導している。EGFRチロシンキナーゼ阻害剤であるゲフィチニブやエルロチニブは、変異EGFRのチロシンキナーゼドメインのATP結合部位に競合的に結合し、EGFRの活性化を阻害し下流のシグナル伝達経路を遮断することによって、がん細胞の増殖を抑制するとともに細胞死を誘導する。
- (注7)重複変異
- 1遺伝子の中に複数の変異を有する変異のこと
- (注8)EGFRのチロシンキナーゼ阻害剤
- 上皮成長因子(EGF)が結合する受容体(EGFR)に変異がおきると、細胞増殖の伝達因子となるチロシンキナーゼが常に活性化されたままの状態となり、がん細胞の増殖が繰り返される。EGFRチロシンキナーゼ阻害薬はチロシンキナーゼの活性を阻害することにより、がん細胞増殖を抑制する。
- (注9)T790M変異
- EGFR遺伝子のエクソン20の790番目にあるアミノ酸であるトレオニン(T)がメチオニン(M)になる変異のこと。EGFRチロシンキナーゼ阻害剤の獲得耐性因子として最初に報告された。獲得耐性症例の約50%にT790M が検出される。阻害剤の結合部位に生じる遺伝子変異であり、ゲートキーパー変異とも呼ばれる。EGFR に活性型変異(エキソン19の欠失やL858R 変異)に加えこのT790M変異が入ることにより、EGFRのATP 親和性が高まり相対的に EGFRチロシンキナーゼ阻害剤結合性が低下するため下流シグナルが阻害されなくなり、耐性化する。
添付資料
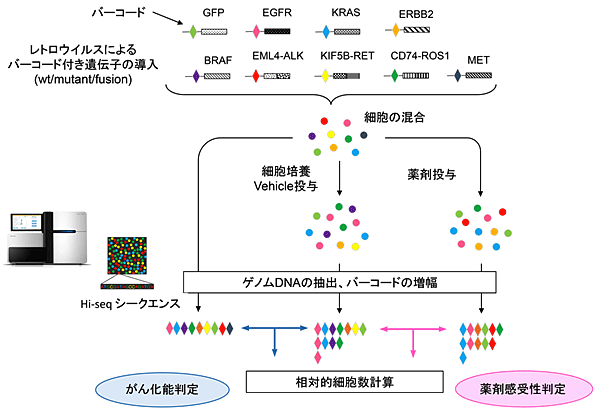
図1 MANO法の概要
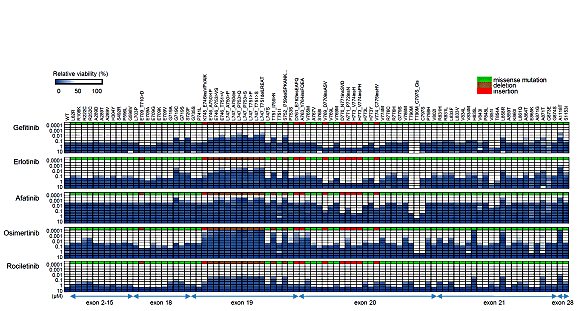
図2 EGFR変異体の薬剤感受性評価
問い合わせ先
研究に関するお問い合わせ
東京大学大学院医学系研究科 分子細胞生物学専攻 ゲノム医学講座
特任助教 高阪 真路(コウサカ シンジ)
東京都文京区本郷7-3-1
Tel:03-5841-0633
E-mail:kohsakas"AT"m.u-tokyo.ac.jp
東京大学大学院医学系研究科 分子細胞生物学専攻 細胞情報学分野
教授 間野 博行(マノ ヒロユキ)
東京都文京区本郷7-3-1
Tel:03-5841-0633
E-mail:genome"AT"m.u-tokyo.ac.jp
報道に関するお問い合わせ
東京大学医学部・医学系研究科総務係
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-3303
E-mail:ishomu"AT"m.u-tokyo.ac.jp
〒100-0004 東京都千代田区大手町1-7-1
Tel:03-6870-2245
E-mail:contact"AT"amed.go.jp
事業に関するお問い合わせ
日本医療研究開発機構 戦略推進部がん研究課 革新的がん医療実用化研究事業担当
〒100-0004 東京都千代田区大手町1-7-1
Tel:03-6870-2221 Fax:03-6870-2244
E-mail:cancer"AT"amed.go.jp
日本医療研究開発機構 創薬戦略部医薬品研究課 革新的先端研究開発支援事業(LEAP)担当
〒100-0004東京都千代田区大手町1-7-1
Tel:03-6870-2219 Fax:03-6870-2244
E-mail:iyaku-leap"AT"amed.go.jp
※E-mailは上記アドレス"AT"の部分を@に変えてください。
掲載日 平成29年11月16日
最終更新日 平成29年11月16日


