腫瘍にマクロファージが浸潤する仕組みを解明-新たながんの治療法開発に期待-
プレスリリース
九州大学
国立研究開発法人日本医療研究開発機構
概要
たんぱく質リン酸化酵素であるmTORC1(※1)は様々ながんで異常に活性化されており、それががんの進行の原因になっていることは以前から知られていましたが、一方で具体的にどのようにしてmTORC1の活性化ががんを進行させるのかについては、多くは謎のままでした。九州大学生体防御医学研究所の中山敬一主幹教授、松本雅記准教授、中津海洋一研究員の研究グループは、以前からたんぱく質リン酸化を大規模かつ定量的に解析するための技術開発を進めており、この研究分野をリードしてきましたが、このたび同技術を用いてmTORC1の下流で機能する分子を探索したところ、mTORC1にはFOXK1(※2)というたんぱく質を活性化する働きがあることを明らかにしました。さらに、活性化したFOXK1にはマクロファージを誘引するたんぱく質であるCCL2(※3)の産生を促す作用があることがわかりました。以前より、がんの周囲にマクロファージ(腫瘍随伴マクロファージ、TAM)(※4)が集積すると、がん免疫が抑制されてがんの進行が早まることが知られていましたが、がん細胞内のFOXK1の機能を阻害すると、CCL2の分泌が低下してTAMががんに集積せず、がんの増殖が抑制されました。つまり、研究グループは、mTORC1の活性化に起因したTAMの集積を引き起こす分子FOXK1を発見し、それががんの新たな治療標的分子になることを示しました。
これまで多くのがんでなぜTAMが集積するのか、その具体的なメカニズムは謎でしたが、本研究によってmTORC1-FOXK1-CCL2経路の活性化がひとつの原因であることが明らかになりました。
これらの結果は、TAMの集積をターゲットとした新たな抗がん剤創薬の可能性を示すものです。本研究成果は、2017年11月28 日(火)午後12 時(米国東部時間)に米国科学雑誌「Cell Reports」で公開されます。
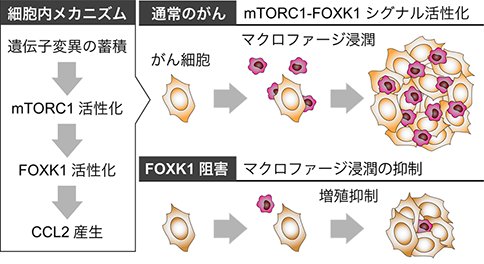
(参考図)mTORC1は腫瘍随伴マクロファージ浸潤を促進する
研究者からひとこと:
mTORC1の異常活性化とマクロファージの浸潤は、どちらも多くのがんに共通した特徴として知られていました。今回FOXK1の発見によって、二つの現象に因果関係があることが分かりました。これらの知見から、マクロファージを対象とした新たな抗がん剤開発が期待されます。
研究の背景と経緯
これまでに発がんに繋がる様々な遺伝子変異が知られていますが、その中にはmTORC1の異常活性化を誘導するものが多く含まれており、60%以上のがんにおいてmTORC1が異常活性化されていると言われています。mTORC1はたんぱく質リン酸化酵素であり、他の様々なたんぱく質をリン酸化することでがんを促進します。しかしながらmTORC1がどのようなたんぱく質群をリン酸化しているのか、またその結果何が起こってがんが促進されているかについては大部分が謎でした。
一方で、多くのがんには腫瘍随伴マクロファージ(TAM)の浸潤が観察されます(図1)。TAMは細胞傷害性T細胞を阻害することでがん免疫を抑制することが知られており、新規抗がん剤の標的として期待されています。しかしながらなぜ多くのがんでTAMの浸潤が観察されるのかについては謎でした。
すなわちこれまで「mTORC1の機能」と「TAM浸潤の原因」の二つについての謎が残されていましたが、長い間これら二つは無関係だと考えられてきました。
研究の内容
mTORC1がどのようなたんぱく質をリン酸化するかを探索するために、高感度質量分析計を用いたリン酸化プロテオミクス技術を用いてデータ取得を行いました。細胞内の一万箇所以上に上るリン酸化について解析を行った結果、mTORC1によって制御されるものとして53個のリン酸化たんぱく質を同定しました(図2)。その中でも特に転写因子であるFOXK1に焦点を当てて詳細に解析を行ったところ、mTORC1の活性が上昇すると、FOXK1が活性化されることが明らかになりました。
次にFOXK1によって転写が誘導される遺伝子を探索したところ、マクロファージを誘引する作用のあるCCL2の転写が、mTORC1によるFOXK1の活性化により上昇することが明らかになりました。以上の事から、mTORC1によってFOXK1が活性化し、CCL2の産生を上昇させることが明らかとなりました(図3)。
mTORC1の活性化とTAMの浸潤の二つの現象は様々ながんで同時に起こることが知られています。しかしながらこれまでmTORC1の活性がTAMの浸潤に寄与するとは考えられていませんでした。そこでmTORC1、FOXK1、CCL2の遺伝子発現を抑制したマウスのがん細胞を作製し、各々を用いてマウスの皮下移植実験(※5)を行いました。その結果、何も抑制しないがん細胞と比べて上記3種類の細胞ではどれもTAMの浸潤量が減少し(図4)、なおかつ腫瘍重量も減少しました。さらにヒト大腸がん細胞株であるHCT116のFOXK1を抑制した細胞をヌードマウスの皮下に移植した実験においても、腫瘍の増殖は有意に抑制されました(図5)。
mTORC1の阻害剤として抗がん剤であるラパマイシンがよく知られています。そこで、皮下にがん細胞を移植したマウスに対してラパマイシンの投与を行い、腫瘍内に浸潤したTAMの量を比較しました。その結果、ラパマイシンを投与することでTAMの浸潤量が減少し、腫瘍も縮小することが分かりました。
以上の結果から、がんで高頻度に見られるmTORC1の活性化が、FOXK1の活性化を通じてTAM浸潤の原因となっていることが分かりました。
今後の展開と治療応用への期待
参考図
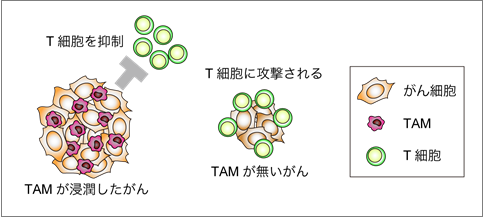
図1 TAM(腫瘍随伴マクロファージ)の浸潤によるがん促進メカニズム
TAM(腫瘍随伴マクロファージ)は、がんを攻撃する細胞傷害性T細胞を抑制して腫瘍免疫を回避し、がんの増殖を促進します。
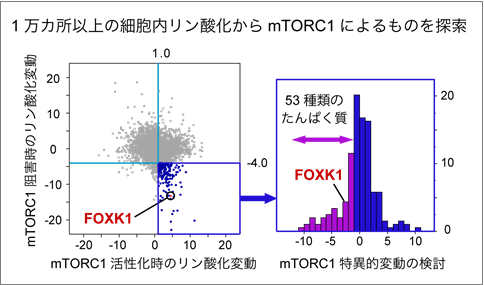
図2 FOXK1はmTORC1に依存してリン酸化が変動する
mTORC1の活性化を誘導した細胞や、mTORC1の阻害剤を添加した細胞のリン酸化の変化を大規模に測定しました。1万カ所以上のリン酸化の変動データの中から、mTORC1の活性化によって変動するものを探索しFOXK1を含む53種類のたんぱく質を同定しました。
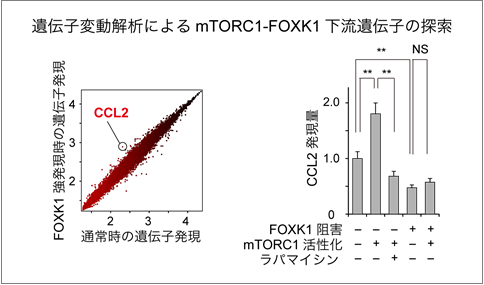
図3 CCL2の発現はmTORC1-FOXK1経路の下流で制御される
FOXK1によって産生される遺伝子の転写物を探索した結果、CCL2を同定しました。CCL2の産生はmTORC1によるFOXK1のリン酸化制御に応答して変動することも分かりました。
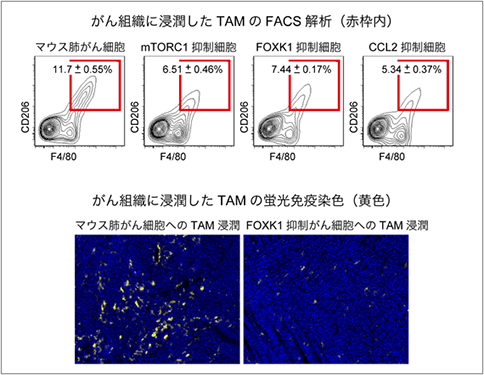
図4 TAM浸潤はmTORC1-FOXK1-CCL2経路の阻害により抑制される
マウス肺がん細胞をマウスの皮下に移植したところ、TAMの浸潤が見られました。しかしながら一方でmTORC1、FOXK1、CCL2を抑制したがんではTAMの浸潤が抑えられました。また、がんの組織切片の蛍光免疫染色を行った実験においても、同様の結果が得られました。
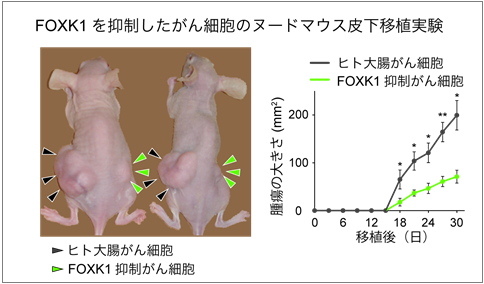
図5 FOXK1阻害はがんを抑制する
ヒト大腸がん細胞を左側の皮下に、FOXK1を抑制したヒト大腸がん細胞を右側の皮下に移植したところ、FOXK1を抑制したがんの大きさが有意に抑制されました。
用語解説
- (※1)mTORC1:
- たんぱく質リン酸化酵素であり、他のさまざまなたんぱく質をリン酸化することで機能の制御を行います。インスリンやアミノ酸といった栄養に応答して活性化し、細胞の成長を促す機能を持ちます。多くのがん細胞では常時活性化状態にあります。
- (※2)FOXK1:
- DNAに結合し、遺伝子から転写物を産生するための機能をもつたんぱく質のひとつです。
- (※3)CCL2:
- 細胞外に分泌されマクロファージに作用するたんぱく質で、これが作用することでマクロファージは誘引され集積します。
- (※4)腫瘍随伴マクロファージ(TAM):
- がん組織に浸潤しているマクロファージの総称。多くのがんにおいて浸潤が観察され、その浸潤量が多いと、予後が悪いケースが多いです。腫瘍免疫を抑制する機能がよく知られています。
- (※5)皮下移植実験:
- がん細胞をマウスの皮下に移植することで、腫瘍を形成させる実験です。
論文名
“Noncanonical pathway for regulation of CCL2 expression by an mTORC1-FOXK1 axis promotes recruitment of tumor-associated macrophages”
(mTORC1-FOXK1軸による新規CCL2発現制御経路は、腫瘍随伴マクロファージの動員を促進する)
Cell Reports, in press, 2017
特記事項
科学研究費補助金・基盤研究(S)
研究課題名:「幹細胞維持分子の機能解析と全身の幹細胞の可視化を目指した総合的研究」
研究代表者:中山 敬一(九州大学 生体防御医学研究所 主幹教授)
研究期間:平成25年4月~平成30年3月
日本医療研究開発機構(AMED)・次世代がん研究シーズ戦略的育成プログラム(P-DIRECT)
研究課題名:「がん関連遺伝子産物の転写後発現調節を標的とした治療法の開発」
(がんの増殖を制御するユビキチン化酵素群を標的とする治療薬の開発)
研究代表者:中山 敬一(九州大学 生体防御医学研究所 主幹教授)
研究期間:平成23年12月~平成28年3月
日本医療研究開発機構(AMED)・次世代がん医療創生研究事業(P-CREATE)
研究課題名:「FOXK1によるCCL2発現調節機構を標的としたがん治療法の開発」
研究代表者:中山 敬一(九州大学 生体防御医学研究所 主幹教授)
研究期間:平成28年4月~
お問い合わせ先
研究に関すること
中山 敬一(ナカヤマ ケイイチ)
生体防御医学研究所 主幹教授
Tel:092-642-6815 Fax:092-642-6819
E-mail:nakayak1”AT"bioreg.kyushu-u.ac.jp
AMED事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構
戦略推進部 がん研究課
〒100-0004 東京都千代田区大手町一丁目7番1号
TEL:03-6870-2221
E-mail:cancer”AT"amed.go.jp
報道に関すること
九州大学広報室
〒819-0395 福岡市西区元岡744
TEL:092-802-2130 FAX: 092-802-2139
E-mail:koho”AT"jimu.kyushu-u.ac.jp
九州大学
国立研究開発法人日本医療研究開発機構
経営企画部 企画・広報グループ
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2245
E-mail:contact”AT"amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 平成29年11月29日
最終更新日 平成29年11月29日


