プレスリリース ぜんそくに関わる新しい遺伝子領域を発見-感染などの免疫応答とぜんそくとの関係の解明へ-
プレスリリース
理化学研究所
東京医科歯科大学
日本医療研究開発機構
要旨
理化学研究所(理研)統合生命医科学研究センター医科学数理研究グループの角田達彦グループディレクター(東京医科歯科大学医科学数理分野 教授)らの共同研究チーム※は、「国際共同研究トランスナショナルぜんそく遺伝学コンソーシアム(TAGC)[1]」に参画し、大規模ゲノムワイド関連解析(GWAS)[2]を行い、新しいぜんそく関連遺伝子と、ぜんそくと自己免疫疾患[3]や炎症性疾患との関係、そして感染などへの免疫応答の関与などの手がかりを発見しました。
多因子疾患であるぜんそくの罹患率は、日本人では5~8%、米国ではメキシコ系アメリカ人の3.9%からアフリカ系アメリカ人の12.5%までさまざまです注1)。また、遺伝的要因のぜんそくリスクへの寄与率は、25~80%と推定されています注2)。このように、罹患率や寄与率の推定値が大きく異なるのは、ぜんそくは環境の違いに左右されやすく、症状もさまざまだからです。これまで、20の研究からぜんそくとの関連が認められた遺伝子座は、わずか21でした。
ぜんそくのリスクとなる新しい遺伝子座を発見するため、世界中の研究者グループで構成されるTAGCが設立されました。今回、共同研究チームはTAGCの一員として現在最大規模となる世界中の多集団でGWASを行いました。さまざまな集団を代表する142,000人以上のデータを解析することで、人種の違いや環境の違いに左右されにくい、ぜんそくのリスクとなる18遺伝子座と878の一塩基多型(SNP)[4]の包括的なカタログを構築しました。そして、ぜんそくのリスクとなる5遺伝子座を新たに発見しました。また、ぜんそくと花粉症の併発症で示唆されていた既知の2遺伝子座内に、既知のものと異なる新しいぜんそく関連SNPも発見しました。これらのぜんそく関連SNPのリストを既存のデータベースと組み合わせて解析し詳しく調べたところ、自己免疫疾患や炎症性疾患の関連SNPと大きく重なることが分かりました。同時に、ぜんそく関連SNPが免疫細胞のエンハンサー[5]の近くに集まっていることから、免疫関係の制御を担っている可能性も示されました。
本成果は今後、ぜんそく発症の詳しいメカニズムの解明や、メカニズムに関連した分子ターゲットの発見によって、ぜんそくに効果的な薬の創薬につながると期待できます。また、発見されたSNP群は、ぜんそくの発症リスクを予測する疾患遺伝子マーカーとしての活用が考えられます。
本研究は、国際科学雑誌『Nature Genetics』に掲載されるのに先立ち、オンライン版(12月22日付け:日本時間12月23日)に掲載されます。
本研究は、日本医療研究開発機構の「オーダーメイド医療の実現プログラム」の支援のもと行われました。
- 注1)
- Akinbami, L.J. et al. Trends in asthma prevalence, health care use, and mortality in the United States, 2001-2010. NCHS Data Brief, 1-8 (2012).
- 注2)
- Duffy, D.L., Martin, N.G., Battistutta, D., Hopper, J.L. & Mathews, J.D. Genetics of asthma and hay fever in Australian twins. Am Rev Respir Dis 142, 1351-8 (1990).
※共同研究チーム
- 理化学研究所 統合生命医科学研究センター
- 医科学数理研究グループ
- グループディレクター 角田 達彦 (つのだ たつひこ)
(東京医科歯科大学 難治疾患研究所 ゲノム応用医学研究部門 医科学数理分野 教授)
- グループディレクター 角田 達彦 (つのだ たつひこ)
- 統計解析研究チーム
- 客員主管研究員 高橋 篤(たかはし あつし)
- 統合生命医科学研究センター
-
- 副センター長 久保 充明(くぼ みちあき)
背景
ぜんそくは世界中の何億人もがかかる多因子疾患です。ぜんそくの罹患率は集団によって異なり、日本では5~8%、米国ではメキシコ系アメリカ人の3.9%からアフリカ系アメリカ人の12.5%までさまざまです。遺伝的要因がぜんそくのリスクに寄与する割合は、ある家族研究により25~80%と推定されています。このように、罹患率や寄与率の推定値が大きく異なるのは、ぜんそくは環境の違いに左右されやすいことや、症状がさまざまだからです。
これらの理由から、これまでぜんそくの大規模ゲノムワイド関連解析(GWAS)で同定された関連遺伝子の数は、同規模の関節リウマチなどの他の多因子性疾患の研究よりも少ない傾向にありました。これまでの20の研究からぜんそくと関連が認められた遺伝子座はわずか21であり、また、これらの遺伝子座は遺伝的リスクの一部のみしか説明できていませんでした。
ぜんそくのさらなる新しいリスク遺伝子座を発見するため、世界中の研究者グループで構成される「国際共同研究トランスナショナルぜんそく遺伝学コンソーシアム(TAGC)」が設立されました。今回、共同研究チームはTAGCの一員として、これまでで最大規模となる世界中の多集団で解析を試みました。
研究手法と成果
1)世界の多様な集団を統合したぜんそくGWAS
TAGCでは、ぜんそくのGWASとして、ヨーロッパ系の祖先を持つ19,954人の患者と107,715人の一般集団、アフリカ系の祖先を持つ2,149人の患者と6,055人の一般集団、日本人1,239人の患者と3,976人の一般集団、ラテン系606人の患者と792人の一般集団に対する、293万カ所での一塩基多型(SNP)の遺伝子型データを解析しました。すなわち、ヨーロッパ系、アフリカ系、日本、ラテン系の23,948人の患者と118,538人の一般集団(合計142,486人)を比較解析することによって、集団の違いや環境の違いに左右されにくい、ぜんそくに関連する遺伝子座を発見しました。
その結果、18遺伝子座に、全部で878のぜんそく関連SNPを認めました(図1)。その内訳は、今回新たに発見した5遺伝子座(5q31.3、6p22.1、6q15、12q13.3、17q21.33)と、以前に日本人での研究やラテン系集団での研究で報告された2遺伝子座(6p21.33、10p14)、欧州集団のぜんそくと花粉症の研究で報告された2遺伝子座(8q21.13、16p13.13)、そして以前に同定されたぜんそくの9関連遺伝子座からなります。
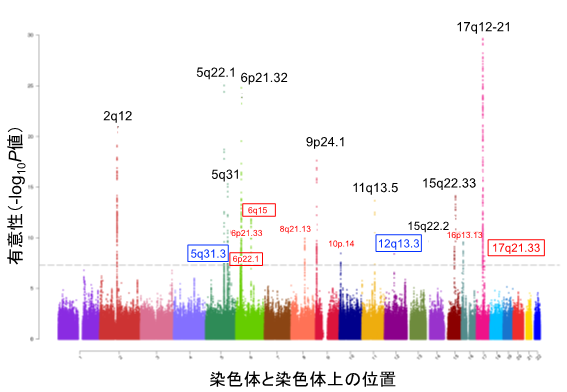
図1 国際多集団142,486人によるGWASメタ解析の結果
既知のぜんそく9遺伝子座は黒で、ヨーロッパ系祖先メタ解析で見いだされた新しい7遺伝子座は赤で、多集団祖先メタ解析でさらに見いだされた新しい2遺伝子座は青で示されている。今回新たに同定されたのは、5q31.3、6p22.1、6q15、12q13.3、17q21.33の5遺伝子座である。
2)ぜんそくとの関連性を持つ新しいSNP
今回、新たに5遺伝子座が同定されましたが、その中でもぜんそくとの最も強い関連を認めたのは、6q15にあるBACH2遺伝子領域のSNPでした。BACH2遺伝子は、ヒト細胞で抗ウイルス応答に重要な機能を持つことが分かっています。2番目に強い関連を認めたのは17q21.33のSNPで、GNGT2 遺伝子を制御しています。これにより、ぜんそくの発症には、免疫反応の中心的な因子NF-κB[6]を活性化する因子の一つであるGNGT2 遺伝子が関わる可能性が示されました。
これらのほかにも、6p22.1の二つのSNPは互いに連動しており、肺機能に関わる遺伝子や免疫調節の遺伝子の関与の可能性が示されました。また、12q13.3のSNPは、血液や肺での2型ヘルパーT細胞[7]の機能的応答に必要なSTAT6遺伝子発現と強く関連していることも分かり、これまでの候補遺伝子研究で有無が論争となっていた、ぜんそくリスクとSTAT6遺伝子との関連を強く支持する結果になりました。そして、5q31.3のSNPはNDFIP1遺伝子のイントロン[8]内にあり、抗ウイルス応答と炎症過程の強力な阻害因子であるNDFIP1遺伝子の血液中での発現と関連しています。
さらに、以前に日本人の研究とラテンアメリカ人の研究でぜんそくとの関連が認められていた2遺伝子座(6p21.33、10p14)のそれぞれで、さらなる新たな関連SNPを発見しました。まず、6p21.33には、免疫関連遺伝子や肺機能関連遺伝子が多く集まっています。また、10p14での新しいSNPは、造血細胞でのHi-Cデータ[9]を用いた解析で、特に免疫CD4陽性T細胞[10]でGATA3プロモーター[11]と相互作用する領域であることを見いだしました。GATA3はTh2細胞と自然2型リンパ球細胞[12]の分化の鍵となる因子であることから、ぜんそくのリスクとなる非常に有力な候補といえます。
また、ぜんそくと花粉症の併発に関して既知の2遺伝子座(8q21.13、16p13.13)は、今回のぜんそく研究でも見いだされ、アレルギー性ぜんそくに関与している可能性が高いこと、またPAG1遺伝子やDEXI遺伝子のぜんそくへの関与の可能性が強く示されました。
3)ぜんそくと他の表現型の感受性遺伝子座との重複
ぜんそくと関連を持つ5q31.3、6p22.1、6q15、12q13.3、17q21.33、6p21.33、10p14、8q21.13、16p13.13の9遺伝子座が、アレルギー関連表現型に関わる遺伝子座、肺機能表現型に関わる遺伝子座、また他の免疫関連疾患について報告されてきた遺伝子座と重複しているかどうかを、公共データベースにあるGWASのカタログを用いて調べました。その結果、6遺伝子座はアレルギー関連遺伝子座と、8遺伝子座は自己免疫疾患関連遺伝子座や感染症関連遺伝子座などと、3遺伝子座は肺機能関連遺伝子座と重なりました。
さらに解析を進め、この9遺伝子座は、特に自己免疫疾患遺伝子座との強い重なりが、また炎症成分を持つ疾患(冠動脈疾患、がん、神経精神疾患)に関わる遺伝子座とは中程度の重なりが認められました。最も強く重なるのは、アトピー性皮膚炎などのアレルギー症状に関わる遺伝子座でした。
4)ぜんそく関連遺伝子多型とエピジェネティック[13]な遺伝子調節との関係
今回、ロードマップ・エピゲノミクス計画[14]やENCODE計画[14]などからの公共データを用いて、さまざまなヒト細胞種でのエピゲノム[13]を調べたところ、本研究で認められたぜんそく関連遺伝子座は、免疫細胞のエンハンサーの近くに多くあり、免疫関連機能の調節に関与している可能性が高いことが分かりました。さらにエピジェネティックなメカニズムがぜんそくを促進する鍵となりうることも分かり、エピゲノム研究の重要性も示されました。
今後の期待
今回、さまざまな集団を代表する142,000人以上の検体を解析することによって、人種の違いや環境の違いに左右されにくい、ぜんそくのリスク多型の包括的なカタログを構築しました。それにより、世界の多くの人種間にわたるぜんそく感受性遺伝子領域が明らかになりました。特に候補遺伝子の多くはウイルスやバクテリアへの免疫応答に関与しており、ぜんそくに感染が大きく関わることも示されました。また、遺伝的多様性や環境暴露の履歴に関する情報を統合するとともに、エピゲノムの探索が重要であることも分かりました。
今後、これらを手がかりにぜんそく発症の詳しいメカニズムの解明や、メカニズムに関連した分子ターゲットを発見することで、ぜんそくに効果的な薬の創薬につながると期待できます。また、発見されたSNP群は、ぜんそくの発症リスクを予測する疾患遺伝子マーカーとしての活用が可能となります。
論文情報
- タイトル:
- Multiancestry association study identifies new asthma risk loci that colocalize with immune-cell enhancer marks
- 著者名:
- Florence Demenais, Michiaki Kubo, Atsushi Takahashi, Tatsuhiko Tsunoda et al.
- 雑誌:
- Nature Genetics
- DOI:
- 10.1038/s41588-017-0014-7
補足説明
- [1] 国際共同研究トランスナショナルぜんそく遺伝学コンソーシアム(TAGC)
- ぜんそく発症に関わる新規のリスク遺伝子座の発見を可能にするために、世界中の研究者グループが共同研究するコンソーシアム。多様な集団・人種を代表する142,000人以上という大規模な解析により、集団や環境の違いに左右されにくい喘息関連遺伝子の包括的なカタログを構築することが可能になった。TAGCはTrans-National Asthma Genetic Consortiumの略。
- [2] ゲノムワイド関連解析(GWAS)
- ゲノムワイド関連解析は、人のゲノム全体をほぼカバーする場所の、一塩基多型(SNP)を代表とする配列多様性の遺伝子型を決定し、遺伝子型の頻度の集団的偏り(特に患者と一般集団との間の)と、病気や表現型との関連を統計的に調べる方法。GWASはGenome Wide Association Studyの略。
- [3] 自己免疫疾患
- 自己免疫疾患は、何らかの免疫異常によって自分の体や組織を異物のように認識し、自己抗体や自己に反応するリンパ球を作り、自分の体を攻撃する疾患のこと。代表的なものに関節リウマチがある。
- [4] 一塩基多型(SNP)
- 集団のゲノム配列中でみられる一塩基の違い(個人差、多様性)で、特に、集団の1%以上に違いが認められる場合に、一塩基多型と呼ぶ。SNPはSingle Nucleotide Polymorphismの略。
- [5] エンハンサー
- エンハンサー領域(配列)は、ゲノムDNA上で制御対象である遺伝子とは遠く離れた領域に位置し、遺伝子の転写効率を向上させる働きを持つ。
- [6] NF-κB
- タンパク質の複合体で、転写因子として働く。特に免疫反応で中心的な役割を持ち、急性・慢性炎症反応や細胞増殖、アポトーシスのメカニズムなどに関わることから、炎症性疾患やがんなど、多くの病気に関わる。
- [7] 2型ヘルパーT細胞
- CD4陽性細胞の中でインターロイキン-4(IL-4)、インターロイキン-5(IL-5)、インターロイキン-13(IL-13)などの2型サイトカインを産生し、B細胞に働きかけ液性免疫(抗体産生)などの2型免疫応答に関与する。
- [8] イントロン
- 遺伝子の中でゲノムDNAからmRNAに転写される部分をエキソンと称する。ゲノムDNA上で、エキソンとエキソンの間のmRNAに転写されない部分をイントロンと称する。
- [9] Hi-Cデータ
- DNAとタンパク質らなる複合体であるクロマチンの空間的な相互作用の可視化を、シークエンシングによって行う方法であるHi-C法という実験方法から得られるデータ。
- [10] CD4陽性T細胞
- 胸腺で分化・成熟するリンパ球。B細胞の分化成熟、抗体産生を誘導するなど、免疫システムの司令塔としての役割を持つ。
- [11] プロモーター
- ゲノムDNA上でRNAに書き写される領域の近くにあり、遺伝子を発現させる機能を持つ部分をプロモーター領域(配列)という。
- [12] 自然2型リンパ球細胞
- 抗原を認識する受容体を持たないリンパ球のことを自然免疫リンパ球という。ILC1、ILC2、ILC3の3種類があり、ILC2は、寄生虫感染防御やアレルギー性炎症疾患において重要な細胞であることが分かっている。
- [13] エピジェネティック、エピゲノム
- DNAの塩基配列に依存しない遺伝子の調節機構をエピジェネティクスと呼ぶ。エピジェネティックはその形容詞形。エピジェネティクスの分子基盤は、DNAのメチル化やヒストンのメチル化/アセチル化によりゲノムの特定領域に可逆的につけられた「目印」であり、このメチル化やアセチル化の情報はしばしばエピゲノムと呼ばれる。
- [14] ロードマップ・エピゲノミクス計画、ENCODE計画
- ロードマップ・エピゲノミクス計画は、米国の「医学研究のためのNIHロードマップ」の一環で、ヒトの胚や成体組織、疾患組織や健常組織でのエピゲノムに関する包括的な参照データを収集することにより、ゲノム上の機能領域を決定している。ENCODE計画は、同様にヒトゲノム上の機能領域を調べ、データベースを作成するプロジェクトであり、日本など5カ国が参加した。遺伝子発現情報やエピゲノム情報、クロマチン構造など、さまざまな機能データが収集された。
発表者・機関窓口
発表者
※研究内容については発表者にお問い合わせ下さい
理化学研究所 統合生命医科学研究センター 医科学数理研究グループ
グループディレクター 角田 達彦(つのだ たつひこ)
(東京医科歯科大学 難治疾患研究所 ゲノム応用医学研究部門 医科学数理分野 教授)
TEL:03-5803-4175 FAX:03-5803-0182
E-mail:tatsuhiko.tsunoda"AT"riken.jp
機関窓口
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press"AT"riken.jp
東京医科歯科大学 総務秘書課 広報係
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm"AT"tmd.ac.jp
日本医療研究開発機構(AMED)
基盤研究事業部 バイオバンク課
TEL:03-6870-2228
E-mail:kiban-kenkyu"AT"amed.go.jp
※Eーmailは上記アドレス"AT"の部分を@に変えてください。
関連リンク
掲載日 平成29年12月23日
最終更新日 平成29年12月23日


