ロイコトリエンB4受容体の構造-GPCRに対する逆作動薬探索の効率化に向けて-
プレスリリース
理化学研究所
日本医療研究開発機構
順天堂大学
青山学院大学
要旨
理化学研究所(理研)横山構造生物学研究室の堀哲哉専任研究員、横山茂之上席研究員、順天堂大学の横溝岳彦教授、奥野利明准教授、青山学院大学の宮野雅司教授らの共同研究グループ※は、ベンズアミジン基[1]を含む化合物が、Gタンパク質共役型受容体(GPCR)[2]の一つであるロイコトリエンB4(LTB4)[3]受容体(BLT1)の不活性状態[4]の立体構造を安定化していることをX線結晶構造解析[5]と機能解析により明らかにし、多くのGPCRの逆作動薬[6]になり得ることを提唱しました。
多くのGPCRは創薬ターゲット[7]です。薬剤設計の迅速化には、創薬研究の初期段階で、GPCRに対する作動薬[8]、逆作動薬、拮抗薬[9]を効率的に探索・設計することが必要です。多くのGPCRの7回膜貫通ヘリックス束[10]の内部にはナトリウムイオン-水分子クラスター(Na+-H2Oクラスター)が結合し、不活性状態のGPCRの立体構造を安定化[11]しています。また、同クラスター結合部位のアミノ酸配列は多くのGPCR間で保存されていますが、隣接する作動薬[8]結合部位のアミノ酸配列は各GPCR間で固有です。そこで、同クラスター結合部位に結合してGPCRの活性抑制能を持つ官能基と、作動薬結合部位に結合して各GPCRへの特異的結合を担う部分を持つ化合物は、不活性状態GPCRの立体構造を安定化する逆作動薬になると考えられてきました。しかし、同クラスターへの結合を模倣する官能基はこれまで同定されていません。
共同研究グループは、BLT1とその拮抗薬との複合体の結晶構造を解明しました。本拮抗薬に含まれるベンズアミジン基は、BLT1のNa+-H2Oクラスターと同じ様式でBLT1に結合していました。また結晶構造から、ベンズアミジン基はBLT1の活性状態への構造変化を阻害して、不活性状態の立体構造を安定化していると考えられました。この仮説を実証するために、作動薬であるLTB4によるBLT1のGタンパク質[2]活性化能がベンズアミジン分子そのものにより抑制されることを実験的に示しました。これらの結果から、ベンズアミジン基と作動薬結合部位に結合する部分を組み合わせた低分子化合物が、各GPCRに特異的に結合する逆作動薬になり得ると考えられます。今後、逆作動薬の探索・設計の効率化への貢献が期待できます。
本研究成果は、国際科学雑誌『Nature Chemical Biology』掲載に先立ち、オンライン版(1月8日付け:日本時間1月9日)に掲載されます。
本研究は、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(創薬等先端技術支援基盤プラットフォーム)、日本学術振興会 科学研究費助成事業、文部科学省私立大学戦略的研究基盤形成支援事業、武田科学振興財団の支援により行われました。
※共同研究グループ
- 理化学研究所
- 横山構造生物学研究室
- 上席研究員 横山 茂之 (よこやま しげゆき)
- 専任研究員 堀 哲哉 (ほり てつや)
- ライフサイエンス技術基盤研究センター 構造・合成生物学部門
- 構造生物学グループ タンパク質機能・構造研究チーム
- 嘱託職員 羽藤 正勝 (はとう まさかつ)
- 放射光科学総合研究センター 利用システム開発研究部門
- ビームライン基盤研究部 生命系放射光利用システム開発ユニット
- ユニットリーダー 山本 雅貴 (やまもと まさき)
- 専任技師 平田 邦生 (ひらた くにお)
- 基礎科学特別研究員 山下 恵太郎(やました けいたろう)
- 専任技師 河野 能顕 (かわの よしあき)
- 順天堂大学 医学部
- 教授 横溝 岳彦 (よこみぞ たけひこ)
- 准教授 奥野 利明 (おくの としあき)
- 青山学院大学 理工学部
- 教授 宮野 雅司 (みやの まさし)
- 国立国際医療研究センター 脂質シグナリングプロジェクト
- プロジェクト長 清水 孝雄 (しみず たかお)
- 岡山理科大学 理学部
- 教授 中村 元直 (なかむら もとなお)
背景
Gタンパク質共役型受容体(GPCR)は、ヒトでは約800種存在します。これは、タンパク質ファミリーの中で最大規模です。ヒトGPCRはアミノ酸配列や機能の類似性に基づいて、五つに分類されます。719種存在するクラスAが最大で、創薬ターゲットとなりにくい視覚受容体や嗅覚受容体を除くと284種が残ります。この284種のうち、オーファンGPCRと呼ばれる内因性作動薬[8]が同定されていない87種は、創薬ターゲットとして最近特に注目されています。
薬剤設計の迅速化には、研究の初期段階で、GPCRに対する作動薬、逆作動薬、拮抗薬を効率的に探索・設計することが必要です。逆作動薬は、作動薬によるGPCR活性を抑制し、かつ作動薬非結合状態のGPCRの内在性活性[6]も抑制します。
多くのクラスA GPCRの活性は、ナトリウムイオン(Na+)によって抑制されます(図1)。不活性状態のGPCRの7回膜貫通ヘリックス束内部にはナトリウムイオン-水分子クラスター(Na+-H2Oクラスター)構造が形成され、不活性状態のGPCRの立体構造を安定化します。Na+-H2Oクラスター結合部位のアミノ酸配列はクラスA GPCR間で高度に保存されており、Na+-H2Oクラスター結合部位にそれと同様な結合様式で結合する官能基は、不活性状態のクラスA GPCRの立体構造を安定化すると考えられてきました。他方で、Na+-H2Oクラスター結合部位は作動薬結合部位に隣接しており、作動薬結合部位のアミノ酸配列は各GPCRで固有です。
したがって、Na+-H2Oクラスター結合部位に結合してその作用を模倣する官能基がGPCRの活性を抑制し、かつ作動薬結合部位に結合して各GPCRへ特異的結合する部位を持つ化合物は、それぞれのGPCRに特異的に作用する逆作動薬になると考えられてきました。しかし、これまでNa+-H2Oクラスターの作用を模倣する官能基は同定されていませんでした。
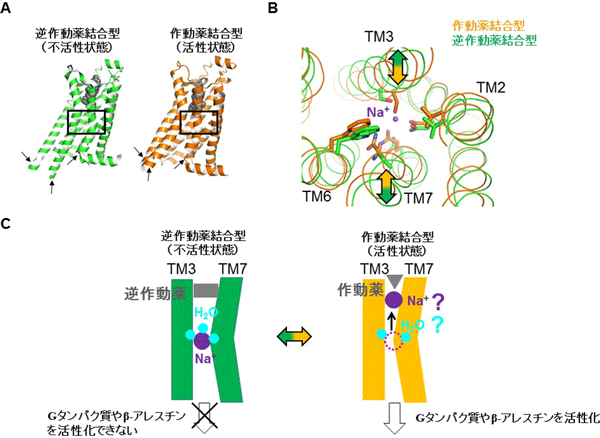
図1 Gタンパク質共役型受容体(GPCR)の構造変化
- 逆作動薬結合型(不活性状態、緑)と作動薬結合型(活性状態、オレンジ)のA2Aアデノシン受容体(GPCRの一種)の構造。作動薬と逆作動薬を球体モデル(灰色)で示した。両型の構造間で、矢印で示した膜貫通ヘリックス領域に大きく違いが生じる。
- 逆作動薬結合型(緑)と作動薬結合型(オレンジ)のA2Aアデノシン受容体における、ナトリウムイオン(Na+)結合部位付近の構造の違い。両構造を重ね合わせ、図Aの黒で囲んだ部分について、上側(細胞質側)から見た図として示した。Na+を紫色、周辺のアミノ酸側鎖をスティックモデルで示した。Na+結合部位付近も、両型の構造間で構造の違いが観察できるので、活性状態(作動薬結合型)と不活性状態(逆作動薬結合型)の平衡において、膜貫通ヘリックス3(TM3)と7(TM7)の矢印のような構造変化を伴うと考えられる。
- 不活性状態と活性状態の平衡におけるTM3とTM7の構造変化の模式図。不活性状態ではNa+はTM3とTM7の間に結合し、不活性状態の立体構造を安定化する。活性状態では、構造変化によりNa+は追い出されると考えられている。ただし、追い出された後にどこに存在するのかは解明されていない。
研究手法と成果
共同研究グループは、GPCRの一つであるロイコトリエンB4(LTB4)受容体(BLT1)を拮抗薬(BIIL260)との複合体構造として結晶化しました(図2A、B)。X線結晶構造解析の結果、BIIL260に含まれるベンズアミジン基が、BLT1のNa+-H2Oクラスター結合部位に結合していることが分かりました(図2C)。ベンズアミジン基内のプロトン化アミジン基[12]は、GPCRで高度に保存されているアスパラギン酸残基、二つのセリン残基とそれぞれ塩橋[13]と水素結合を形成していました。また、ベンズアミジン基内のベンゼン環は、バリン残基とトリプトファン残基とそれぞれCH-π相互作用[14]とEdge-to-π相互作用[14]を形成していました。この相互作用は、まさにNa+-H2Oクラスターの相互作用を模倣しています(図2D)。したがって、ベンズアミジン基はNa+-H2Oクラスターと同様に、不活性状態のBLT1の立体構造を安定化していると考えられます。
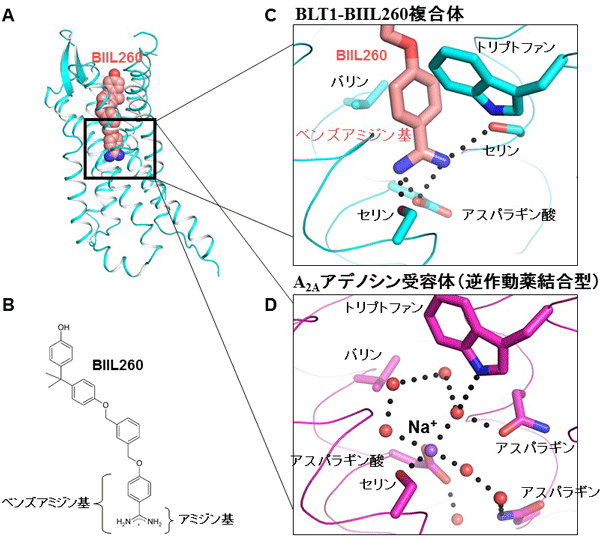
図2 ロイコトリエンB4受容体(BLT1)の結晶構造
- 全体構造。BLT1を拮抗薬(BIIL260)との複合体として結晶化した。BLT1をシアン色、BIIL260の炭素原子をサーモン色、酸素原子を赤、窒素原子を青で示した。
- BIIL260の模式図。
- BLT1とBIIL260のベンズアミジン基の結合様式。ベンズアミジン基はGPCR間で保存されているナトリウムイオン(Na+)結合部位に結合していた。BLT1にBIIL260が結合した場合、BIIL260のベンズアミジン基がNa+結合部位に結合するので、Na+は立体障害によりBLT1に結合することはできない。ベンズアミジン基内のアミジン基(図B参照)はプロトン化され(水素イオンが付加され)、BLT1のアスパラギン酸残基と二つのセリン残基と相互作用している。さらにベンズアミジン基内のベンゼン環部分は、BLT1のトリプトファン残基とバリン残基と相互作用している。
- A2Aアデノシン受容体のNa+結合部位付近の構造。Na+は水分子(H2O)とクラスター構造を形成して、A2Aアデノシン受容体に結合している。Na+-H2Oクラスターと相互作用するA2Aアデノシン受容体のアミノ酸は、ベンズアミジン基との相互作用に関わるBLT1のアミノ酸とほとんど同じである。したがって、ベンズアミジン基はNa+-H2Oクラスターと同様に、不活性状態のBLT1を安定化していると考えられる。
GPCRは、活性状態と不活性状態の平衡状態にあり、不活性状態から活性状態へ移行する際に7回膜貫通ヘリックス束の立体構造が変化します(図1C)。本研究で行ったBLT1とBIIL260の構造解析から、ベンズアミジン基は活性状態に移行するための7回膜貫通ヘリックス束の構造変化を阻害し、Na+-H2Oクラスターと同様に不活性状態の立体構造の維持に寄与すると考えられました(図3)。つまり、BIIL260はGPCRの不活性状態を安定化していると考えられます。
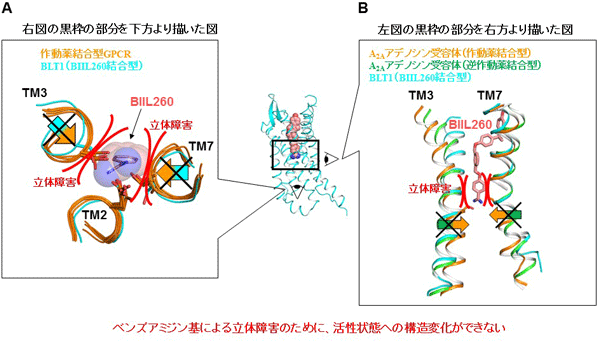
図3 ベンズアミジン基による不活性状態の安定化機構の考察
- 活性状態のGPCRの構造とベンズアミジン基。6種の作動薬結合型GPCR(活性状態)とBLT1の構造を重ね、ベンズアミジン基結合部位付近のみ示した。赤曲線で示した場所で、ベンズアミジン基は作動薬結合型GPCRとは重なるので、ベンズアミジン基が結合した状態でGPCRは活性状態に移行できないと考えられる。
- 活性状態・不活性状態間でのGPCRの構造変化とベンズアミジン基による構造変化の抑制。活性状態(オレンジ)と不活性状態(緑)のA2Aアデノシン受容体とBLT1(シアン、不活性状態)の結晶構造を重ねた。図Aで示したように、活性状態の膜貫通へリックスTM3とTM7はベンズアミジン基との立体障害を生じる。このため、ベンズアミジン基が結合した場合、活性状態になるためのTM3とTM7の構造変化が妨げられ、活性状態に移行できなくなる。このため、不活性状態が安定化・維持されると考えられる。
GPCRの中には、作動薬非存在下でもGタンパク質を活性化する内在性活性を持つものがあります。この内在性活性を抑制する化合物が逆作動薬です。逆作動薬は、不活性状態に選択的に結合して不活性状態の構造を安定化することにより、内在性活性を抑制します。したがって、今回BLT1と複合体化して結晶構造解析を行った拮抗薬BIIL260は、不活性状態を安定化するのであれば機能的には逆作動薬になります。しかし、BLT1には測定できる程の内在性活性能が無いために、拮抗薬BIIL260の逆作動薬活性を直接検証することはできませんでした。
そこで、活性抑制を担うベンズアミジン基の代わりにベンズアミジン分子(図4D)を用いて、作動薬(LTB4)依存的なBLT1活性を抑制するか否か検証しました。LTB4刺激によるBLT1のGタンパク質活性化能は、ベンズアミジン分子濃度依存的に抑制され(図4A)、かつベンザミジン分子とLTB4はBLT1中でお互い重ならない位置で作用するアロステリック[15]な作用様式でした(図4B、C)。この結果により、ベンズアミジン分子は拮抗薬BIIL260のベンズアミジン基と同じ部位に同じ結合様式で結合して、不活性状態を安定化することを証明できました。したがって、結晶構造解析の結果から考察した「ベンズアミジン基はBLT1の活性状態への構造変化を阻害することで、不活性状態を安定化する」という仮説を裏付けることができました(図4D)。また、「逆作動薬は不活性状態を安定化する」という定義から、BIIL260は逆作動薬活性であることも示すことができました。
さらに、同じくクラスA GPCRであるβ1アドレナリン受容体でも、同様にベンズアミジン分子による活性抑制効果を確認しました。ベンズアミジン基が結合した部位のアミノ酸残基はクラスA GPCRで高度に保存されているため、他の多くのクラスA GPCRにもベンズアミジン分子が作用する可能性があります。
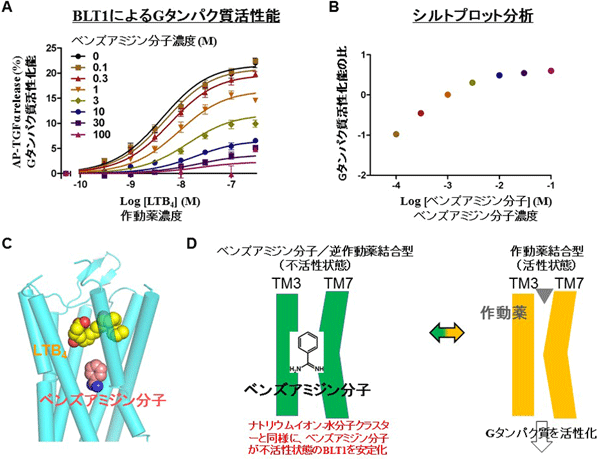
図4 ベンズアミジン分子による作動薬によるBLT1のGタンパク質活性の抑制
- ベンズアミジン分子によるロイコトリエンB4(LTB4)依存的BLT1活性の影響測定(TGFα-sheddingアッセイ)。BLT1はLTB4濃度依存的にGタンパク質活性が上昇するが、活性はベンズアミジン分子依存的に抑制される。
- シルトプロット分析。グラフが曲線状なので、ベンズアミジン分子はLTB4とは別の結合部位に結合して陰性アロステリック因子としてBLT1に作用するとこが明確になった(図C参照)。
- BLT1とLTB4、ベンズアミジン分子のドッキングモデル。プログラムAutoDock 4を使用して予測したLTB4とBLT1のドッキングモデルに、BLT1-BIIL260結晶構造中のBIIL260のベンズアミジン基を重ね合わせた。モデル中で、ベンズアミジン分子とLTB4はBLT1に同時にお互い重ならない位置に結合しているが、図A、Bの実験結果がそれを支持している。
- ベンズアミジン分子によるLTB4依存的BLT1活性の分子機構の模式図。ベンズアミジン分子はBIIL260のベンズアミジン基と同じ位置に結合し、LTB4が結合していない不活性状態のBLT1の立体構造を安定化する。
ベンズアミジン基が結合した部位のアミノ酸はクラスA GPCRで高度に保存されていることから、ベンズアミジン基は他の多くのクラスA GPCRの活性抑制基になる可能性があります。さらに、ベンズアミジン基に限らずベンズアミジン誘導体基も各GPCRの活性を抑制する可能性もあります。Na+-H2Oクラスター結合部位(つまりベンズアミジン基結合部位)に隣接して作動薬結合部位があるので、作動薬結合部位に結合する部分にベンズアミジン基(またはベンズアミジン誘導体基)が結合した低分子化合物は、各クラスA GPCRに特異的に結合する逆作動薬になる可能性があります(図5)。この概念は、GPCRの逆作動薬の合理的設計および効率的探索につながると考えられます。
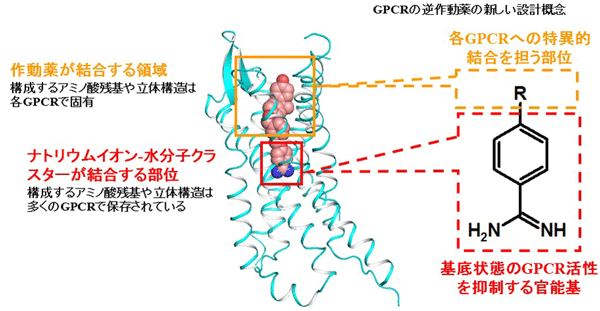
図5 GPCRの逆作動薬の設計、効率的探索にむけて
作動薬結合部位はNa+-H2Oクラスター結合部位に隣接している。Na+-H2Oクラスター結合部位のアミノ酸は多くのGPCRで保存されているが、作動薬結合部位のアミノ酸は各GPCRで固有である。ベンズアミジン基を含む低分子化合物において、ベンズアミジン基がNa+-H2Oクラスター結合部位に結合することによりGPCRの活性抑制基となる。また、ベンズアミジン基以外の部位(図のRの部分)が作動薬結合部位への結合を担い、各GPCRに特異的・強固に結合する逆作動薬となる。
今後の期待
Na+-H2Oクラスターの作用を模倣する官能基であるベンズアミジン基が、Na+-H2Oクラスター結合部位に結合しGPCRの活性抑制基になり得るという本成果は、今後の創薬シード化合物の探索・設計の効率化に貢献すると期待できます。
例えば、ベンズアミジン基を含む化合物に特化した化合物ライブラリーを用いた初期スクリーニングを行うことで、より効率的な逆作動薬のスクリーニングを実現する可能性があります。また、ベンズアミジン基を活性抑制基として含み、各GPCRに特異的に結合する化合物をコンピュータ上で合理的に設計することで、逆作動薬を迅速に設計することも考えられます。
論文情報
- タイトル
- Na+-mimicking ligands stabilize the inactive state of leukotriene B4 receptor BLT1
- 著者名
- Tetsuya Hori, Toshiaki Okuno, Kunio Hirata, Keitaro Yamashita, Yoshiaki Kawano, Masaki Yamamoto, Masakatsu Hato, Motonao Nakamura, Takao Shimizu, Takehiko Yokomizo, Masashi Miyano and Shigeyuki Yokoyama
- 雑誌
- Nature Chemical Biology
- DOI
- 10.1038/nchembio.2547
補足説明
- [1] ベンズアミジン基、官能基
- ベンゼン環にアミジン基(-C(=NH)-NH2)が結合した官能基。官能基とは、有機化合物を特性づける原子団のこと。
- [2] Gタンパク質共役型受容体(GPCR)、Gタンパク質
- Gタンパク質共役型受容体は、細胞表面に発現して、細胞外シグナルを細胞内に伝達する膜タンパク質である。細胞外シグナルは光や核酸、ペプチド、低分子物質、タンパクと多岐にわたり、それぞれの細胞外シグナルに対して個別のGPCRが存在する。Gタンパク質は細胞内部に存在し、細胞外シグナルによって活性化されたGPCRにより活性化される。活性化されたGタンパク質は、さらに下流のエフェクタ―タンパク質を活性化する。GPCRはGタンパク質だけではなくアレスチンと呼ばれるタンパク質も活性化する。GPCRはG protein-coupled receptorの略。
- [3] ロイコトリエンB4(LTB4)
- アラキドン酸から生成される生理活性脂質の一つ。好中球や単球などの白血球細胞が異物を認識して活性化されると、ロイコトリエンB4がこれらの細胞から分泌され、近傍の白血球を活性化・招集し、異物を排除する。
- [4] 不活性状態
- 逆作動薬により不活性状態の立体構造が安定化され、活性・不活性状態の平衡が不活性状態に移動した状態のこと。他方で、内在性活性が存在しないGPCRは、作動薬が作用しない環境では、逆作動薬がなくても不活性状態に平衡が移動している。
- [5] X線結晶構造解析
- 結晶にX線を照射すると回折点が生じ、その回折データを解析することにより電子密度を描くことができる。その電子密度に原子を当てはめていくと、結晶中の物質の立体構造を解析することができる。この方法によって、タンパク質の立体構造や内部構造を知ることができる。
- [6] 逆作動薬、内在性活性
- GPCRの種類によっては、作動薬が存在しない場合でも、Gタンパク質やアレスチンを活性化している。この活性を内在性活性という。平衡を不活性状態に移動させて内在性活性を抑制する薬剤を逆作動薬(インバースアゴニスト)と呼ぶ。
- [7] 創薬ターゲット
- 薬剤の標的(ターゲット)となるタンパク質のこと。2005年から2014年までの間でアメリカ食品医薬品局(FDA)に承認された薬剤219種のうち、54種(25%)はGPCRをターゲットとしていた。
- [8] 作動薬、内因性作動薬
- 単純化した2状態モデルとして、GPCRには活性状態と不活性状態が平衡関係にある。活性状態はGタンパク質やアレスチンを活性化する状態で、不活性状態は活性化しない状態である。平衡を活性状態に移動させてエフェクタータンパク質を活性化する低分子化合物や、ペプチド、脂質、タンパク質などを作動薬(アゴニスト)と呼ぶ。生体内にある作動物質を内因性作動薬と呼ぶ。
- [9] 拮抗薬
- GPCRは、活性状態と不活性状態の平衡関係にあるが、平衡を移動させることなく作動薬また逆作動薬と競合する位置に結合して、作動薬や逆作動薬によるGPCR活性制御を阻害する薬剤を拮抗薬(アンタゴニスト)と呼ぶ。作動薬や逆作動薬がない状態で、拮抗薬がGPCRに結合してもGPCRの内在性活性には影響を与えない。
- [10] 7回膜貫通へリックス束
- タンパク質はヘリックスやベータシート構造をしている(二次構造)。GPCRはヘリックスが7本束になった構造をしており、そのヘリックス束領域が細胞表面の細胞膜に埋まった状態で存在する。膜を貫通する状態なので、7回膜貫通ヘリックスと呼ぶ。
- [11] 安定化
- GPCRの活性状態・不活性状態の平衡移動は、GPCRの立体構造変化を伴う。本質的には、平衡移動した状態で立体構造が安定化される。つまり、活性状態ではGタンパク質やβアレスチンを活性化できる立体構造が安定化され、不活性状態では逆作動薬が結合してGタンパク質やβアレスチンを活性化できない立体構造が安定化されている。
- [12] プロトン化アミジン基
- ベンズアミジンのアミジン基のpKaは11.6なので、生理的条件化ではアミジン基にはプロトン(水素イオン)が付加して正電荷を持つ。
- [13] 塩橋
- タンパク中での正電荷と負電荷の相互作用。BLT1とBIIL260複合体構造では、負に荷電しているアスパラギン酸と正に荷電しているプロトン化アミジン基間で形成されるイオン性相互作用が塩橋である。
- [14] CH-π相互作用、Edge-to-π相互作用
- ベンゼン環の法線方向は電子が豊富なπ電子が存在して負電荷を持っている。この?電子系とアルキル基の水素原子が水素結合を形成することをCH-π相互作用という。また、二つのベンゼン環が垂直に向き合ったとき、一方のベンゼン環のπ電子系ともう一方のベンゼン環の水素原子が水素結合を形成することをEdge-to-π相互作用という。
- [15] アロステリック
- 作動薬や逆作動薬が結合する部位とは異なる結合部位をアロステリック結合部位、アロステリック結合部位に結合して受容体の活性を制御する化合物等をアロステリック因子と定義する。アロステリック因子は作動薬/逆作動薬と同時に受容体に結合・作用する。アロステリック因子が作用して、GPCRの作動薬/逆作動薬結合部位の立体構造が変化し、作動薬や逆作動薬の作用が亢進する場合と抑制させる場合がある。BLT1とベンズアミジン分子の関係では、ベンズアミジン分子は作動薬(LTB4)と立体的に重なることなくBLT1に結合してLTB4依存的BLT1の活性を抑制する。そのため、ベンズアミジン分子はLTB4依存的BLT1活性に対して負のアロステリック因子であり、ベンズアミジン分子の作用はアロステリック様と呼ぶ。図4Bの分析(Schild分析)では、プロットが曲線状なのでベンズアミジン分子の作用はアロステリック様であり、LTB4とベンズアミジン分子は同時にBLT1に作用している。仮に同分析で直線になった場合は競合阻害であり、ベンズアミジン分子とLTB4はBLT1中でお互いに立体的に重なってしまう位置に結合するので、ベンズアミジン分子とLTB4は同時にBLT1には作用できない。
発表者・機関窓口
発表者
※研究内容については発表者にお問い合わせ下さい
理化学研究所 横山構造生物学研究室
上席研究員 横山 茂之 (よこやま しげゆき)
専任研究員 堀 哲哉 (ほり てつや)
TEL:045-503-9196 FAX:045-503-9195
E-mail:yokoyama"AT"riken.jp (横山)
順天堂大学 医学部
教授 横溝 岳彦 (よこみぞ たけひこ)
准教授 奥野 利明 (おくの としあき)
TEL:03-5802-1030 FAX:03-5802-5889
E-mail:tyokomi"AT"juntendo.ac.jp (横溝)
青山学院大学 理工学部
教授 宮野 雅司 (みやの まさし)
機関窓口
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press"AT"riken.jp
順天堂大学 総務部 文書・広報課 長嶋 文乃
TEL:03-5802-1006 FAX:03-3814-9100
E-mail:pr"AT"juntendo.ac.jp
青山学院大学 政策・企画部 政策・企画課 課長 戸田 隆也
TEL:03-3409-8159 FAX:03-3409-3826
E-mail:ttoda"AT"aoyamagakuin.jp
日本医療研究開発機構(AMED)創薬戦略部 医薬品研究課
TEL:03-6870-2219
E-mail:20-DDLSG-16"AT"amed.go.jp
※E-mailは上記アドレス"AT"の部分を@に変えてください。
関連リンク
掲載日 平成30年1月9日
最終更新日 平成30年1月9日


