プレスリリース ヒトES細胞由来網膜の移植後機能を確認―重度免疫不全末期網膜変性マウスを作製し移植後光反応を検証―
プレスリリース
理化学研究所
実験動物中央研究所
大日本住友製薬
日本医療研究開発機構
要旨
理化学研究所(理研)多細胞システム形成研究センター網膜再生医療開発プロジェクトの万代道子副プロジェクトリーダー、実験動物中央研究所(実中研)動物資源基盤技術センターの高橋利一センター長、大日本住友製薬再生・細胞医薬神戸センターの岸野晶祥センター長らの共同研究グループ※は、ヒトES細胞(胚性幹細胞)[1]由来の網膜組織を重度免疫不全マウス[2]の末期網膜変性[3]モデルに移植して、形だけでなく機能的にも成熟することを確認しました。
ヒトのES細胞/iPS細胞(人工多能性幹細胞)[1]から効率よく立体の網膜細胞が分化誘導されることが報告され注1、2)、その臨床応用が期待されています。万代副プロジェクトリーダーらはこれまでに、マウスのES細胞/iPS細胞由来の網膜組織を視細胞[4]が変性・消退し、光を感じない末期のマウス網膜変性モデルに移植すると、生着後成熟し移植先の神経細胞と機能的につながり、光が分かるようになることを報告しています注3、4)。また、ヒトES細胞由来の網膜組織についても、免疫不全ラットやサルの視細胞変性モデルに移植後成熟することを形態・組織学的に示しました注5)。しかし、臨床応用にあたってヒトのES細胞やiPS細胞由来の移植片が光に応答するかの検証が残っていました。ヒトの移植視細胞の機能検証では、移植によるモデルの残存機能に対する保護効果と区別する必要があるため、特に視細胞の残存機能がほとんどない末期モデルを用いる必要があります。しかし、変性の激しいマウスやラットなどの末期網膜変性モデルではヒトの網膜組織は成熟しにくいという問題がありました。
今回、共同研究グループは、拒絶反応を全く示さない重度免疫不全マウスの末期網膜変性モデル(NOG-rd1マウス)の作製に成功し、移植後の機能検証を可能にしました。実際に、ヒトES細胞由来の網膜組織をNOG-rd1マウスに移植したところ、半年後には成熟した視細胞の生着、電子顕微鏡観察による外節構造[5]の形成、視細胞が光を感じるために必要な視物質[6]の存在を確認できました。さらに、移植先の網膜を摘出し多電極アレイシステム[7]を用いて調べたところ、光に対する反応、つまり機能的な成熟も確認できました。
本研究成果は、ヒトES細胞から分化誘導した網膜組織が臨床応用に使える可能性を示しています。今後、ヒトへの移植での検証が待たれます。
本研究は、米国の科学雑誌『Stem Cell Reports』(3月13日号)に掲載に先立ち、オンライン版(3月1日付け:日本時間3月2日)に掲載されます。
本研究は、日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム疾患・組織別実用化研究拠点(拠点A)「視機能再生のための複合組織形成技術開発および臨床応用推進拠点」の支援を受けて実施しました。
注1)2012年6月14日プレスリリース「ヒトES細胞から立体網膜の形成に世界で初めて成功」
注2)2015年2月19日プレスリリース「ヒトES細胞から毛様体縁を含む立体網膜を形成」
注3)2014年4月25日CDBニュース「ES・iPS細胞由来の網膜組織をマウスに移植」
注4)2017年1月11日プレスリリース「iPS細胞由来の網膜組織を用いた視機能の回復」
注5)2015年12月25日CDBニュース「ヒトES細胞由来網膜組織を疾患モデルサルに移植」
※共同研究グループ
- 理化学研究所
多細胞システム形成研究センター
網膜再生医療研究開発プロジェクト -
- 副プロジェクトリーダー 万代 道子(まんだい みちこ)
(科学技術ハブ推進本部 創薬・医療技術基盤プログラム プロジェクトリーダー) - プロジェクトリーダー 高橋 政代(たかはし まさよ)
- 副プロジェクトリーダー 杉田 直(すぎた すなお)
- 研修生 伊良波 諭(いらは さとし)
- 研究員 ホンヤ・ツ(Hung-Ya Tu)
- 研究員 山崎 優(やまさき すぐる)
(大日本住友製薬 研究員) - 研究員 砂川 玄志郎(すながわ げんしろう)
- 研究員 松山 武(まつやま たけし)
- 研究員 小出 直史(こいで なおし)
- 研修生 渡邊 健人(わたなべ たけひと)
- テクニカルスタッフ(研究当時) 藤井 桃(ふじい もも)
- 副プロジェクトリーダー 万代 道子(まんだい みちこ)
- 立体組織形成研究チーム
-
- チームリーダー 永樂 元次(えいらく もとつぐ)
- ライフサイエンス技術基盤研究センター 超微形態研究チーム
-
- チームリーダー 米村 重信(よねむら しげのぶ)
- 実験動物中央研究所
動物資源基盤技術センター -
- センター長 高橋 利一(たかはし りいち)
- 資源開発室
-
- 室長代理 後藤 元人(ごとう もとひと)
- 研究員 香川 貴洋(かがわ たかひろ)
- 大日本住友製薬 再生・細胞医薬神戸センター
-
- センター長 岸野 晶祥 (きしの あきよし)
- 主任研究員 桑原 篤(くわはら あつし)
- 熊本大学 眼科学
-
- 教授 谷原 秀信(たにはら ひでのぶ)
背景
網膜色素変性は遺伝的な原因より、桿体(かんたい)細胞[4]という網膜の周辺部に分布する視細胞が変性・消退していく疾患で、中心に分布する錐体細胞[4]も2次的に変性し、徐々に視覚が失われていきます。原因遺伝子が分かっている場合、早期であれば変性を防ぐ治療が期待されますが、末期のものに対しては現在のところ有効な治療法はありません。
ヒトのES細胞(胚性幹細胞)/iPS細胞(人工多能性幹細胞)から効率よく高純度の立体の網膜組織が分化誘導できることが報告されて以来、その移植による臨床応用への期待が高まっています。以前、マウスの視細胞の形態は残存しているが機能しないモデルにおいて、視細胞をバラバラにして移植すると生着して機能が回復するという報告がありました。最近になって、これらの移植後の機能回復は、移植視細胞から移植先の視細胞への細胞内の物質移動による効果であることが報告されました。そのため、本来、網膜でのシグナル伝達でみられるような視細胞と双極細胞[8]との間のシナプス[9]結合(シグナル伝達機構)が移植視細胞と移植先の双極細胞の間でも起こるかについての検証は、移植先の視細胞がほとんど失われた末期のモデルで行う必要があると考えられるようになりました。
万代副プロジェクトリーダーらはこれまでに、視細胞とともに視機能の失われたマウス末期網膜変性モデルに、マウスのiPS細胞から分化誘導した胎児期相当の幼若な網膜組織を移植すると、移植後視細胞が層構造を形成しつつ形態的に綺麗に成熟すること、これらの成熟移植片が光に反応してそのシグナルを移植先に伝えるとともに、一部のマウスでは光が分かるようになることを行動検査で示しました。さらに、ヒトES細胞由来の網膜組織でも、免疫不全ラットやサルの視細胞変性モデルを用いて、これらの組織が移植後形態的に成熟し、成熟を示すタンパク質などを発現していることを形態・組織学的に示しました。しかし、臨床応用にあたって、ヒトES細胞由来の網膜組織がマウスのES/iPS由来網膜組織と同じように光に反応するかという検証がまだ行われていませんでした。
ただし、このような機能検証は常に、“移植先に残存している視細胞や視機能の応答に対する移植細胞の保護効果”と“移植細胞そのものの応答”との区別が問題となります。また、これまでマウスiPS細胞由来の網膜組織の移植後の機能検証に用いていた残存機能がほぼ失われた非常に変性の速いマウスでは、免疫抑制剤を用いてもヒトES細胞由来の網膜組織が移植後に綺麗に成熟しないという問題があり、ヒトの組織が機能的に生着する免疫不全マウスのモデルを確立する必要がありました。
そこで今回は、まず残存機能がほぼ失われた免疫不全の末期の網膜変性モデルマウスを作製・評価し、その後にヒトES由来網膜組織の移植後の生着、成熟、機能評価を試みました。
研究手法と成果
第一ステップとして共同研究グループは、実験動物中央研究所においてrd1-2J(rd1)、rd10というよく用いられる2種類のマウス末期網膜変性モデルをそれぞれ重度免疫不全マウス(NOGマウス)と掛け合わせて、ヒト網膜組織の機能を評価するための2種類の重度免疫不全の末期網膜変性マウス「NOG-rd1」と「NOG-rd10」を作製しました(図1)。
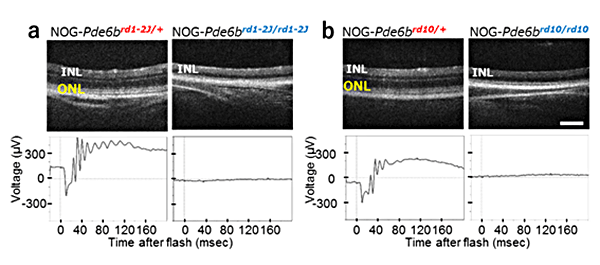
図1 重度免疫不全化した2種類のマウス末期網膜変性モデルの作製
これらのマウスでは、免疫系統が抑制されることにより網膜の変性速度などが変わることがあります。rd1は生後3~4週で視細胞がほぼ消失するのに対して、rd10はrd1よりは少し変性が遅く網膜の変性からの保護の研究によく用いられています。rd1とrd10の網膜変性についての詳しい解析を行ったところ、rd1は重度免疫不全化(NOG-rd1)してもほぼ同様の変性(生後3~4週で視細胞がほぼ消失)がみられました。これに対し、rd10は興味深いことに免疫不全化(NOG-rd10)により変性速度が速くなりました。
ただし、rd10は有色系統のマウスであるのに対し、NOG-rd10マウスはアルビノ[10]であることから、光障害により変性が加速した可能性も考えられました。そこで、NOG-rd10マウスを妊娠中から暗所で飼育したところ変性は遅くなったものの、同様に暗所飼育したrd10マウスの方がやはり変性速度は遅いことが分かりました。この変性速度の差の原因には、免疫系の何らかの影響または系統差による影響などが挙げられます。これらの結果から今回の機能検証には、これまでのマウスES細胞/iPS細胞由来の網膜組織移植でのデータも蓄積しているrd1マウスとほぼ同様の変性がみられたNOG-rd1マウスが妥当と考えられました。
次のステップとして、NOG-rd1マウスにヒトES細胞由来の網膜組織を移植して、移植細胞の成熟と機能検証を試みました(図2)。その結果、組織学的な観察では、これまでの免疫不全ラットやサルでの報告と同様に、分化200日以後には成熟した視細胞が層構造を形成して生着することが確認できました。また、電子顕微鏡を用いた観察では移植した網膜の外節構造の形成も確認でき、免疫染色法[11]で錐体細胞や桿体細胞が光を感じるために必要な視物質(オプシン、ロドプシン)の存在も確認できました(図3)。
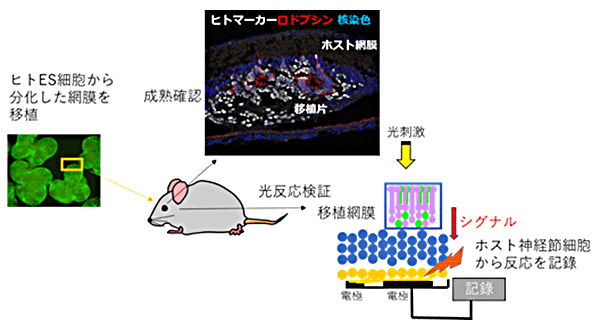
図2 ヒトES細胞由来の網膜組織移植後の組織成熟確認と光反応検証の実験概要
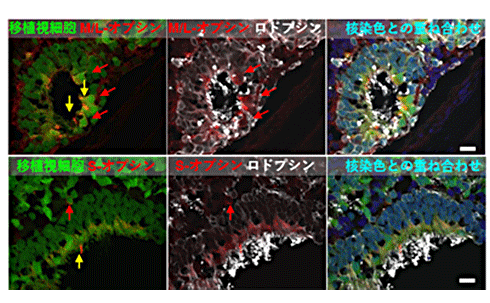
図3 NOG-rd1に移植したヒトES細胞由来網膜の成熟
続いて、移植後の移植先の網膜を摘出し、多電極アレイシステムを用いて光反応の検出を行いました。光に対する反応を10種類の波形パターンに自動分類し、さらに3回の反復照射での再現性を自動判定するプログラムを用いて、光反応を示す神経節細胞(脳につながる網膜細胞)を客観的にカウントしました。そして、カウントされた細胞を正常な網膜で通常見られるような「正常な反応」と変性網膜や生後シナプス形成前に見られるような「過敏な反応」に分類しました。
次に、残存視細胞の有無やその機能について、移植を行う8週齢のNOG-rd1マウス網膜で確認しました。これらの変性網膜では、桿体細胞が消失した後、2次的に変性する錐体細胞の残存が周辺部ではみられました。しかし、実際に網膜の移植する神経乳頭[12]から1mm前後の範囲内ではほぼ消失し、変性途上の錐体細胞がわずかにみられただけで、光反応を示す神経節細胞は検出されませんでした。個体によっては12週齢でも周辺部では残存する視細胞からの反応がわずかに見られましたが、いずれも弧発性であり、神経乳頭から1mm以内の網膜で反応する細胞はみられませんでした。
一方、ヒトES細胞由来の網膜組織の移植後20週以上(生後半年以上)経過している、変性がさらに非常に進行した時期のNOG-rd1マウスでは、移植した8眼中3眼で、移植部位に光反応を示す細胞が再現性を持って、かつ、集中してみられました(図4上段、図5)。このような反応は、移植を実施した8週齢においても通常は見られません。したがって、移植により残存している機能が保護されたのではなく、新たに獲得された反応と考えられました。さらに、視細胞からの入力を薬剤で遮断すると全ての正常な光反応と一部の過敏な光反応が消えることから、これらが視細胞から入力された反応であることが確認されました(図4下段)。他の2眼においても正常および過敏な光反応を示す細胞が移植片上及びその周辺に集中して見られました(図5)。残り5眼のうち2眼では、移植片上全体で光反応が見られる細胞は1個か2個とまばらであったため、残存機能との判別は困難だと判定しました。残りの3眼では光反応がみられませんでしたが、測定後の確認で、移植部分が測定範囲に入っていなかった、あるいは、入っていてもごく一部だったことが分かりました。
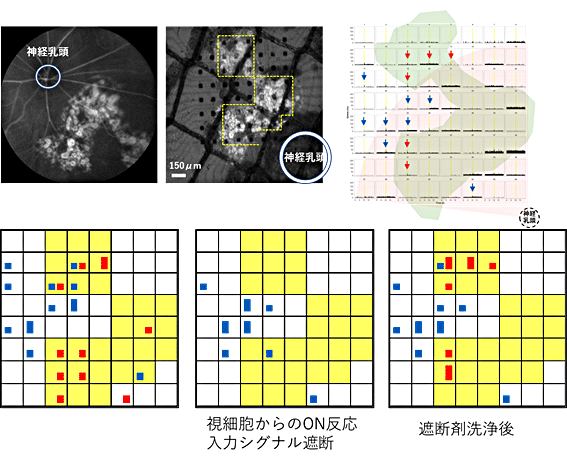
図4 ヒトES細胞由来網膜組織の移植20週後の光反応
下段:光刺激的に対し(8x8)電極上で光応答を示した神経節細胞の数を自動判定プログラムにより客観的にカウントし表示したもの。左から薬剤投入前、視細胞からのONシグナル遮断薬剤(L-AP4)投与後、薬剤洗浄後。移植片が載っている電極を黄色で示した。赤色は正常な網膜でみられる光応答パターンを示した細胞数、青色は過敏な光応答をした細胞数を示している。正方形は細胞1個、長方形は2個の細胞を表す。光応答が視細胞からの入力を薬剤で遮断するとその光反応が消えることから(中央)、視細胞から入力された反応であることが確認できた。
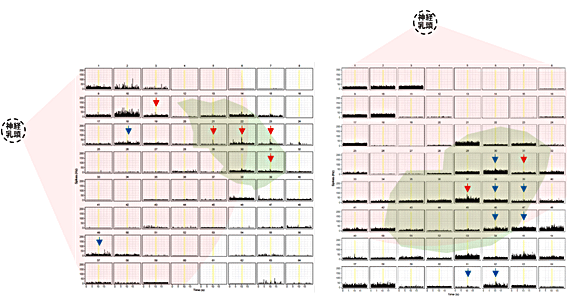
図5 ヒトES由来網膜移植で光反応が得られた他のサンプル
これらのことから、光反応がみられた網膜では、特に過敏な光反応については保護効果による残存視細胞の反応である可能性も完全には否定できないものの、移植時の週齢であるの8週齢の時期でも見られないような視神経近位を含む正常反応が移植部位で集中的に見られることから、これらの過敏な光反応も移植片由来の未熟なシナプス形成を反映しているのではないかと考えられました。
しかし、以前報告したマウスiPS細胞由来の網膜組織の移植では全例で正常な光反応がみられたのに比べ、今回は光反応の検出頻度が低かったため、免疫不全化したモデルマウスという移植先の影響も考えて、確認のために他系統のマウスのiPS細胞由来の網膜組織を他家移植[13]しました。すると、こちらは移植後4週の時点で、4眼全例で明瞭な光応答を観察することができました。これは、マウスという移植先と同じ動物種のiPS細胞由来網膜組織であれば効率よく光反応が見られるという、前回の論文報告からの再現性を免疫不全マウスにおいても確認したことを意味します(図6)。
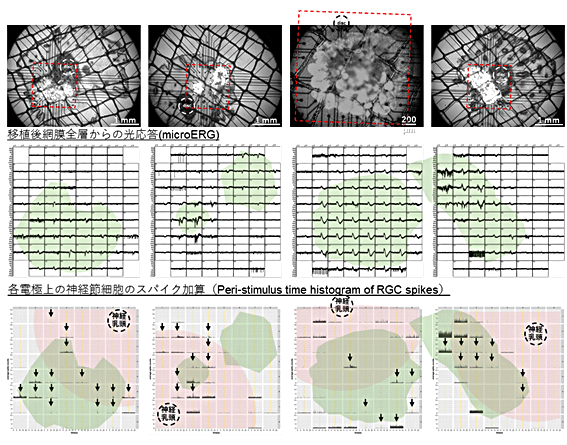
図6 マウスiPS細胞由来の網膜組織を用いた他家移植での光応答
これらの結果より、ヒトES細胞由来の網膜組織は十分に成熟した光応答能も持っており、臨床応用に使える可能性が示されました。ヒト由来組織の移植でマウス由来組織よりも光反応が低かった原因としては、①ヒトとマウスの神経細胞が機能的な神経伝達回路を築くことが難しいこと、②ヒト由来組織が機能的に生着するまでにマウスの網膜がさらに変性が進むことにより受け入れが難しくなっている可能性、③同じサイズの移植片内の機能的視細胞の数の違いや細胞株の差といった可能性、が考えられます。しかし、実際の効果の確認はヒトへの移植での検証を待つことになります。
今後の期待
今回、ヒトES細胞由来の網膜組織でも移植後機能的に成熟し、光に応答する可能性が示されたことで、臨床応用への可能性が拓けたといえます。今後は、さらにヒトiPS細胞、臨床で実際に用いる細胞や分化方法などで同様の追試と安全性試験を行ったうえで、ヒトにおいての移植により機能および効果を確認することになります。同時に、よりよい機能につながる次世代細胞株の作製や分化方法についても研究を進めています。
論文情報
- タイトル
- Establishment of immunodeficient retinal degeneration model mice and functional maturation of human ESC-derived retinal sheets after transplantation
- 著者名
- Satoshi Iraha, Hung-Ya Tu, Suguru Yamasaki, Takahiro Kagawa, Motohito Goto, Riichi Takahashi, Takehito Watanabe, Sunao Sugita, Shigenobu Yonemura, Genshiro A Sunagawa, Take Matsuyama, Momo Fujii, Atsushi Kuwahara, Akiyoshi Kishino, Naoshi Koide, Mototsugu Eiraku, Hidenobu Tanihara, Masayo Takahashi, Michiko Mandai
- 雑誌
- Stem Cell Reports
- DOI
- 10.1016/j.stemcr.2018.01.032
補足説明
- [1] ES細胞(ヒト胚性幹細胞)、iPS細胞(人工多能性幹細胞)
- 脊椎動物の初期胚が持つ、全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。iPS細胞は、成人の皮膚細胞などの体細胞・組織から採取した細胞にOct3、Sox2、Klf4遺伝子などを導入して初期化し多能性を持たせ、人工的に作製した多能性幹細胞である。ES細胞は、哺乳類の着床前胚(胚盤胞)に存在する内部細胞塊から作製された多能性幹細胞。
- [2] 重度免疫不全マウス(NOGマウス)
- いくつかの免疫不全マウスを交配によって複合化したマウスで、免疫機能をほぼもたず拒絶反応を全く起こさない。実験動物中央研究所が樹立に成功し、2002年に報告した。NOGマウスは簡略名で、正式な名称はNOD/Shi-scid, IL-2RγKO。
- [3] 網膜変性、網膜色素変性
- 網膜変性の代表的なものには、視細胞が遺伝的原因などで変性して起こる網膜色素変性と、色素上皮が加齢などの原因で機能不全を起こして生じる加齢黄斑変性がある。網膜色素変性は、網膜を構成する中でも光受容体である桿体視細胞が遺伝的原因で変性し、脱落するために起こる。進行すると錐体細胞も2次的に変性、脱落し、失明を含む強度の視力障害に至ることもある。原因となる遺伝子が70以上あるとされる。
- [4] 視細胞、桿体(かんたい)細胞、錐体細胞
- 視細胞は光を受け、その信号を網膜内の神経細胞へ伝達する重要な役割を担っている。視細胞は大きく分けて、錐体細胞と桿体細胞の2種類が存在する。錐体細胞は、明るいところで物を見るときに使われ、中心部に集まり解像度や色覚に寄与する。桿体細胞は非常に光感度の良い細胞で、主に暗いところで物を見るときに使われる。
- [5] 外節構造
- 視細胞は、外節、内節、核を含む細胞体、接合部から構成されている。桿体細胞の外節(下図)は円盤膜が積み重なった円筒状の形状をしていて、光受容物質のロドプシンを高密度で含有しており、この部分で光子と反応する効率を高めている。外節構造を持つことにより、視細胞は高感度で光を捉えることができる。一方、内節にはミトコンドリアなどがあり、視細胞に必要なエネルギーを作っている。なお、錐体細胞の外節は円錐状をしている。

- [6] 視物質
- 脊椎動物の網膜の視細胞に含まれ、光の受容体として働くタンパク質のこと。オプシン。錐体細胞は反応する光波長域が異なる視物質の違いにより、中長波長(L/Mまたは赤/緑)に反応する錐体細胞、短波長(青色)に反応する細胞にさらに分かれる。
- [7] 多電極アレイシステム
- 複数の電極が配置されており、その上に組織を載せて、電極に隣接している細胞の細胞外電位を捉えることにより、細胞の活動を記録することができる。網膜においては、電極上の網膜全層の電位の変化を捉えるいわゆる「網膜電位図」のような波形と、電極に隣接している神経節細胞の活動の両方を記録することができる。網膜電位図では網膜内の各種細胞の活動を大まかに捉えることができる。
- [8] 双極細胞
- 網膜の中で光の信号を受けた視細胞が、次に信号を送る細胞のこと。
- [9] シナプス
- 神経細胞同士の情報伝達に関わる構造。情報を伝える細胞と伝えられる細胞の間には約20ナノメートル(nm、1nmは10億分の1m)のすき間がある。情報を伝える細胞はこのすき間に神経伝達物質を放出し、伝えられる細胞側の神経伝達物質受容体がそれを受け取ることにより神経情報が伝わる。
- [10] アルビノ
- 先天的にメラニンの産生がないため色素細胞を持たず、見た目が白い動物種。
- [11] 免疫染色法
- 組織切片中の標的分子に対する抗体を使い、その組織内での蛋白の局在を可視化する手法。免疫組織化学染色法とも呼ばれる。
- [12] 神経乳頭
- 網膜脳へのシグナルの出口にあたるから部位で、全ての神経節細胞の神経線維が神経乳頭に集まり、ここを通って脳へ向かう。
- [13] 他家移植
- 自分の細胞・組織を自分の他の場所に移し変えることを自家移植と呼ぶのに対して、自分以外の同じ動物種の(ヒトからヒト、マウスからマウスなど)細胞・組織を移し変えることを他家移植という。実験用のマウスの場合は、同じ遺伝背景での系統が多種確立されているため、異なる系統(遺伝背景)からの移植について「他家移植」といういい方をする。
発表者・機関窓口
発表者
理化学研究所多細胞システム形成研究センター 網膜再生医療研究開発プロジェクト
副プロジェクトリーダー 万代 道子(まんだい みちこ)
実験動物中央研究所 動物資源基盤技術センター
センター長 高橋 利一(たかはし りいち)
大日本住友製薬 再生・細胞医薬神戸センター
センター長 岸野 晶祥(きしの あきよし)
機関窓口
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press"AT"riken.jp
実験動物中央研究所 広報室
TEL:044-201-8516 FAX:044-201-8511
MAIL:pr-office"AT"ciea.or.jp
大日本住友製薬(株)広報・IR担当
TEL:06-6203-1407(大阪)、03-5159-3300(東京)
AMED事業に関するお問い合わせ
日本医療研究開発機構(AMED)戦略推進部再生医療研究課
TEL:03-6870-2220 FAX:03-6870-2242
E-mail:saisei"AT"amed.go.jp
※E-mailは上記アドレス"AT"の部分を@に変えてください。
掲載日 平成30年3月2日
最終更新日 平成30年3月2日


