プレスリリース ゲノム編集技術を用いたヒトiPS細胞での正確な一塩基置換技術(MhAX法)を開発
プレスリリース
京都大学iPS細胞研究所(CiRA)
国立大学法人広島大学
国立研究開発法人日本医療研究開発機構
ポイント
- DNA修復機構の一つを利用して、精密な一塩基置換を実現する技術(MhAX法)を開発
- ヒトiPS細胞を用いて、遺伝性疾患でみられる一塩基多型を再現することに成功
- 正常な塩基を二つもつ細胞と、変異した塩基を二つもつ細胞、正常な塩基と変異した塩基を一つずつもつ細胞を、同時に樹立する技術を確立
要旨
京都大学iPS細胞研究所Knut Woltjen准教授らの研究グループは、広島大学大学院理学研究科 山本 卓 教授 および 慶應義塾大学 先端生命科学研究所 曽我 朋義 教授らと共同で、人工DNA切断酵素(※1)を用いたヒトiPS細胞での正確な一塩基置換技術(MhAX法)を開発しました。本法は、従来法と比較して、目的の一塩基多型(※2)以外の変異が最小限である点や、二次的なドナーDNAを必要としない点など多くの利点を有します。このゲノム編集技術(※3)を用いた精密な一塩基置換技術は、ヒトiPS細胞での遺伝性疾患のモデリングや修復に広く利用され、疾患の本態性解明や新薬の開発、遺伝子治療等へ応用されることが期待されます。
この研究成果は、3月5日(日本時間19:00頃)、英国Nature Publishing Groupの科学雑誌『Nature Communications』にオンライン掲載される予定です。
研究の背景
遺伝子の一塩基置換はゲノム全体で1000万箇所以上あることが知られており、中にはアルツハイマー病や心臓疾患などとの関連が指摘されているものもあります。患者さん由来のiPS 細胞を利用したこれらの疾患モデル系の構築は疾患の原因解明や新規治療薬の開発への有用な手段として期待されています。しかしこうした一塩基置換による影響を厳密に評価するためには、置換が起こった箇所以外の全てのDNAが全く同じ配列であるものを比較する必要があります。
人工DNA切断酵素であるTALENやCRISPR-Cas9を用いたゲノム編集技術により、こうした一塩基置換を導入または修復する手法は、疾患モデルの作製や遺伝子治療に大きく貢献すると期待されている技術です。しかしながら正確に目的の一塩基が改変された細胞を効率的に得るためには、一度目印となる遺伝子を挿入したノックイン細胞を作製し、改変された細胞だけを選び出し、その後目印として導入した遺伝子を抜き取る操作が必要となります。従来法では、この遺伝子の除去の過程で複数の余分な塩基が残ったり、二次的なドナーDNAが必要となったりなど、正確性や効率の面で改善が必要とされていました。
真核生物の細胞にはDNA二本鎖が切断された時に修復する機構が備わっており、特に10~30塩基対ほどの短い相同配列(マイクロホモロジー)を認識して修復する機構は、マイクロホモロジー媒介末端結合(MMEJ※4)と呼ばれています。本研究ではこのMMEJを利用した新しい一塩基置換方法を開発しました。
研究結果
一旦挿入した遺伝子を抜き取る際に、マイクロホモロジーに依存した修復機構を利用し、修復後には、目的の一塩基置換と(遺伝子の機能に影響を及ぼさない)目印となる一塩基置換が導入されるように設計しました。本手法をMicrohomology-assisted excision(MhAX)法と名付けました(図1)。
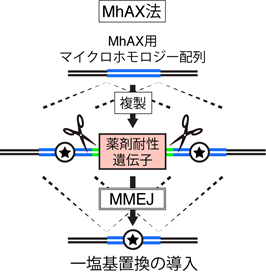
図1 MhAX法
MhAX法では、MMEJが複製されたマイクロホモロジー配列を修復することで目印となる遺伝子を取り除き、一塩基が置換される。
MhAX法を利用することにより、ヒトiPS細胞において、先天性プリン代謝異常症でみられるHPRT1遺伝子の一塩基多型(HPRTMunich)を再現することに成功しました。また、同じくプリン代謝疾患の原因変異の一つとして知られるAPRT遺伝子の一塩基多型(APRT*J)については、左右のマイクロホモロジー領域に正常型塩基と変異型塩基をそれぞれ配置することにより、修復細胞に正常型塩基と変異型塩基が確率的に生じるように工夫しました(図2)。その結果、正常型塩基を二つもつ細胞と、変異型塩基を二つもつ細胞、正常型塩基と変異型塩基を一つずつもつ細胞を、同時に樹立することに成功しました(図3)。これにより、同じ遺伝的背景を有しながら目的の一塩基多型のみが異なる細胞を並列に作製することが可能となり、厳密な対照実験に基づいて当該の一塩基多型と疾患との関連性を精査することのできる手法が確立されました。
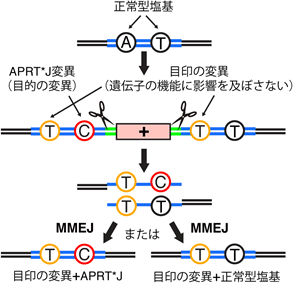
図2 正常型塩基と変異型塩基(APRT*J)の確率的な生成
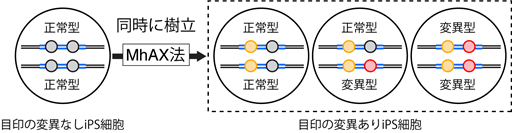
図3 MhAX法のメリット
全てのタイプの変異を持ったiPS細胞を同時に作ることができる
期待される効果と今後の展望
ヒトiPS細胞での一塩基置換の導入技術は、遺伝性疾患のモデル細胞の作製に役立てられ、疾患の本態性解明や医薬品開発に資することが期待されます。また、疾患患者由来の体細胞からiPS細胞を作製し、本技術を用いて疾患の原因変異を修復した後に、目的の細胞に分化させて自家移植を行うex vivoの遺伝子治療への可能性も示唆されます。
また本技術は、ヒトiPS細胞以外の細胞株や生物個体にも適用できる可能性があり、今後これらの実施例が蓄積されることにより、基礎生物学研究や各種産業における利用価値が高まることが予想されます。
論文名と著者
- 論文名
- “Microhomology-assisted scarless genome editing in human iPSCs”
- ジャーナル名
- Nature Communications
- 著者
- Shin-Il Kim1*, Tomoko Matsumoto1*, Harunobu Kagawa1, Michiko Nakamura1, Ryoko Hirohata1, Ayano Ueno2, Maki Ohishi2, Tetsushi Sakuma3, Tomoyoshi Soga2, Takashi Yamamoto3 & Knut Woltjen1,4**
-
*筆頭著者 **責任著者
- 著者の所属機関
-
- 京都大学iPS細胞研究所(CiRA)
- 慶應義塾大学 先端生命科学研究所
- 広島大学大学院 理学研究科
- 京都大学 白眉センター
本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- 日本学術振興会 科学研究費補助金(若手B)
- 京都大学白眉プロジェクト
- 日本医療研究開発機構(AMED)
再生医療実現拠点ネットワークプログラム 疾患特異的iPS細胞を活用した難病研究「疾患特異的iPS細胞樹立促進のための基盤形成」
用語説明
- 注1)人工DNA切断酵素
- DNAに結合する部分とDNAを切断する部分を人工的に融合させたタンパク質(Transcription activator-like effector nuclease, TALEN)や標的配列に結合するガイドRNAと複合体を形成してDNAを切断するタンパク質(Clustered regularly interspaced short palindromic repeats- CRISPR associated protein 9, CRISPR-Cas9)がある。どちらも、ゲノムDNAの特定の遺伝子配列のみを切断することが可能である。
- 注2)一塩基多型
- ゲノムDNAの中の特定の単一塩基が異なる塩基に置き換わったもの。ゲノムワイド関連解析から、疾患への関与が疑われる一塩基多型が多数同定されているものの、その多くは実験的な証明が追いついていない状況にある。
- 注3) ゲノム編集技術
- 人工DNA切断酵素によってゲノムDNAにDNA二本鎖切断を誘導し、その修復過程において、標的遺伝子への欠失や挿入変異を導入(遺伝子ノックアウト)したり、ドナーベクターのゲノムDNAへの組み込みを促進することで遺伝子を挿入(遺伝子ノックイン)したりする最先端の遺伝子改変技術。
- 注4)マイクロホモロジー媒介末端結
- Microhomology-mediated end-joining (MMEJ)。真核生物が持つDNA修復機構の一つ。二本鎖切断の際に生じた切断両末端間で、相補的な配列同士が結合し、修復される機構。
お問い合わせ
本件担当
京都大学iPS細胞研究所(CiRA)
国際広報室
和田濵
TEL:075-366-7005
FAX:075-366-7185
Email:media"AT"cira.kyoto-u.ac.jp
AMED事業に関するお問い合わせ先
日本医療研究開発機構(AMED)
戦略推進部再生医療研究課
TEL:03-6870-2220
FAX:03-6870-2242
E-mail:saisei"AT"amed.go.jp
関連リンク
掲載日 平成30年3月5日
最終更新日 平成30年3月5日


