酸化ストレスが顔面肩甲上腕型筋ジストロフィーの原因遺伝子DUX4を増加させる
プレスリリース
京都大学iPS細胞研究所(CiRA)
日本医療研究開発機構
ポイント
- 顔面肩甲上腕型筋ジストロフィー(FSHD) 注1)の患者さんからiPS細胞技術を利用して骨格筋細胞を作製し、DUX4という遺伝子がFSHDの骨格筋細胞では発現量が多いことを確かめた。
- 酸化ストレスがDUX4の発現を増加させていることを発見し、ゲノム編集によってそのDUX4発現の増加を抑えることに成功した。
- 酸化ストレスがDUX4を増加させる過程で、DNA損傷応答シグナル注2)が介在していることを突き止めた。
要旨
顔面肩甲上腕型筋ジストロフィー(FSHD)は遺伝性の進行性筋ジストロフィーですが、骨格筋に毒性をもたらすDUX4という遺伝子の異常発現が原因と考えられています。DUX4は第4番染色体のテロメア近傍(4q35) 注3)のクロマチン構造注4)の変化という細胞内の異常で発現しますが、細胞外の要因でDUX4の発現が変わり得るのかは分かっていませんでした。
今回、本田充大学院生(京都大学CiRA/東京大学大学院理学系研究科より学外研究)、および櫻井英俊准教授(京都大学CiRA)らの研究グループは、FSHDの患者さん由来iPS細胞から作製した骨格筋細胞を用いて、酸化ストレスがDUX4の発現を増加させていることを確かめました。
さらに、FSHD 由来骨格筋細胞にCRISPR/Cas9注5)を使ったゲノム編集を行い、酸化ストレス状況下においてDUX4を抑制させることに成功しました。
また、酸化ストレスからDUX4の発現までの機構にDNA損傷応答シグナルが介在していることを突き止めました。
これらの結果は、過運動、筋損傷や炎症などがもたらす酸化ストレスが、FSHDの進行を促進させる外的リスクファクターの1つであることを示唆します。
この研究成果は2018年8月9日に英国科学誌「Human Molecular Genetics」でオンライン公開されました。
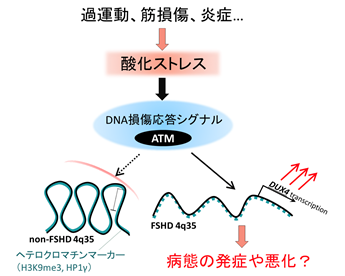
研究の背景
顔面肩甲上腕型筋ジストロフィー (FSHD)は進行的に筋肉の変性やそれに伴う筋力低下をもたらす遺伝性の病気です。FSHDのタイプには2種類あり、“FSHD1”は第4番染色体のテロメア(4q35)のゲノム配列(D4Z4)の反復の短縮(10復以下)を起因とし、“FSHD2”はFSHD1以外の複合因子を起因とします(D4Z4反復配列数は健常の範囲だが比較的短いのに複合してSMCHD1などのクロマチン制御因子注6)の変異が伴う場合など)。健常のD4Z4反復配列ではDNAが高度にメチル化注7)されていますが、FSHD1やFSHD2ではそれぞれのゲノム異常によってDNA低メチル化を伴うクロマチン構造の変化が起こり、DUX4の転写が活性化されます(図1)。これまでの臨床研究や遺伝学研究により、このDUX4の発現がFSHDの原因であると考えられていましたが、細胞内のクロマチン構造の変化のみならず、細胞外の要因によりDUX4の発現が促進されるのかは分かっていませんでした。
酸化ストレスはこれまで骨格筋機能に影響を及ぼすストレスの一つとして注目されており、臨床学的研究によりFSHDに何らかの形で寄与していることは示唆されていましたが、酸化ストレスとDUX4の発現を結びつける研究は行われていませんでした。
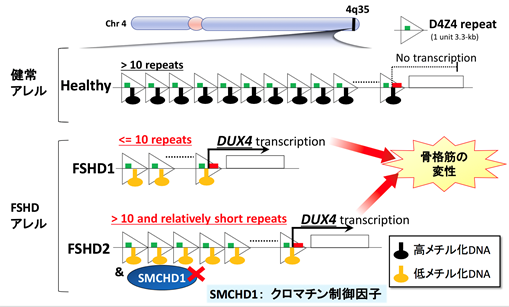
図1:第4番染色体のテロメア(4q35)のゲノム配列の比較(健常の場合とFSHDの場合)
研究結果
1)疾患特異的iPS細胞からFSHD の骨格筋細胞を作製し、DUX4という遺伝子がFSHDの骨格筋細胞では発現量が多いことを確かめました。
本研究では、まず、FSHD1患者さんとFSHD2患者さん、そして健常者の体細胞からiPS細胞を作製し、それぞれを骨格筋細胞へ分化させました(図2A)。それぞれの細胞で遺伝子発現量を解析すると、FSHD1患者さんとFSHD2患者さんの骨格筋細胞ではDUX4の発現量が多く、健常者の骨格筋細胞ではDUX4の発現量が見られないことがわかりました (図2B)。
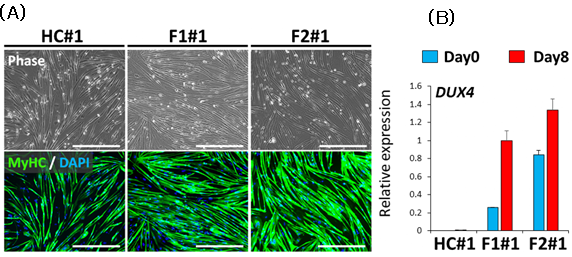
図2:健常者(HC)とFSHD患者さん(F1とF2)から作製した骨格筋細胞
2)酸化ストレスがDUX4を増加させていることが分かりました。さらに、ゲノム編集により酸化ストレス状況下においてDUX4増加を抑えることに成功しました。
次に、健常者とFSHD患者さん由来の骨格筋細胞に酸化ストレスを付加するとDUX4の発現に影響があるか調べるため、酸化ストレスとして過酸化水素(H2O2)を用いて刺激を加えました。それぞれの骨格筋細胞を過酸化水素100μMの下で24時間培養すると、DUX4の発現量がFSHD患者さん由来細胞において明らかに増加することが分かりました(図3A)。さらに、酸化ストレスによるDUX4の発現量の増加が、FSHDの原因遺伝子の一つであるSMCHD1の変異によるものなのか調べるため、FSHD2患者さん由来骨格筋細胞のSMCHD1をCRISPR/Cas9を用いてゲノム編集し、変異を修復しました。そして、ゲノム編集した細胞に過酸化水素の刺激を加えると、ゲノム編集する前の細胞に比べ、DUX4の発現量が抑制されていることが確認できました(図3B)。これらの結果から、<DUX4の発現量は酸化ストレスの増加量に依存し、FSHD2においては疾患原因の一つであるSMCHD1の変異とも関連があることが分かりました。
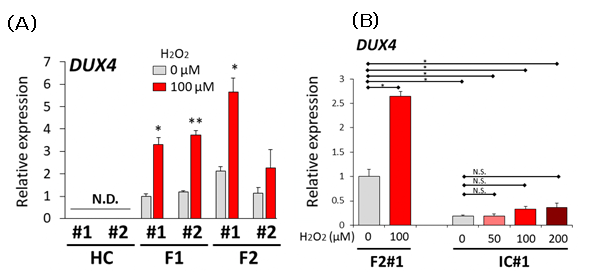
図3:酸化ストレスの付加によるDUX4の発現量の比較
(HC:健常者由来、F1:FSHD1患者さん由来、F2:FSHD2患者さん由来、IC:FSHD2のDNAをゲノム編集したもの)
3) 酸化ストレスがDUX4を増加させる過程で、DNA損傷応答シグナルが介在していることを突き止めました。
過酸化水素の刺激はDNAの損傷も含めて細胞にさまざまな影響を与えます。最後に、DNA損傷応答シグナルが酸化ストレスからDUX4の増加の間に関わっているのか調べました。
先の実験で、DUX4の発現の増加は酸化水素の刺激から12時間後ごろに始まり、6時間後の時点ではまだDUX4の増加が始まらないことが分かっています。まず、DUX4の増加が始まる前の過酸化水素の刺激から6時間後のFSHD骨格筋細胞において、DNA損傷応答シグナルの指標であるγ-H2AXの発現量が増加されていることが確認されました。また、過酸化水素の量にも依存していることが分かりました(図4)。これらの結果から、DUX4の発現量が増加する前にDNA損傷応答シグナルが発せられていることが分かり、酸化ストレスがDUX4を増加させる過程でDNA損傷応答シグナルが介在していることを突き止めました。さらに突き詰めると、DNA損傷応答シグナルを伝達する中心的な役割を持つ物質ATMが関わっていることが分かりました(図5)。
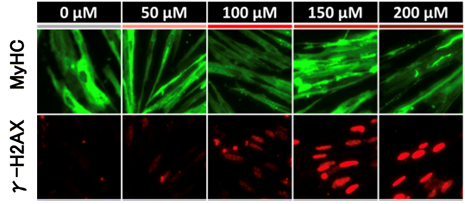
図4:過酸化水素の量の変化におけるFSHD骨格筋細胞(FSHD1患者さん由来)の DNA損傷応答シグナル(DUX4 発現が増加する前)
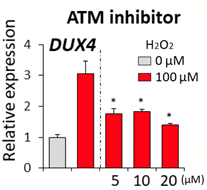
図5:ATMを阻害した場合のFSHD骨格筋細胞(FSHD1患者さん由来)におけるDUX4発現量の比較グラフ。
本研究の意義と今後の展望
FSHDは遺伝性の病気ですが、患者さんによって症状の進行具合にばらつきがあることから、何らかの外的要因があることが提唱されていました。今回の研究は、初めて、疾患特異的iPS細胞を用いてFSHDの原因遺伝子DUX4が外的刺激:酸化ストレスによって増加されることを示しました。さらに、酸化ストレスがDUX4を増加させる過程で、DNA損傷応答シグナルが介在していることが分かりました。これらの結果から、FSHD患者さんにとって、活性酸素を産む生活習慣や食生活、またDNAを損傷させ得るさまざまなストレスがFSHD発症の外的リスクファクターとなることを示唆します。
本研究で用いた疾患特異的iPS細胞を用いたFSHDモデルは今後、さらなるFSHD疾患に対する創薬開発などの研究において有用であると考えられます。
論文名と著者
- 論文名
- “A Patient-derived iPSC Model Revealed Oxidative Stress Increases Facioscapulohumeral Muscular Dystrophy-causative DUX4 ”
- ジャーナル名
- Human Molecular Genetics
- 著者
- Mitsuru Sasaki-Honda1,2, Tatsuya Jonouchi1, Meni Arai1,3, Akitsu Hotta1, Satomi Mitsuhashi4,5, Ichizo Nishino5, Ryoichi Matsuda2,6, Hidetoshi Sakurai1,*
- 著者の所属機関
-
- 京都大学 iPS細胞研究所(CiRA)
- 東京大学 大学院 理学系研究科 生物科学専攻
- 京都大学 農学研究科・農学部
- 横浜市立大学 医学研究科医科学専攻 遺伝学教室
- 国立精神・神経医療研究センター 疾病研究第一部
- 東京大学 大学院総合文化研究科 広域科学専攻 生命環境科学系
本研究への支援
本研究は、下記機関の支援を受けて実施されました。
- 国立研究開発法人 日本医療研究開発機構 再生医療実現拠点ネットワークプログラム 疾患特異的iPS細胞の利活用促進・難病研究加速プログラム
「筋疾患に対する治療薬の創出を目指した研究」 - 日本学術振興会 特別研究員奨励費(17J04509)
- 国立研究開発法人国立精神・神経医療研究センター精神・神経疾患研究開発費
- 公益医用薬物研究奨励富岳基金
用語説明
- 注1)顔面肩甲上腕型筋ジストロフィー (Fasioscapulohumeral muscular dystrophy: FSHD)
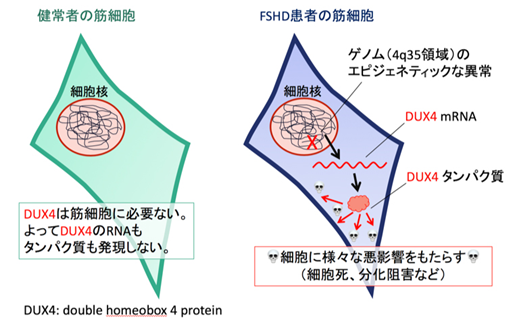
- 顔面筋、肩や首の筋肉の変性や懐死とそれによる筋力低下などが起こる遺伝性の病気。顔面肩甲上腕型筋ジストロフィー(FSHD)は、比較的遅い発症年齢であること(一般的に10代の時期)、筋力低下に左右差が見られること、患者さんによって症状の進行具合にばらつきがあることから他の筋ジストロフィーに比べ特殊な疾患であるとされている。FSHDは主として第4番染色体のテロメア(4q35領域)近傍にあるゲノム反復配列の短縮を伴うことが知られている。ゲノム反復配列の短縮等の結果ゲノム構造に変化を来し、本来の骨格筋細胞では発現していないDUX4という遺伝子が異常に発現されて細胞に悪影響をもたらすと考えられている(下図)。
- 注2)DNA損傷応答シグナル
- DNA損傷を受けた時に細胞が発するシグナル。DNA損傷が発生した場合、DNAが損傷を抱えたまま複製や細胞分裂が行われないよう、細胞はDNA損傷応答シグナルを発して増殖を一時的に停止してDNA損傷の修復を行う。ATM (Ataxia Telangiectasia Mutated)はDNA損傷応答シグナルを伝達する中心的な役割を持つ物質である。
- 注3)テロメア
- 染色体の末端部の構造。繰り返し配列を持つDNAとさまざまなタンパク質から構成される。
- 注4)クロマチン構造
- DNAとタンパク質から成る複合体の構造。構造の変化に伴い遺伝子の活性化、不活性化に関与するので、塩基配列の変化に依らない遺伝子発現の機構(エピジェネティクス)制御の基盤となる。
- 注5)CRISPR/Cas9
- CRISPR(Clustered Regularly Interspaced Short Palindromic Repeat)という塩基配列とCas9というDNA切断酵素と、切断させたい場所へとCas9を誘導するガイドRNAを使うことで、任意の場所のDNAを切断することができる。ゲノム編集技術の一つ。
- 注6)クロマチン制御因子
- クロマチン構造を制御する役割を持つ因子。
- 注7)DNAのメチル化
- 哺乳類の場合、DNAのシトシン塩基の5位末端の水素(-H)がメチル基(-CH3)に置き換わることをいう。遺伝子の働きを調整する領域がメチル化されると遺伝子の発現が抑制され、逆にメチル基が外れる(脱メチル化) と、遺伝子の発現が活発になることが知られている。塩基配列の変化に依らない遺伝子発現の機構(エピジェネティクス)の一つ。
お問い合わせ
京都大学iPS細胞研究所(CiRA)
研究支援部門 国際広報室
大内田 美沙紀
TEL: 075-366-7005
FAX: 075-366-7185
Email: cira-pr“AT”cira.kyoto-u.ac.jp
AMED事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課
〒100-0004 東京都千代田区大手町一丁目7番1号
TEL:03-6870-2220
FAX:03-6870-2242
E-mail:saisei“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
お問い合わせ
関連リンク
掲載日 平成30年8月27日
最終更新日 平成30年8月27日


