プレスリリース 生き物の形づくりに働く「力感知・力抵抗」機構―上皮細胞が組織応力に応答して並び換わる仕組みを発見―
プレスリリース
京都大学 高等研究院 物質-細胞統合システム拠点
国立研究開発法人日本医療研究開発機構
京都大学 高等研究院 物質-細胞統合システム拠点(iCeMS=アイセムス)の杉村薫特定拠点准教授と井川敬介特定研究員は、個体発生過程における新しい力感知・力抵抗メカニズムを発見しました。
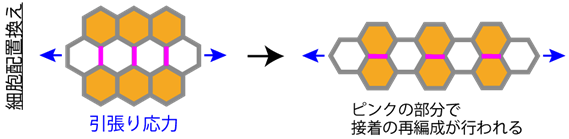
卵から成体へ生き物が形づくられる過程を個体発生といいます。個体発生過程では、組織が時空間的に精密に制御された変形を繰り返します。このとき、一つ一つの細胞に注目すると、細胞がお互いの位置関係を変える「細胞配置換え」が起きています(下図)。最近の研究から、ショウジョウバエ翅(はね)上皮※1などで組織引張り応力※2が細胞配置換えの方向を決めることがわかってきました。しかし、細胞が組織から受ける力の強さや方向性を感知する仕組み(力感知)や細胞が組織引張り応力に壊されることなく配置を変える仕組み(力抵抗)は謎のままでした。
研究グループは、細胞骨格を構成するアクチンに結合するタンパク質であるAIP1(Actin interacting protein 1※3)とコフィリン※4が翅上皮の細胞配置換えにおける力感知と力抵抗を担うことを発見しました。AIP1はコフィリンを介して組織引張り応力を感知して、特定方向の細胞接着面に局在します。さらに、AIP1とコフィリンはアクチン細胞骨格や細胞間接着の再編成を調節して、組織引張り応力と直交する向きの細胞間接着面に機械的な負荷に対する強度を与え、その結果、細胞が正しい向きに並びかえられることが明らかになりました。
組織の変形は必ず、細胞の力感知と力抵抗を伴うことから、本研究で明らかになった分子メカニズムは個体発生の様々な局面で働いていると期待されます。また、aip1とコフィリンはともに酵母からヒトまで保存された遺伝子であり、AIP1とコフィリンの働きにより細胞の動的な並び換えと機械的な構造強度を両立させる仕組みはヒトでも働いている可能性があります。
本成果は、英科学誌「Nature Communications(ネイチャー・コミュニケーションズ)」誌オンライン版に、英国時間9月10日午前10時(日本時間午後6時)に公開される予定です。
1.背景
個体発生では、組織が時空間的に精緻に制御された変形を繰り返すことで、生き物が形づくられます。このとき、細胞はおしくらまんじゅうのように互いに押し合いへしあいしながら、力を掛け合っています。このミクロスケールのおしくらまんじゅうは個体発生において必須かつ多面的な役割を果たしています。例えば、分子モーターなどのタンパク質により生みだされた力は、組織を伸ばしたり折り曲げたりします。加えて最近の研究から、組織内の力分布パターン(組織応力)が、細胞に位置や方向の情報を伝えるメッセンジャーとして働くことがわかってきました。例えば、ショウジョウバエ翅上皮では、組織の遠近軸方向(体の内側から外側に向かう方向)に沿った引張り応力が細胞配置換えの方向を決める一因となっています(図1a, b)。このような組織応力による個体発生制御が実現するためには、第一に細胞が組織応力を感知し応答する仕組み、第二に細胞が組織応力による機械的な負荷に打ち勝って動的に変形したり配置を変えたりする仕組みが必要です(図1c)。この仕組みがうまく働かないと、正しい方向に細胞を並び換えることができません。しかし、細胞の力生成メカニズムと比較して、力感知・力抵抗メカニズムの理解は大きく遅れていました。
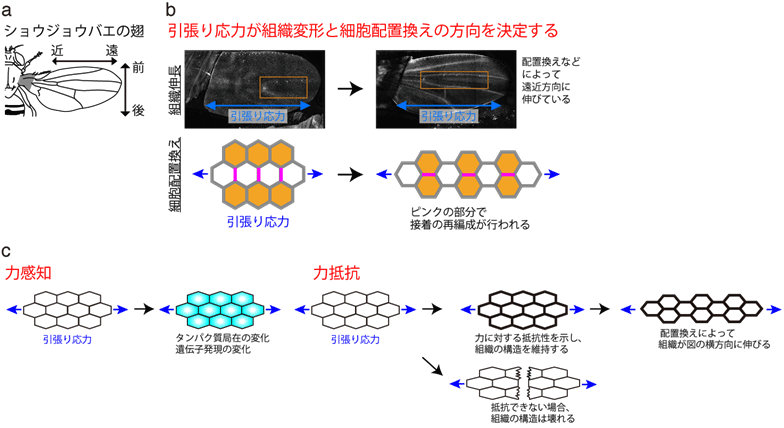
図1:研究の背景と問題設定
2.研究内容と成果
本研究では、組織に引張り応力がはたらくことで起こる細胞の配置換えの過程での、細胞の力感知・力抵抗の分子メカニズムの解析に取り組みました。
ショウジョウバエ翅上皮では、(引張り応力と直交する)前後軸方向の細胞接着面が短縮し、細胞接着面が組み換わった後に、遠近軸方向の細胞接着面が新生されます。研究グループは、F-アクチンを切断してアクチン細胞骨格の再編成を促進する「コフィリン」の働きを補助する「Actin interacting protein 1(AIP1)」 に注目しました。まず、AIP1が、コフィリンと機械的にリラックスした(=強い引張り力を受けていない)F-アクチンとの協同的結合を介して、前後軸方向の細胞接着面に濃縮することを見出しました。そして、このAIP1の細胞内の分布の偏りが細胞配置換えの方向決定に必要とされることを確認しました。
次に、AIP1とコフィリンが細胞配置換えの方向を制御する仕組みを解析する過程で、細胞接着面が組み換わる直前にアクトミオシン※5がリング状の構造を形成することを発見しました(図2上)。AIP1やコフィリンの発現量を減らしたり、アクチン細胞骨格の再編成を抑制したりすると、アクトミオシンのリング状構造が肥大化し、その中心部では「アファディン」や「α-カテニン」などの細胞間接着構造の構成因子が局在できていませんでした(図2中)。肥大化したアクトミオシンのリング状構造は生成と消失を繰り返し、遠近軸方向の細胞接着面が安定に形成されない場合があることがわかりました。興味深いことに、遺伝学的もしくは薬理学的操作により誘導されるアクトミオシンのリング状構造の肥大化を、組織引張り応力をなくすことで機械的にレスキューできる(細胞構造が正常に戻る)ことがわかりました(図2下)。以上から、「AIP1とコフィリンはアクチン細胞骨格や細胞間接着の再編成を調節して、組織引張り応力と直交する向きの細胞間接着面に機械的な負荷に対する構造的強度を付与し、その結果、細胞が正しい向きに並びかえられる」ことが明らかになりました(図3)。
本研究では、特定方向に強い組織応力による細胞配置換え方向制御と細胞六角格子化促進※6という、研究グループの過去の物理的な知見から出発して、分子遺伝学やライブイメージング、画像解析などの発生生物学・定量生物学的手法を主に用いることで、一つは、マクロスケールの機械的な力の場の情報がミクロスケールのアクチンフィラメント構造に変換されるということ、もう一つは、機械的負荷下における多細胞組織の構造強度と形態形成の最適なバランスがあるという二つのコンセプトを提唱することができました。特に、前者に関しては、アクチンの構造多型と応力、コフィリンなどのアクチン結合タンパク質との結合親和性の関係という人工的に再構成された細胞骨格系で得られた生物物理学知見から着想を得たことが重要な契機となりました。このように、複数の学術分野の視点や手法を統合したことが本研究成果につながりました。
本研究では、特定方向に強い組織応力による細胞配置換え方向制御と細胞六角格子化促進※6という、研究グループの過去の物理的な知見から出発して、分子遺伝学やライブイメージング、画像解析などの発生生物学・定量生物学的手法を主に用いることで、一つは、マクロスケールの機械的な力の場の情報がミクロスケールのアクチンフィラメント構造に変換されるということ、もう一つは、機械的負荷下における多細胞組織の構造強度と形態形成の最適なバランスがあるという二つのコンセプトを提唱することができました。特に、前者に関しては、アクチンの構造多型と応力、コフィリンなどのアクチン結合タンパク質との結合親和性の関係という人工的に再構成された細胞骨格系で得られた生物物理学知見から着想を得たことが重要な契機となりました。このように、複数の学術分野の視点や手法を統合したことが本研究成果につながりました。
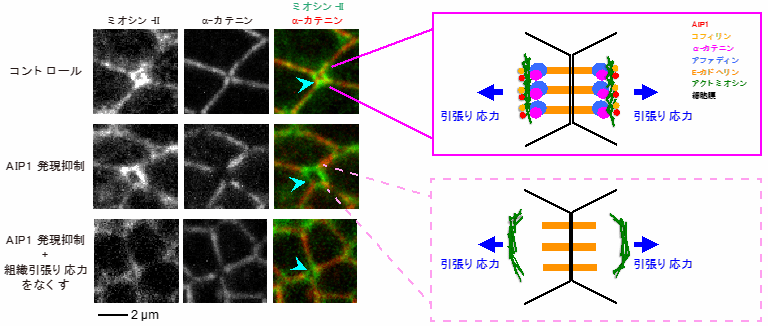
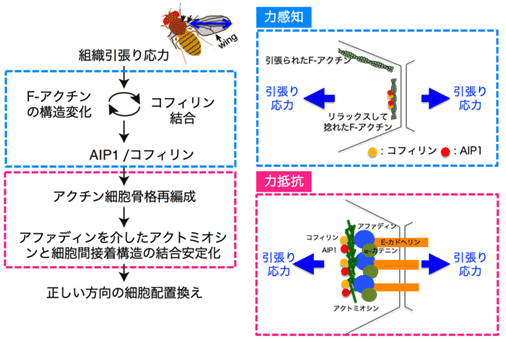
図3:研究成果のまとめと作業仮説
3.今後の展開
aip1とコフィリンはともに、酵母からヒトまで保存された遺伝子であり、本研究で明らかになったAIP1とコフィリンの働きにより細胞の動的な並び換えと機械的な構造強度を両立させる仕組みはヒトでも働いている可能性があります。
組織の変形は必ず、細胞の力感知と力抵抗を伴うことから、本研究で明らかになった分子メカニズムは個体発生の様々な局面で働いている可能性があります。今後、細胞分裂やプログラム細胞死などの他の形態形成プロセスにおけるAIP1とコフィリンの働きを検証することで、個体発生における力感知・力抵抗の分子メカニズムの理解が深まると期待されます。
4.用語解説
- ※1 上皮
- 生き物の体の表面を覆い、外界と体内部を分けるバリアとして働く組織。例えば、ヒトの腸上皮など。バリア機能を実現するために細胞どうしが細胞間接着分子を介して強固に接着している。上皮発生過程では、細胞どうしが接着したまま、互いの配置関係を動的に変える必要がある。
- ※2 応力
- 物体に外から力が作用したときに物体内部に生じる力。N/m2の次元を持つ。ショウジョウバエ翅上皮では組織の遠近軸方向に強い、異方的な引張り応力が働く。
- ※3 Actin interacting protein 1(AIP1)
- アクチンフィラメントとコフィリンに結合して、コフィリンのF-アクチン切断活性を亢進させるタンパク質。
- ※4 コフィリン
- アクチンに結合して、F-アクチンの脱重合と再編成を促進するタンパク質。コフィリンは、機械的にリラックスした、ねじれた(=強い引張り力を受けていない)アクチンフィラメントに結合しやすい。一方で、コフィリンは、アクチンフィラメントをねじることでF-アクチンの脱重合を促進する。
- ※5 アクトミオシン
- アクチンフィラメントと力を生みだす分子モーター、ミオシンの複合体。
- ※6 細胞六角格子化促進
- 上皮細胞を二次元的に並べる場合、蜂の巣のような六角格子がエネルギー的に最も安定である。個体発生過程では、五角形や七角形の細胞が混在する状況から、細胞配置換えを経て、六角形の細胞の割合が増える。当研究グループは以前、ショウジョウバエ翅上皮では、特定方向に強い組織応力が細胞配置換えの向きを揃えることで六角形細胞の増加を促進することを報告していた。
5.研究プロジェクトについて
本研究は以下の支援を受けて実施されました。
日本学術振興会科学研究費補助金補助金(15H01321)
日本学術振興会科学研究費補助金補助金(17K15125)
科学技術振興機構戦略的創造研究推進事業さきがけ (JPMJPR13A4)
国立研究開発法人日本医療研究開発機構の革新的先端研究開発支援事業(PRIME)
「メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出」研究開発領域における研究開発課題「応力場・変形場・シグナル場の同時計測とデータ同化による成長する上皮組織の力学の理解と予測」(研究開発代表者:杉村薫)の一環で行われました。
6.論文タイトル・著者
- 論文タイトル:
- AIP1 and cofilin ensure a resistance to tissue tension and promote directional cell rearrangement.
(参考訳:AIP1とコフィリンが、組織引張り応力に対する細胞の構造的安定性を保障し、方向性を持った細胞配置換えを促進する) - 著者:
- 井川敬介、杉村薫
- Nature Communications|DOI:
- 10.1038/s41467-018-05605-7
7.iCeMSについて
京都大学 高等研究院 物質-細胞統合システム拠点(iCeMS=アイセムス)は、文部科学省「世界トップレベル研究拠点(WPI)プログラム」に平成19年度に採択され、平成29年にはその研究水準および運営が世界トップレベルであるとして、「WPIアカデミー拠点」に認定された研究拠点です。iCeMSでは、生物学、物理学、化学の分野を超えて新しい学問を作り、その学問を社会に還元することを目標に活動している日本で唯一の研究所です。その新しい学問からは、汚水や空気の浄化といった環境問題の解決、脳の若返りといった医療に役立つ可能性を秘めたとてつもないアイデアが次々と生まれています。
詳しくはウェブサイトをご覧下さい。
問い合わせ先
研究内容について
杉村 薫(スギムラ・カオル)
京都大学 高等研究院 物質-細胞統合システム拠点(iCeMS)特定拠点准教授
電話:075-753-9866 Fax:075-753-9820
Eメール:sugimura-g"AT"icems.kyoto-u.ac.jp
京都大学iCeMSについて
遠山 真理(トオヤマ・マリ) 髙宮 泉水(タカミヤ・イズミ)
京都大学 高等研究院物質-細胞統合システム拠点(iCeMS)
パブリックエンゲージメントユニット
電話:075-753-9752 Eメール:pe"AT"mail2.adm.kyoto-u.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
TEL:03-6870-2224 FAX:03-6870-2246
E-mail:kenkyuk-ask"AT"amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成30年9月10日
最終更新日 平成30年9月10日


