新規作用機序に基づくB型肝炎ウイルス治療薬候補を同定
プレスリリース
東京大学
日本医療研究開発機構
発表者
關場 一磨(東京大学医学部附属病院 消化器内科/東京大学大学院医学系研究科 内科学専攻 消化器内科学 博士課程3年生)
大塚 基之(東京大学医学部附属病院 消化器内科/東京大学大学院医学系研究科 内科学専攻 消化器内科学 講師)
小池 和彦(東京大学医学部附属病院 消化器内科/東京大学大学院医学系研究科 内科学専攻 消化器内科学 教授)
発表のポイント
- B型肝炎ウイルス(注1)の複製に重要なウイルスタンパクHBxと宿主タンパクDDB1との結合を阻害する薬剤の効率的なスクリーニング系を構築し、ニタゾキサニドを同定しました。
- 現在B型肝炎治療に広く用いられている核酸アナログ製剤では抑えることのできないウイルスRNAの産生をニタゾキサニドが抑制することを確認しました。
- 今後、既存のB型肝炎治療薬では達成困難であるB型肝炎の治療目標「Functional cure」(HBs抗原陰性化)への展望を新たに拓くと期待されます。
発表概要
B型肝炎は、全世界で2億5千万人以上が罹患し毎年約90万人が死亡しているとされており、その克服は世界的な重要課題とされています。B型肝炎の長期予後改善のための治療目標はウイルスタンパクであるHBs抗原の陰性化(Functional cure)ですが、既存のB型肝炎治療薬では達成困難であり、新規治療法の登場が強く望まれています。そうした中、ウイルスタンパクHBxと宿主タンパクDDB1との結合を端緒とするウイルス複製の制御機構が徐々に明らかとなり、新しい治療標的として注目されてきました。東京大学医学部附属病院 消化器内科の關場一磨 大学院生、大塚基之 講師、小池和彦 教授らの研究グループは、相補型スプリットルシフェラーゼアッセイ技術(注2)を応用し、HBxとDDB1との結合阻害剤を簡便に探索できるスクリーニング系を構築し、それによってニタゾキサニドをB型肝炎治療候補薬剤として同定しました。さらに、ニタゾキサニドはHBxとDDB1結合を阻害することによって、ウイルスRNAをはじめとしたウイルス産物量を有意に抑えるという、既存B型肝炎治療薬には無い効果を有することを、初代ヒト肝細胞(注3)を用いた検討などで明らかにしました。ニタゾキサニドは原虫による腸炎の治療薬として米国食品医薬局(FDA)で既に認可されている薬剤であり、今後のB型肝炎治療薬への転用(ドラッグリポジショニング:注4)が期待されます。本研究成果は、米国東部夏時間10月24日にCellular and Molecular Gastroenterology and Hepatology(オンライン版)にて発表されました。なお、本研究は日本医療研究開発機構(AMED)肝炎等克服実用化研究事業の肝炎等克服緊急対策研究事業(研究開発課題名「B型肝炎ウイルスRNAと相互作用する宿主因子の網羅的同定とその制御による病態制御法開発」研究代表者:大塚基之)および文部科学省科学研究費補助金などの支援により行われました。
発表内容
研究の背景
B型肝炎ウイルスを体内から完全に排除することも、ウイルスRNAやウイルスタンパクの産生を止めることも、現在は困難です。これは、現在広く使われている抗ウイルス薬である逆転写酵素阻害剤(注5)が、ウイルスDNAの産生は効率的に阻害するものの、感染した肝細胞の核内にウイルスDNA複製の鋳型として存在するcccDNA(注6)からのウイルスRNA産生を抑制することが原理的にできないためと考えられています。したがって、ひとたび逆転写酵素阻害剤の服用を始めると一生服薬を継続せざるを得ず、患者さんの負担や医療経済的にも大きな問題となっています。
B型肝炎ウイルスの効率的な複製にはウイルスタンパクHBxや宿主タンパクDDB1が必要であることが以前から知られていましたが、その制御機構の詳細は明らかではありませんでした。本研究グループは、「HBxは、宿主のDDB1との結合を介して宿主ユビキチン・プロテアソーム系(注7)を利用し、本来はウイルスRNA転写に抑制的に働くはずの宿主タンパクSmc5/6複合体を分解してウイルスRNAの転写を活性化させている」という最近の報告(Decorsière, A. et al. Nature (2016). Murphy, C. M. et al. Cell Rep. (2016).)に着目しました。そして「ウイルスタンパクHBxと宿主タンパクDDB1との結合阻害剤を同定できれば、cccDNAからのウイルスRNA転写を抑制するSmc5/6の発現量を回復させ、ウイルスRNAやそこから産生されるウイルスタンパクなどの量を低下させることができるのではないか」と仮説を立てました。タンパクとタンパクとの結合阻害活性を測定するのは一般的に容易ではありませんが、近年の相補型スプリットルシフェラーゼアッセイ技術の登場によって、タンパクとタンパクとの結合状態が簡便にモニターできるようになり、それを応用すれば目的のHBx–DDB1結合阻害剤を簡便にスクリーニングできると考えました。そこで、本研究ではこのスクリーニング系を用いて米国食品医薬局(FDA)ですでに認可されている化合物ライブラリーをスクリーニング対象とすることで、臨床応用への「近道」として、「ドラッグリポジショニング」を目指すこととしました。
研究内容
まず、本研究グループはウイルスタンパクHBxと宿主タンパクDDB1との結合活性を簡便に測定するために、それぞれのタンパクにルシフェラーゼタンパクを断片状に付加した状態で発現することができるDNA分子を作製しました。それらのDNA分子を細胞内で共発現させると、HBxとDDB1との結合状態をルシフェラーゼタンパクの酵素活性の強さで簡便にモニターすることができました(図1)。ここに、FDAがすでに認可している817種の薬剤を添加してルシフェラーゼ活性値の変化を観察したところ、ニタゾキサニドという薬剤が強くルシフェラーゼ活性値を抑制したことから、ニタゾキサニドがHBx–DDB1結合阻害作用を有することが示唆されました。このニタゾキサニドのHBx–DDB1結合阻害作用は、免疫沈降法をはじめとした複数の別の実験で確認できました。
次に、HBx発現細胞におけるニタゾキサニドの投与によるSmc5の発現回復効果を検証したところ、ニタゾキサニドはSmc5の量を有意に回復しました。また、ミニサークルDNA技術(注8)を用いてウイルスのcccDNAを模倣するDNA分子を作製し、それに対するニタゾキサニドの効果を見たところ、ウイルスRNA転写が有意に抑制されました。さらに、ストップコドンを挿入してHBx発現を欠損させた変異型の擬似cccDNAでは、このニタゾキサニドによるウイルスRNA転写抑制効果は失われることから、ニタゾキサニドの効果はHBx依存的であることが確認されました。
最後に、初代ヒト肝細胞を用いたB型肝炎ウイルス感染系において、ニタゾキサニドはSmc5の発現回復をもたらし、ウイルスRNAをはじめ、ウイルスタンパク、ウイルスDNA、cccDNA量を低下させることが確認されました。
以上のことから、ニタゾキサニドは、HBx–DDB1結合阻害という作用機序を持つ、新規のB型肝炎治療薬となる可能性が示されました(図2)。
社会的意義・今後の予定
これらの結果は、ニタゾキサニドがHBx–DDB1結合阻害剤として、既存のB型肝炎治療薬では達成困難なHBs抗原陰性化(Functional cure)を実現する可能性を有していることを示しています。また、cccDNA量自体の減少効果も認めたことから、ウイルスRNA転写抑制にとどまらずウイルス完全排除へ向けた病態解明への一助ともなる可能性があります。
今後は、これらのデータをもとに、化合物構造の最適化や動物モデルなどでの検討を加えて、ヒトへの応用の可能性を探っていきたいと考えています。
発表雑誌
- 雑誌名:
- Cellular and Molecular Gastroenterology and Hepatology
- 論文タイトル:
- Inhibition of HBV transcription from cccDNA with nitazoxanide by targeting the HBx–DDB1 interaction
- 著者:
- 關場 一磨、大塚 基之*、大野 元子、山上 まり、岸川 孝弘、鈴木 辰典、石橋 嶺、清宮 崇博、田中 恵理、小池 和彦(* 責任著者)
- DOI番号:
- 10.1016/j.jcmgh.2018.10.010
- アブストラクトURL:
- https://www.cmghjournal.org/article/S2352-345X(18)30156-5/fulltext
用語解説
- 注1)B型肝炎ウイルス:
- 血液や体液などを介して肝臓に感染するDNAウイルス。感染したウイルスは炎症(肝炎)を惹起し、肝硬変や肝癌の原因となる。世界保健機関(WHO)は、B型肝炎ウイルス感染者は世界中で20億人、そのうちB型肝炎ウイルス持続感染者は2.57億人、さらに年間90万人がB型肝炎ウイルス関連疾患で死亡していると報告し、その克服を重要課題として挙げている。
- 注2)相補型スプリットルシフェラーゼアッセイ技術:
- ルシフェラーゼ(発光酵素)のDNA配列を適切な部位で2つに分断し、生成したルシフェラーゼ断片(スプリットルシフェラーゼ)が細胞内で物理的に近づくと、構造的相補性に基づき分断されていても活性を回復する現象を活用した測定技術。
- 注3)初代ヒト肝細胞:
- ヒトから採取された肝臓組織から培養した細胞。B型肝炎ウイルスはヒトやチンパンジーなど、感染できる宿主が限られており、一般的に研究に用いられる肝癌細胞株にも感染しないため、B型肝炎ウイルスの感染実験を行うには初代ヒト肝細胞を用いる。
- 注4)ドラッグリポジショニング:
- 目的の疾患の治療薬を、別の疾患に有効な治療薬の中から見つけ出すこと。この手法では、すでにヒトでの安全性や薬物動態の試験に合格している薬剤を用いるため、新薬であれば行わなければいけない試験を省略できる、薬剤の製造方法が確立しているため開発期間の短縮・研究開発コストを低減できる、といった利点がある。高騰し続けている医薬品価格の抑制への寄与も期待される。
- 注5)逆転写酵素阻害剤:
- B型肝炎の治療に広く用いられているウイルスDNA複製阻害剤。B型肝炎ウイルスはその生活環の中で、プレゲノムRNAからDNAへの逆転写を行うが、逆転写酵素阻害剤はウイルスDNAポリメラーゼ/逆転写酵素による基質の取り込みを競合的に阻害してDNA鎖の伸長を停止することでウイルスの増殖を阻害する。エンテカビルやテノホビルがその代表薬。
- 注6)cccDNA:
- covalently closed circular DNAの略。B型肝炎ウイルスは肝細胞に侵入すると、もともと不完全環状二本鎖の形態をとっているウイルスDNAが核内に移行し、完全閉鎖環状二本鎖の形態cccDNAに変換される。cccDNAは核内に安定的に存在し続け、ウイルスRNAを作るための鋳型として働く。既存のB型肝炎ウイルス治療薬では排除が困難である。
- 注7)ユビキチン・プロテアソーム系:
- ユビキチンの活性化から結合、プロテアソーム(タンパク分解酵素)によるタンパク分解までを担う一連の生化学経路。ユビキチン活性化酵素(E1)、ユビキチン結合酵素(E2)、ユビキチンリガーゼ(E3)の3種類の酵素の働きで、E3に選択的に識別された標的タンパクがポリユビキチン修飾を受けると、ポリユビキチン鎖が標識となって、ユビキチン修飾を受けたタンパクはプロテアソーム(タンパク分解酵素)によって分解される。
- 注8)ミニサークルDNA技術:
- プラスミドDNAからバクテリア由来の複製開始点や抗生物質耐性遺伝子などバックボーン部分を取り除き、標的遺伝子配列のみの環状2本鎖DNA(ミニサークルDNA)を作成する技術。この技術を用いると、B型肝炎ウイルス遺伝子配列のみを完全閉鎖二本鎖の状態で合成することができ、cccDNAを模倣した状態を再現できる。
添付資料
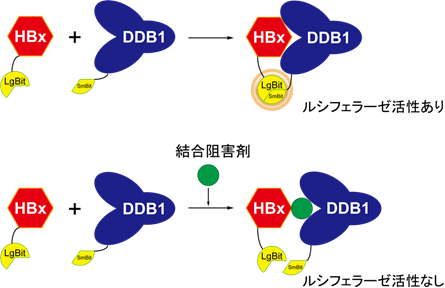
図1.スプリットルシフェラーゼを用いたHBx–DDB1結合阻害剤のスクリーニング
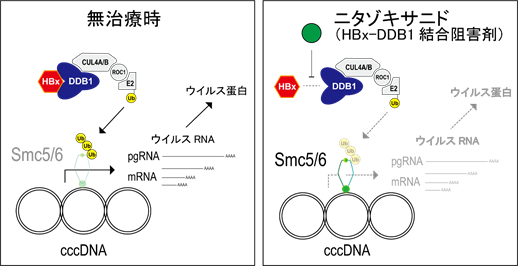
図2.ニタゾキサニド(HBx–DDB1結合阻害剤)によるB型肝炎ウイルスRNAの転写抑制
問い合わせ先
研究内容に関するお問い合わせ先
東京大学医学部附属病院 消化器内科
大学院生 關場 一磨(せきば かずま)
電話:03-5800-8812(研究室直通)
E-mail:ksekiba-tky"AT"umin.ac.jp
講師 大塚 基之(おおつか もとゆき)
電話:03-5800-8812(研究室直通)
E-mail:otsukamo-tky"AT"umin.ac.jp
取材に関するお問い合わせ先
東京大学医学部附属病院 パブリック・リレーションセンター
担当:渡部、小岩井
電話:03-5800-9188(直通)
E-mail:pr"AT"adm.h.u-tokyo.ac.jp
AMEDの事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構 戦略推進部 感染症研究課
(肝炎等克服実用化研究事業 担当)
電話:03-6870-2225 FAX:03-6870-2243
E-mail:hepatitis"AT"amed.go.jp
※E-mailは上記アドレス”AT”の部分を@に変えてください。
関連リンク
掲載日 平成30年10月25日
最終更新日 平成30年10月25日


