日本発・小児期Leigh脳症を起こす新しい病因遺伝子の発見
プレスリリース
千葉県こども病院
千葉県がんセンター
日本医療研究開発機構
千葉県こども病院遺伝診療センター・代謝科/千葉県がんセンター研究所の研究グループは、埼玉医科大学、順天堂大学と共同研究で、ミトコンドリア病を対象とした新規病因遺伝子の同定・病態解明研究や創薬研究を進めています。この度、Leigh脳症を呈した患者さんにおいて、PTCD3遺伝子(別名 MRPS39)を新しい病因遺伝子として同定しました。PTCD3機能異常はミトコンドリアの翻訳の障害を引き起こし、その結果ミトコンドリア機能不全が生じることを明らかにしました。プロテオーム解析によっても、ミトコンドリアの翻訳や呼吸鎖複合体の異常を証明することができました。本研究は、論文誌『Neurogenetics』に掲載されたので、報告いたします。
発表のポイント
- Leigh脳症*1(ミトコンドリア病*2の一病型)の患者で全エクソーム解析*3を行い、新規病因遺伝子としてPTCD3遺伝子を世界で初めて同定し、論文誌『Neurogenetics』に報告しました。
- PTCD3機能異常はミトコンドリアリボソーム*4の形成不全を生じ、ミトコンドリアタンパク質の翻訳の減少をもたらしていました。さらに、ミトコンドリア呼吸鎖複合体*5の形成にも影響し、結果としてATP合成の低下が生じていました。
- Leigh脳症は、多様な遺伝子異常によって引き起こされることがわかっており、その全容および病態発症機構は十分に理解されていません。今回の新規原因遺伝子の発見が、Leigh脳症のさらなる病態解明の進展や遺伝子診断の向上、新規治療法の開発などにつながるものと期待されます。
研究の背景
千葉県こども病院/千葉県がんセンター研究所(村山圭 部長)は順天堂大学・難病の診断と治療研究センター(岡﨑康司 教授・センター長)、埼玉医科大学小児科(大竹明 教授)と共同で、2007年から希少難病であるミトコンドリア病の生化学診断と遺伝子診断に取り組んできました。2014年から日本医療研究開発機構(AMED)による難治性疾患実用化研究事業「ミトコンドリア病診療の質を高める、レジストリシステムの構築、診断基準・診療ガイドラインの策定および診断システムの整備を行う臨床研究」、2016年から「創薬を見据えた、ミトコンドリア病の新規病因遺伝子の発見とその病態解明」、2017年から「ミトコンドリア病診療マニュアルの改定を見据えた、診療に直結させるミトコンドリア病・各臨床病型のエビデンス創出研究」を通して、日本におけるミトコンドリア病診療の基盤構築に寄与してきました。また、同じく臨床ゲノム情報統合データベース整備事業「希少・難治性疾患領域における臨床ゲノムデータストレージの整備に関する研究」においてもミトコンドリア病のゲノムデータ登録に携わってきました。特にミトコンドリア病の原因は多岐に渡っており、ゲノム解析により新規病因遺伝子を見つけ、その結果を病態解明や創薬への展開につなげていくことが喫緊の課題となっています。
Leigh 脳症は、ミトコンドリア病の一つの病型で、頭部の画像所見で基底核、脳幹部に左右対称性壊死性病変をきたすという特徴があります。多くは乳幼児期に発症し、知的退行、筋緊張低下、けいれん発作など進行性の神経変性症状を示します。これまでに、75以上の原因遺伝子が見つかっており、ミトコンドリア遺伝子および核遺伝子のいずれによっても疾患が発症することが明らかになっています。約20%がミトコンドリア遺伝子変異によるもので、それ以外は核遺伝子変異によって生じます。本研究では、新たな原因遺伝子としてPTCD3を同定し、プロテオーム解析*6などを駆使することで疾患発症の分子機序を明らかにしました。
概要
低出生体重、成長障害、ミオクローヌス*7、ミトコンドリア脳症を呈した症例に対し包括的遺伝子解析、および候補遺伝子の機能解析を行い、これまでLeigh脳症の原因遺伝子として報告のなかったPTCD3遺伝子を同定しました。PTCD3の異常はミトコンドリアリボソームの形成異常や、ミトコンドリアタンパク質翻訳異常の原因となり、それがミトコンドリア呼吸鎖複合体の形成および活性減少を引き起こしていました。プロテオーム解析を行うことで、ミトコンドリア・リボソーム・スモールサブユニットおよび呼吸鎖複合体Ⅰ, Ⅲ, Ⅳが選択的に分解されていることも明らかにしました。さらに、正常PTCD3を細胞に戻すことで、上記のミトコンドリア機能異常を細胞レベルで回復することができました。以上のことをもって、PTCD3を新たなLeigh脳症の原因遺伝子として、論文誌『Neurogenetics』で報告しました。
PTCD3異常症の特徴
PTCD3異常症は、子宮内発育遅延、発達遅滞、ミオクローヌス、ミトコンドリア脳症などを呈す疾患です。頭部MRI画像診断では、大脳基底核や脳幹で両側対称性白質病変を示しており、これは典型的なLeigh脳症と一致していました(図1)。患者由来線維芽細胞を用いたミトコンドリア呼吸鎖複合体活性診断では、呼吸鎖ⅠとⅣの低下を示していました。
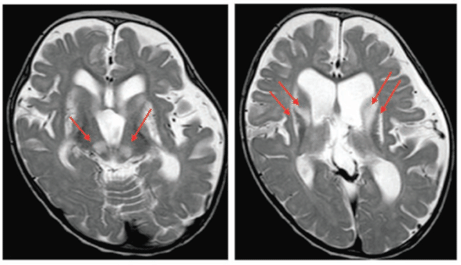
図1.大脳基底核、脳幹の両側対称性白質病変(T2強調画像)
PTCD3遺伝子変異の同定
全エクソーム解析で、PTCD3遺伝子のフレームシフトを起こす挿入とスプライシング異常*8を起こす1塩基置換が同定されました(図2)。実際に、スプライシング異常によって7番目のエクソンのスキップが生じることを明らかにしました。皮膚由来線維芽細胞を用いたウエスタン・ブロッティングでは、患者由来細胞でPTCD3タンパク質の発現低下を認めました。
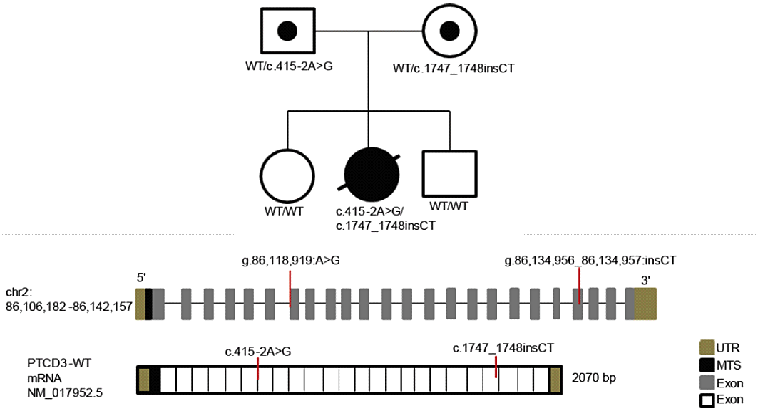
図2.PTCD3変異
ミトコンドリア翻訳異常とリボソーム複合体形成異常
ミトコンドリアリボソームはスモールサブユニット(28S) とラージサブユニット(39S) から構成されており、PTCD3はスモールサブユニットの一つの構成因子として報告されています。このようなことから、PTCD3の異常はスモールサブユニットの形成やミトコンドリアタンパク質の翻訳異常をもたらすことが予想されました。実際にスモールサブユニットの形成とミトコンドリアタンパク質の翻訳を調べたところ、患者細胞ではサブユニットの形成と翻訳は優位に低下していました(図3)。
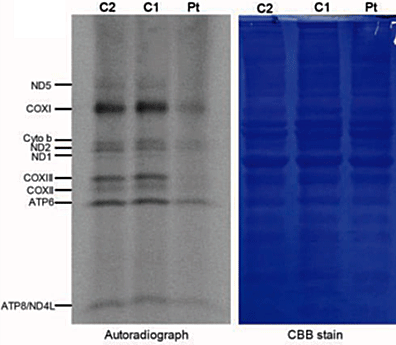
図3.ミトコンドリアの翻訳異常
また、呼吸鎖複合体の構成タンパク質の発現低下と複合体形成の異常を明らかにしました。さらにATP合成*9の低下も確認しています。これらのミトコンドリア機能異常は正常型のPTCD3を患者由来の細胞に強制発現することで機能が回復できることも明らかにしました(図4)。
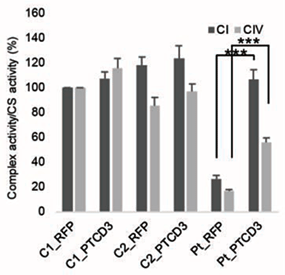
図4.PTCD3の強制発現によるミトコンドリア呼吸鎖機能の回復
プロテオーム解析によるミトコンドリアタンパク質の網羅的解析
プロテオーム解析を用いて、ミトコンドリアタンパク質の網羅的な変化を明らかにしました。リボソームの構成因子について詳細に確認したところ、スモールサブユニットの構成因子が軒並み減少していたのに対し、ラージサブユニットの構成因子は正常でした。つまり選択的にスモールサブユニットが分解されていることが明らかになりました。また、呼吸鎖複合体を調べると、呼吸鎖複合体Ⅰ, Ⅲ, Ⅳが減少しているのに対して、呼吸鎖Ⅱ, Ⅴは正常であることを明らかにしました。
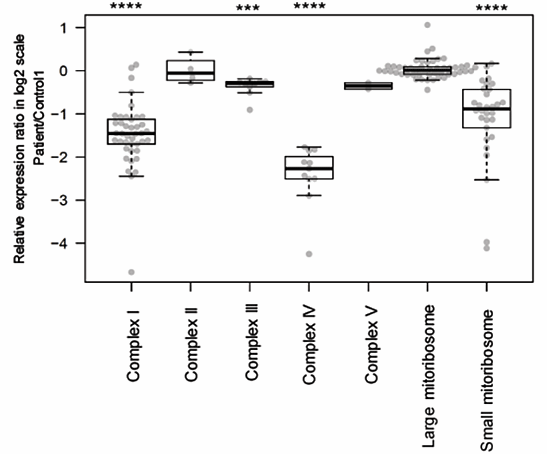
図5.プロテオーム解析
まとめ
PTCD3遺伝子をLeigh脳症の原因遺伝子として世界で初めて同定しました。PTCD3遺伝子異常は、ミトコンドリアタンパク質翻訳異常を介して、ミトコンドリア呼吸鎖複合体機能低下を引き起こし、さらに低出生体重、発達遅滞、ミオクローヌス、ミトコンドリア脳症などの症状に結びつくことを明らかにしました。今回の研究成果を遺伝子診断システムに還元することで、診断率の向上が期待されます。また、プロテオーム解析が大きな力を発揮し、分子機序の解明に大きな役割を果たしたため、この分析系を新たな原因遺伝子発見にも役立てることができると考えています。
掲載論文
- タイトル
- Mitochondrial ribosomal protein PTCD3 mutations cause oxidative phosphorylation defects with Leigh syndrome
- 著者名
- Nurun Nahar Borna, 木下 善仁, 神田 将和, Sze Chern Lim, 志村 優, Yibo Wu, 茂櫛 薫, 八塚 由紀子, 原嶋 宏子, 久冨 雄一朗, 伏見 拓矢, 市本 景子, 村山 圭, 大竹 明, 岡﨑 康司
- 雑誌名
- Neurogenetics
用語解説
- ※1 Leigh脳症
- 1951年にイギリスの神経学者Denis Archibald Leighによって亜急性壊死性脳脊髄症(subacute necrotizing encephalomyelopathy)として報告された疾患です。40,000出生に1人の割合で発症するとされています。画像所見で、脳幹や大脳基底核に両側対称性病変を認めることを特徴とし、発達遅滞、筋力・筋緊張低下、呼吸障害、知的退行などを主症状とします。
- ※2 ミトコンドリア病
- ミトコンドリア病とは、ミトコンドリアの働きが低下することが原因で起こる病気の総称です。エネルギー代謝系(ミトコンドリア呼吸鎖)の先天代謝異常症です。出生 5,000人に1人の割合で発症し、いかなる症状、いかなる臓器・組織、何歳でも、いかなる遺伝形式でも発病します。特に幼少時期発症例は症状が多彩で重篤致死の症例が多いことが分かっています。MELASは学童期~成人期に多く、m.3243A>Gが8割を占めます。根治的治療法がなく、対症的治療法にとどまるのが現状です。
- ※3 全エクソーム解析
- 全エクソーム解析(Whole-exome sequencing; WES)は、ゲノムのなかでタンパク質をコードするエクソン領域を選択的に配列解読する手法です。対象となるのはヒトゲノムのうち2%未満の領域となります。エクソンは、極めて重要な領域なため、ここに多くの疾患の原因となる変異が存在しています。
- ※4 リボソーム
- DNAはRNAに変換され、その後RNAがタンパク質に変換されます。RNAからタンパク質になる過程を翻訳と呼び、この過程にリボソームが必要になります。リボソームはtRNAという分子を介して、RNAからアミノ酸を合成するプロセスを仲介します。
- ※5 ミトコンドリア呼吸鎖複合体
- ミトコンドリアでは生命のエネルギー源であるATPを合成しており、ミトコンドリア呼吸鎖複合体のⅠ~Ⅴまでがその合成に関わっています。複合Ⅰ~Ⅳは、酸化還元反応を利用し、ミトコンドリア内膜を介してプロトン(H+)を輸送します。複合体Ⅴは逆向きのプロトンの流れを利用してATPを作り出します。
- ※6 プロテオーム解析
- タンパク質を網羅的に調べる手法で、タンパク質の増加減少を明らかにすることができます。プロテオーム(Proteome)はタンパク質Protein と、「全体」を意味する -omeに由来した言葉です。
- ※7 ミオクローヌス
- 大脳皮質、視床、基底核、脳幹、小脳、脊髄などの障害に起因し、筋の一部あるいは一連の筋群が瞬間的な不随意的収縮をすることによって起こる動きのことをいいます。
- ※8 スプライシング異常
- mRNAが成熟する過程で、タンパク質をコードするエクソン領域がスプライシングによりイントロン(タンパク質をコードしないDNA領域)から切り離され、連結されます。スプライシングが起こる領域の遺伝子変異は、特定のエクソンを適切に連結できなくしたり(エクソンのスキップ)、適切な位置のスプライシングを妨げたりします。
- ※9 ATP合成
- ※5で説明した通り、ミトコンドリアが生命のエネルギー源であるATPを合成しています。ミトコンドリアでのATP合成の低下は、生命活動に重大な障害をもたらし、疾患の発症に繋がります。
お問い合わせ先
本件に関するお問い合わせ先
千葉県こども病院
事務局医事経営課
Tel:043-292-2111
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構
戦略推進部 難病研究課
Tel:03-6870-2223
E-mail:nambyo-info"AT"amed.go.jp
※E-mailは上記アドレス"AT"の部分を@に変えてください。
関連リンク
掲載日 平成31年2月4日
最終更新日 平成31年2月4日


