プレスリリース インフルエンザウイルスの新たな抗原性変化を解明
プレスリリース
東京大学
日本医療研究開発機構
発表者
河岡 義裕(東京大学医科学研究所 感染・免疫部門 ウイルス感染分野 教授)
発表のポイント
- インフルエンザウイルスのノイラミニダーゼ(NA)蛋白質の「側面領域」を認識する抗体はNAの酵素活性を阻害しないが、ヒトの免疫細胞を活性化することで感染防御に寄与することを発見した。
- NAの酵素活性阻害を指標とした従来の抗原解析法では、インフルエンザウイルスのNA蛋白質の抗原性を正確に評価できていないことが明らかとなった。
- 本研究の成果はワクチン株の選定において重要な知見となり得る。
発表概要
インフルエンザウイルスのノイラミニダーゼ(NA)蛋白質に対する抗体の機能解析は、NA蛋白質の酵素活性部位周辺を認識し、その酵素活性を阻害する活性(Neuraminidase inhibition; NI活性)をもつ抗体について行われてきました。NI活性をもつ抗体による感染阻害から逃れるために、NA蛋白質の活性部位周辺にはアミノ酸変異が生じています。しかしながら、活性部位から離れた「側面領域」にもアミノ酸変異が高度に蓄積された領域があります(図1)。この領域にアミノ酸変異が生じる理由は不明でした。
東京大学医科学研究所の河岡義裕教授のグループは、NA蛋白質の側面領域を認識する抗体を解析することで、NI活性を持たない抗体がヒトの免疫細胞を活性化することで感染防御することを発見しました。さらに、NA側面領域のアミノ酸変異が、そのような抗体から逃れるために引き起こされていることを明らかにしました。
現在NAの抗原性はNI活性をもつ抗体のみを対象として解析されていますが、本研究の成果はNA蛋白質の抗原性評価方法を改良する必要性を示唆しています。近年の研究により、NAに対する抗体が感染防御に重要であることが明らかとなっているため、本研究の成果はワクチン開発において重要な知見となります。
発表内容
①研究の背景・先行研究における問題点
A型インフルエンザウイルスの粒子上には、2種類の糖蛋白質(HA蛋白質とNA蛋白質)が存在します。HA蛋白質が細胞表面上の受容体であるシアル酸に結合することでウイルスの侵入が開始され、NA蛋白質がシアル酸を切断すること(シアリダーゼ活性)で子孫ウイルスが放出されます。これまで、HA蛋白質に対する抗体がインフルエンザウイルスの感染防御に主に寄与していると考えられてきましたが、近年の研究によりNA蛋白質に対する抗体も感染防御に重要であることがわかってきました。感染防御に働く抗NA抗体として、NA蛋白質の酵素活性部位の周辺に結合し、NA蛋白質のシアリダーゼ活性を阻害するNI活性をもつ抗体が注目され、感染防御機構などの解析が行われてきました。そのなかで、一部の抗NA抗体はNI活性に加えて、Fc受容体(注1)を介してマクロファージ、好中球およびナチュラルキラー細胞といった免疫細胞を活性化することで感染防御に寄与することが明らかとなっています。感染を防御する抗体から逃れるために、インフルエンザウイルスの抗原部位にアミノ酸変異が生じ、抗原性が変化します。実際に、過去の流行株のNA蛋白質のアミノ酸配列を比較し、各アミノ酸の変異頻度を算出したところ、シアリダーゼ活性部位周辺には高い頻度でアミノ酸変異が生じていました(図1)。これらのアミノ酸変異は、NI活性を持つ抗体から逃れるために生じたものと考えられます。一方で、シアリダーゼ活性部位から離れている「NA蛋白質の側面領域」にも高頻度にアミノ酸変異が生じていました。これらの領域に、高頻度でアミノ酸変異が生じる理由は不明です。
②研究内容
本研究では、インフルエンザウイルス感染患者からNA蛋白質に対するモノクローナル抗体を7種類作製し解析を行いました。まず、抗体の認識部位を同定するため、さまざまな分離株に対する反応性をもとに変異ウイルスを作製し、抗体の結合性を検証したところ、NA側面のアミノ酸変異により抗体の結合が消失しました。このことから、本研究の抗体がNA蛋白質の側面部位を認識していることが分かりました。次に、NI活性を持つかどうかと、マウスを致死的なウイルス感染から防御できるかどうかを検証した結果、一部の抗体はNI活性を示さなかったものの、Fc受容体を介した免疫細胞の活性化によりウイルス感染からマウスを防御できることが明らかとなりました(図2)。また、感染患者の血清を調べることで、NA側面部位に対する抗体が感染により誘導されることを発見し、さらにNA蛋白質側面の抗原性が変化していることも明らかにしました(図3)。
以上の結果から、NA蛋白質の側面領域を認識し、NI活性を持たない抗体も免疫細胞を活性化することで生体での感染を防御することがわかりました。また、NA蛋白質側面のアミノ酸変異の蓄積も感染防御活性を持つ抗体の選択圧により引き起こされていることが示唆されました。
③社会的意義
近年の研究により、NA蛋白質に対する抗体が感染防御に重要であることが明らかとなっています。そのため、NA蛋白質の抗原性を正確に評価することは、効果的なワクチン株の選定において非常に重要です。現在NA蛋白質の抗原性はNI活性を指標として解析されており、NI活性を持つ抗体の反応性により評価されています。本研究の成果は、従来のNI活性のみに着目した解析手法ではNA蛋白質の抗原性を評価するには十分でないことを示唆しており、NI活性を持たないが感染を防御する抗体も含めて検出できる新たな評価方法が必要であることを示しています。
本研究成果は、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(LEAP)「インフルエンザ制圧を目指した革新的治療・予防法の研究・開発」、感染症研究国際展開戦略プログラム(J-GRID)「中国で発生した高病原性H7N9鳥インフルエンザウイルスのリスク評価並びにワクチン開発に資する研究」、文部科学省(MEXT)新学術領域研究などの一環として得られました。
発表雑誌
- 雑誌名:
- Nature Microbiology
- 論文タイトル:
- Antigenic drift originating from changes to the lateral surface of the neuraminidase head of influenza A virus.
- 著者:
- Atsuhiro Yasuhara, Seiya Yamayoshi*, Maki Kiso, Yuko Sakai-Tagawa, Michiko Koga, Eisuke Adachi, Tadashi Kikuchi, I-Hsuan Wang, Shinya Yamada, and Yoshihiro Kawaoka*
- DOI番号:
- 10.1038/s41564-019-0401-1
用語解説
- (注1)Fc受容体:
- 抗体のFc (Fragment, crystallizable) 領域と結合できる受容体。抗体はその構造上および機能上の違いから、Fabおよび Fc と呼ばれる二つの部位に分けられます。Fab (Fragment, antigen binding) 領域は抗原結合部位を構成しており、Fc領域 は免疫細胞のFc 受容体への結合や、補体系への関与などによって、免疫系のシグナル伝達に重要な役割を果たしています。
添付資料

図1.NA蛋白質の立体構造とアミノ酸変異頻度のマッピング
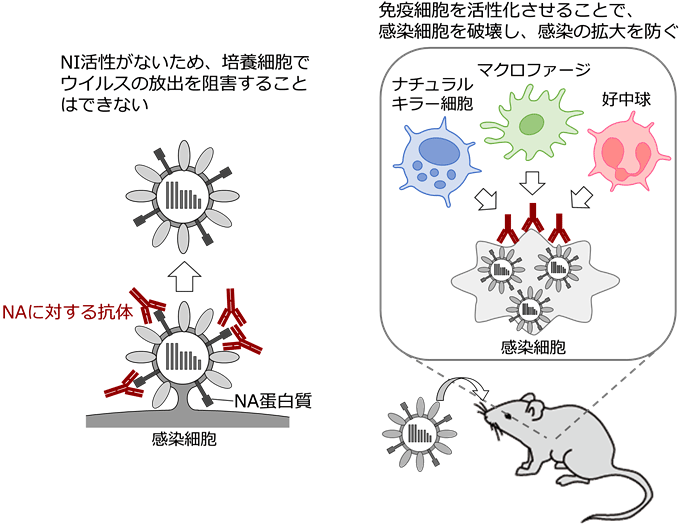
図2.本研究の抗NA抗体の感染防御機構
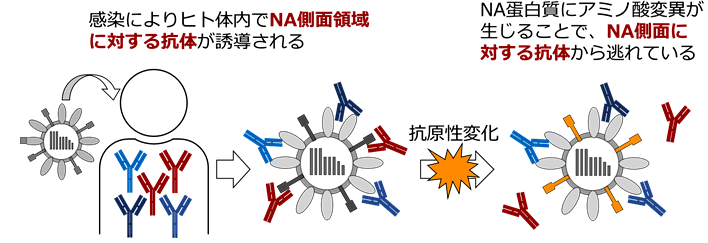
図3.感染による抗体誘導と抗原性の変化
お問い合わせ先
東京大学医科学研究所ウイルス感染分野
教授 河岡 義裕(カワオカ ヨシヒロ)
Tel:03-5449-5310(海外出張中のため、なるべくメールでお問い合わせください)
Email:kawaoka"AT"ims.u-tokyo.ac.jp
AMED事業に関する問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
創薬戦略部 医薬品研究課
革新的先端研究開発支援事業(インキュベートタイプ)担当
Tel:03-6870-2219
E-mail:kenkyuk-LEAP"At"amed.go.jp
戦略推進部 感染症研究課
TEL:03-6870-2225
E-mail:jgrid"AT"amed.go.jp
※E-mailは上記アドレス"AT"の部分を@に変えてください。
掲載日 平成31年3月19日
最終更新日 平成31年3月19日


