プレスリリース 抗ウイルス免疫分子「RIG-I」の機能を阻害する宿主mRNAを発見!
プレスリリース
金沢大学
日本医療研究開発機構
金沢大学医薬保健研究域保健学系の本多政夫教授および村居和寿博士研究員らの研究グループは、医薬保健研究域医学系の金子周一教授および篁俊成教授らとともに、C型肝炎ウイルス(HCV : Hepatitis C virus)(※1)感染時に、 主に肝臓で産生される分泌タンパク質であるセレノプロテインP(※2)のmRNAが、抗ウイルス免疫分子であるRIG-I(Retinoic acid-inducible gene-I)(※3)と結合することで、その機能を阻害し、自然免疫機構を制御することを明らかにしました。
C型肝炎に感染すると、同時に、インスリンの機能低下による代謝異常を特徴とする2型糖尿病になりやすいことが知られています。また、C型肝炎の治療には抗ウイルス薬の投与などを使用する治療が中心となりますが、2型糖尿病を患ったC型肝炎患者では、インターフェロン(IFN)による抗ウイルス治療の効果が低いことが報告されていました。しかし、そのメカニズムや因果関係は未だ明らかにはされていませんでした。
今回、本研究グループは、世界に先駆けて報告したセレノプロテインPという糖尿病関連因子に着目し、培養細胞・マウス・臨床検体を用いた研究によって、HCV感染・自然免疫・代謝性疾患の関係性を明らかにしました。HCV感染によって発現誘導されたセレノプロテインPのmRNAが、抗ウイルス免疫分子であるRIG-Iタンパクに結合し、活性化に必要な構造変化を妨げることにより、抗ウイルス作用を有するIFNの誘導を抑制していることが分かりました。
これらの知見は将来、ウイルス感染や代謝性疾患による免疫システム破綻のメカニズムの解明に活用されることが期待されます。
本研究成果は、2019年4月10日11時(米国東海岸標準時間)米国科学誌「Cell Host & Microbe」のオンライン版に掲載される予定です。
研究の背景
HCVは、世界的に約8千万人もの人々が慢性感染している肝指向性のウイルスであり、HCVに感染した肝臓は、慢性肝炎・肝硬変を経て、やがて肝細胞がんを発症するようになります。近年、ウイルス構成タンパクを標的としたDAAs(Direct-acting antiviral drugs)(※4)と呼ばれる薬剤の開発により、ウイルス排除率が90%以上にまで向上しました。しかしながら、DAAs治療不成功のメカニズムは未だ解明されていません。
肝臓は、炭水化物・タンパク質・脂質の代謝に必要不可欠な臓器であると同時に、毒素や病原体の処理、免疫応答の制御にも重要な役割を担っています。本研究グループは以前、肝臓由来の分泌タンパクであるセレノプロテインPがインスリン抵抗性を引き起こし、2型糖尿病の病態形成に関与することを報告しました(Cell Metabolism 2010;12(5):483-495)。興味深いことに、2型糖尿病を併発したC型慢性肝炎患者においては、IFNによる抗ウイルス治療に対し抵抗性を示す傾向があると報告されています。そこで本研究では、セレノプロテインPに焦点を当て、HCV感染と2型糖尿病の臨床的関連性を検討しました。
研究成果の概要
本研究グループは、培養細胞・マウス・臨床検体を用いた研究から、セレノプロテインPが肝臓での抗ウイルス免疫応答に与える影響を検討しました。
培養細胞を用いた実験において、HCV感染はセレノプロテインPの発現を上昇させることが分かりました。また、臨床検体を用いた解析からは、健常人と比べてC型慢性肝炎患者では血清中のセレノプロテインPの発現が上昇しているとともに、セレノプロテインPが高発現している患者群においては、DAAsを用いた抗ウイルス治療が効きにくいことが明らかになりました。
一方、セレノプロテインPの発現を抑制した細胞において、HCV複製の顕著な抑制が認められました。またその細胞では、抗ウイルス作用を有する IFNの産生が亢進していることが明らかになりました。ヒトには、細胞内に侵入したウイルスを検知してIFNを産生するシステムが存在しており、その際にウイルス由来のRNAを認識してIFN産出の誘導を引き起こす代表的な分子として、RIG-IとMDA5(Melanoma differentiation-associated gene 5)が報告されています。RIG-IとMDA5は、互いに相同性の高いヘリカーゼドメイン(※5)を有していますが、認識できるRNAの構造や配列(PAMP : Pathogen-associated molecular pattern)(※6)が異なっており、HCVはRIG-IとMDA5いずれにも認識されうると考えられています。そこで、RIG-IとMDA5をノックアウトした細胞を用いて実験を行なったところ、セレノプロテインP はRIG-I 経路に依存した自然免疫応答を特異的に制御していることが分かりました。
次に、その制御メカニズムに関して詳細な検討を行いました。セレノプロテインPの精製タンパクおよび合成RNAを用いた実験から、セレノプロテインPによる自然免疫制御は、タンパクによるものではなく、mRNAによって引き起こされることが明らかになりました。RIG-IにウイルスRNAが結合すると、RIG-I が持つATPアーゼ活性が働いて立体構造の変化およびRIG-Iの多量体形成が起こり、ミトコンドリア膜上のタンパクと結合することでIFN産生シグナルが活性化します。セレノプロテインPのmRNAを過剰発現させると、RIG-Iの活性化ステップに重要なATPアーゼ活性, RIG-Iの多量体形成、ミトコンドリアへの局在が阻害されることが分かりました。その制御メカニズムとして、セレノプロテインPのmRNAは、RIG-Iの制御ドメイン(Regulatory domain:RD)と呼ばれるウイルスRNAを認識し捕捉する領域に特異的に結合して相互作用することにより、RIG-Iの活性化に必要な立体構造変化を阻害し、自然免疫を負に制御していることを明らかにしました。(図)
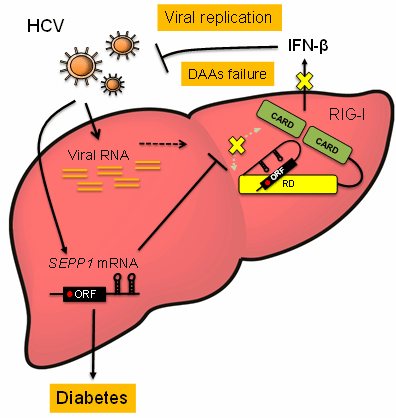
図.HCV感染によって誘導されたセレノプロテインPのmRNAによる自然免疫制御メカニズム
一方、セレノプロテインPがコードされている遺伝子であるセレノプロテインPのmRNAは、RIG-Iの制御ドメイン(Regulatory domain:RD)に結合し、抗ウイルス作用を有するI型インターフェロン(IFN-β)の産生を阻害する。その結果、ウイルス複製(Viral replication)が上昇しDAAs療法に抵抗性を示すようになる。
また、290例のC型肝炎患者にダクラタスビルとアスナプレビルのDAAs療法を行った治療成績から、治療不成功例では、治療前のウイルスの薬剤耐性変異の存在と共に、血中のセレノプロテインPの値が高いことが明らかになり、2型糖尿病を併発したC型慢性肝炎患者では、DAAs療法が効きにくくなる可能性が示唆されました。
以上のことから、肝臓における抗ウイルス免疫制御機構の一つとして、セレノプロテインPのmRNAによるRIG-Iを介した自然免疫の制御機構を明らかにしました。
今後の展開
C型慢性肝炎と2型糖尿病は、世界的に罹患率が高いため早急に克服すべき疾患です。本来、RIG-Iは外から侵入してくる病原体のRNAのみを認識して、病原体に対する感染防御の役割を果たすタンパクであり、自分自身のRNAには作用しないことが知られていました。これまで、セレノプロテインPのmRNAのように、RIG-Iに対する「おとり」RNAとして機能し、RIG-Iの機能を抑制してしまう自己由来のmRNAの報告はほとんどありませんでした。本研究によって得られた知見は、肝臓における免疫寛容や自己免疫疾患の理解に重要な情報を提供すると考えられます。また、RIG-Iを制御する自己RNAの研究に拍車がかかり、そのmRNAを治療標的とした核酸医薬への応用にも期待できると考えられます。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)肝炎等克服緊急対策研究事業「IFNλ4 の機能的役割の解明及び新規診断法・治療法の開発」(研究代表者:本多政夫)、「C型肝炎における慢性肝炎から発がんに至る病態の解明と制御に関する研究」(研究代表者:金子周一)および文部科学省科学研究費補助金「新学術領域研究(領域提案型)」の支援を受けて実施されました。
掲載論文
- 雑誌名:
- Cell Host & Microbe
- 論文名:
- Induction of selenoprotein P mRNA during hepatitis C virus infection inhibits RIG-I-mediated antiviral immunity
(C型肝炎ウイルス感染時に発現誘導されるセレノプロテインPのmRNAは、RIG-I介在性の抗ウイルス免疫応答を阻害する) - 著者名:
- Kazuhisa Murai, Masao Honda, Takayoshi Shirasaki, Tetsuro Shimakami, Hitoshi Omura, Hirofumi Misu, Yuki Kita, Yumie Takeshita, Kiyo-aki Ishii, Toshinari Takamura, Takeshi Urabe, Ryogo Shimizu, Hikari Okada, Taro Yamashita, Yoshio Sakai, and Shuichi Kaneko
- (村居和寿,本多政夫,白崎尚芳,島上哲朗,大村仁志,御簾博文,喜多裕樹,竹下有美枝,石井清朗,篁俊成,卜部健,清水良悟,岡田光,山下太郎,酒井佳夫,金子周一)
- 掲載日時:
- 2019年4月10日11時(米国東海岸標準時間)にオンライン版に掲載
- URL:
- https://doi.org/10.1016/j.chom.2019.02.015
用語解説
- ※1 C型肝炎ウイルス(HCV : Hepatitis C virus)
- フラビウイルス科ヘパシウイルス属に属するRNAウイルスで、C型肝炎の原因となる。
- ※2 セレノプロテインP
- 必須微量元素であるセレン(Se)の輸送タンパクであり、主に肝臓で産生される分泌タンパク質である。
- ※3 RIG-I(Retinoic acid-inducible gene-I)
- 自然免疫系で働くタンパク質の分子であり、ウイルスが細胞内に進入した時にウイルス由来のRNAを認識し、抗ウイルス作用を示すI型インターフェロン産生の誘導を引き起こす。
- ※4 DAAs(Direct-acting antiviral drugs)
- ウイルスタンパクを直接標的とした、高い抗ウイルス効果を持つ直接作用型抗ウイルス薬。
- ※5 ヘリカーゼドメイン
- 一本の鎖でできているRNAが入り組んだ構造をとり、部分的に結合して2本の鎖になっている構造の部分を紐解いて、本来の一本の鎖に戻す働きを持つタンパクをヘリカーゼと呼ぶ。ヘリカーゼの活性のある中心部分をヘリカーゼドメインという。
- ※6 PAMP(Pathogen-associated molecular pattern)
- 微生物特有(高等多細胞生物にはない)のパターン分子の総称。自然免疫を活性化する。その受容体がパターン認識受容体と呼ばれる。
〔RLR(RIG-Ⅰ-like receptor)、TLR(Toll-like receptor)、NLR(NOD-like receptor)など〕
本件に関するお問い合わせ先
研究内容に関すること
金沢大学医薬保健研究域保健学系 教授
本多 政夫(ほんだ まさお)
TEL:076-265-2601
E-mail:mhonda"AT"m-kanazawa.jp
広報担当
金沢大学総務部広報室広報係
嘉信 由紀(かしん ゆき)
TEL:076-264-5024
E-mail:koho"AT"adm.kanazawa-u.ac.jp
金沢大学医薬保健事務部保健学支援課企画総務係
奥村 陽子(おくむら ようこ)
TEL:076-265-2505
E-mail:t-hsomu"AT"adm.kanazawa-u.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 感染症研究課(肝炎等克服実用化研究事業 担当)
TEL:03-6870-2225
E-mail:hepatitis"AT"amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 平成31年4月11日
最終更新日 平成31年4月11日


