プレスリリース 2型糖尿病におけるインスリン抵抗性がアルツハイマー病脳のアミロイド蓄積を促進するメカニズムを解明
プレスリリース
東京大学
日本医療研究開発機構(AMED)
発表者
若林 朋子(東京大学大学院医学系研究科 認知症先進予防治療学寄付講座 特任助教)
山口 一樹(東京大学大学院医学系研究科 修士課程2年生(研究当時))
松井 健太郎(東京大学大学院医学系研究科 博士課程4年生(研究当時)
岩坪 威(東京大学大学院医学系研究科 脳神経医学専攻 神経病理学分野 教授)
発表のポイント
- 代謝負荷に伴うインスリン抵抗性が、アルツハイマー病の病因タンパク質「Aβ」の脳内の除 去速度低下による蓄積増加を引き起こすこと、その作用は食事制限で可逆的に改善されることを明らかにしました。
- インスリンシグナルの障害そのものではなく、インスリン抵抗性の要因となる代謝負荷によ る細胞ストレスが、アルツハイマー病のアミロイド病態の進行に影響する可能性を示しました。
- 2型糖尿病がアルツハイマー病発症のリスクとなることは広く知られてきましたが、 その背後にあるメカニズムの一端を解明し、予防・治療法創出に向けた新たな標的を明らかにしました。
発表概要
アルツハイマー病(AD)は老年期の認知症として最も頻度の高い疾患です。AD患者の脳に特徴的な病理変化として、アミロイドβペプチド(Aβ)からなる老人斑(注1)があり、Aβの蓄積はAD発症の原因であると考えられています。近年、2型糖尿病がAD発症のリスクとなることが明らかになっています。特に、2型糖尿病の中心的な病態であるインスリン抵抗性(注2)がADの発症を促す可能性が予測されてきました。しかし、インスリンシグナルの変化とAβの蓄積との因果関係は未解明でした。
東京大学大学院医学系研究科の岩坪威教授らの研究グループは、脳にAβの蓄積を生じるADモデルマウスを用い、高脂肪食により誘発されたインスリン抵抗性と、インスリンシグナルの鍵分子であるIRS-2(注3)の欠損に伴うインスリン抵抗性による影響を比較、解析しました。その結果、インスリンの作用低下そのものではなく、インスリン抵抗性発症の要因となる代謝ストレスが、Aβの脳内の除去速度を低下させ、結果として蓄積を促進することを示しました。また、食事制限により、脳のAβ蓄積は可逆的に抑制できることを明らかにしました。
2型糖尿病がAD発症のリスクとなることは広く知られてきましたが、本研究はその背後にあるメカニズムの一端を解明し、未だ確立していないADの治療法創出に向け、新たな標的を明らかにしました。
本研究は日本医療研究開発機構(AMED)の脳科学研究戦略推進プログラム「新機軸アミロイド仮説に基づくアルツハイマー病の包括的治療開発」の支援を受け、東京大学医学部附属病院・門脇孝特任教授、窪田直人准教授らとの共同研究により行われ、4月12日にMolecular Neurodegeneration誌に発表されます。
発表内容
①研究の背景・先行研究における問題点
アルツハイマー病(AD)は老年期の認知症として最も頻度の高い疾患であり、大脳の神経細胞が進行性に脱落する結果、症状を発症します。AD患者の脳では、認知機能が低下する10年以上前から、アミロイドβペプチド(Aβ)が凝集し、老人斑の蓄積が始まります。Aβレベルの上昇、蓄積の過程が、AD発症の発端となると考えられています。
ADは複数の遺伝的、環境的要因を背景として発症しますが、近年の疫学的研究の結果から、2型糖尿病がAD発症のリスクを約2倍に高めることが明らかになりました。インスリン抵抗性は、骨格筋や肝臓を始めとする臓器のインスリンに対する作用不全が生じた状態であり、2型糖尿病の中心的な病態です。これまでに、インスリン抵抗性は脳の老人斑形成の程度と相関すことが報告されました。更に、AD患者の脳ではインスリンシグナルの低下が生じているとする報告もあります。これらの研究結果から、2型糖尿病とADをつなぐメカニズムとして、インスリンシグナルの障害が注目されてきました。一方でモデル動物を用いた研究では、インスリンシグナルを遺伝的に阻害すると、逆説的に脳のアミロイド蓄積が抑制されることが示されており、インスリンシグナルの変化とADのAβ病態形成との因果関係には未解明な点が多く残されていました。
②研究内容
東京大学大学院医学系研究科の岩坪威教授らの研究グループは、加齢とともに脳にAβがアミロイド斑として蓄積するADモデルマウスにおいて、高脂肪食の持続的な負荷、あるいはインスリンシグナル伝達に重要なIRS-2を欠損することによる遺伝的なインスリン抵抗性の誘発、更に両者を組み合わせ、Aβ蓄積への影響を解析しました。その結果、高脂肪食の負荷は末梢臓器の炎症性シグナルやストレスシグナルを増加させ、末梢や脳のインスリン抵抗性を引き起こすと同時に、脳ではAβの蓄積が増加しました(図1)。一方、IRS-2を欠損すると、糖尿病を発症するものの、Aβの蓄積は抑制されました。しかし、IRS-2欠損マウスに対して持続的に高脂肪食を負荷すると、糖尿病病態の悪化とともに、Aβの蓄積は再び増加しました(図2)。すなわち、食餌誘導性のインスリン抵抗性によってのみ、ADの病態は促進されることが分かりました。これらの結果は、インスリンシグナルの低下そのものではなく、インスリン抵抗性発症の要因となる代謝ストレスが、ADの病態促進に重要である可能性を示しています。また高脂肪食負により脳のAβが増加しても、その後の食事制限を行うことで、インスリン抵抗性が改善し、その改善の程度に応じて脳のAβ蓄積も可逆的に減少することを示しました(図1)。
さらに本研究では、これまで詳細が明らかになっていなかった、インスリンやAβの脳内での動態を解明するため、脳の細胞間隙に存在するタンパク質を回収可能な微小透析法を用いた解析を行いました。これにより、高脂肪食の摂取による糖尿病状態では、血液中から脳へのインスリンの移行が低下することによって、脳でもインスリン抵抗性が生じる可能性を示しました。また同時に、糖尿病状態のモデルマウスの脳内では、Aβの除去速度が低下することで、アミロイド蓄積が増加する可能性を初めて明らかにしました。
③社会的意義
ADの発症メカニズムに基づく根本的な治療法は未だ確立されていません。近年、インスリン抵抗性がADの発症に関与するという知見に基づいて、糖尿病治療薬や、インスリン経鼻投与などの、インスリンシグナルの賦活化を標的としたADの予防・治療法が模索され始めています。本研究で我々は、ADのアミロイド病態とインスリン抵抗性との因果関係を、2種類のモデルを用いて解析することによって、代謝ストレスがAD病態形成に重要な影響を与えることを示しました。すなわち、末梢や脳における小胞体ストレスや慢性炎症を標的とすることによって、AD発症の原因であるAβ病態の形成を抑制できる可能性が示唆されました。今後は、より具体的な代謝ストレスの経路の特定と、介入法を解明することにより、新たなADの予防・治療戦略の創出に繋がると期待されます。
発表雑誌
- 雑誌名:
- 「Molecular Neurodegeneration」4月12日オンライン版
- 論文タイトル:
- Differential effects of diet- and genetically-induced brain insulin resistance on amyloid pathology in a mouse model of Alzheimer’s disease
- 著者:
- Tomoko Wakabayashi, Kazuki Yamaguchi, Kentaro Matsui, Toshiharu Sano, Tetsuya Kubota, Tadafumi Hashimoto, Ayako Mano, Kaoru Yamada, Yuko Matsuo, Naoto Kubota, Takashi Kadowaki, Takeshi Iwatsubo*
- DOI番号:
- 10.1186/s13024-019-0315-7
用語解説
- (注1)老人斑
- アルツハイマー病(AD)の脳に特徴的に認められるAβタンパク質が沈着してできる構造物。神経細胞から分泌されるAβは、正常な脳では分解・代謝され、低いレベルに保たれているが、ADの脳ではAβが凝集してアミロイド線維構造を形成し、老人斑(アミロイド斑)となって蓄積する。
- (注2)インスリン抵抗性
- インスリンは膵臓のβ細胞から分泌される、血糖降下作用を持つホルモンである。インスリン抵抗性は、インスリン感受性の臓器において、その作用が低下している状態を示す。高脂肪食の摂取や肥満、運動不足などの要因により、脂肪組織や肝臓、筋肉などの代謝に関与する臓器に慢性的な炎症やストレスが生じ、インスリンの細胞内へのシグナル伝達が阻害されることにより、抵抗性を発症すると考えられているが、脳におけるインスリン抵抗性については十分に分かっていなかった。
- (注3)IRS-2
- インスリン受容体基質2(insulin receptor substrate-2: IRS-2)は、活性化した細胞膜表面のインスリン受容体によりリン酸化を受け、細胞内にインスリンのシグナルを伝達する分子である。IRS-2を遺伝的に欠損したマウスは、インスリン抵抗性と膵臓のβ細胞の障害から、糖尿病を発症することが報告されている。
添付資料
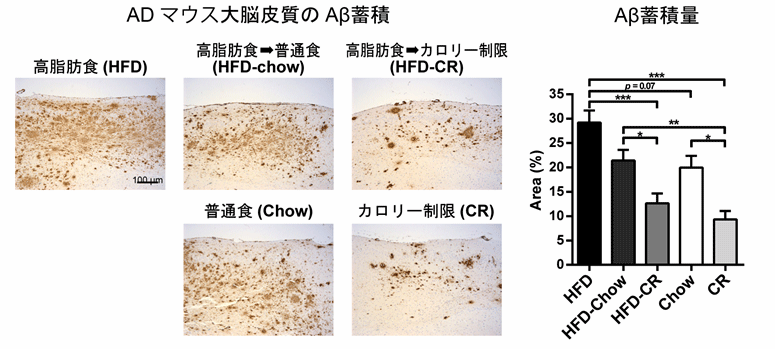
図1:Aβの蓄積は高脂肪食負荷によるインスリン抵抗性の発症に伴って増加しその後の食餌制限により可逆的に抑制される
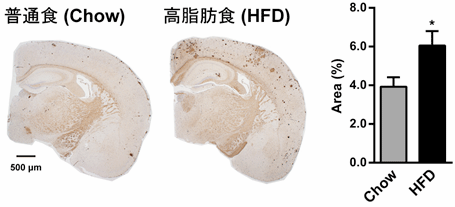
図2:IRS-2 欠損 AD マウスへの高脂肪食負荷によりAβの蓄積が促進される
お問い合わせ先
研究内容に関すること
東京大学大学院医学系研究科 脳神経医学専攻 神経病理学分野
教授 岩坪 威(いわつぼ たけし)
TEL:03-5841-3541
Email:iwatsubo"AT"m.u-tokyo.ac.jp
広報に関すること
東京大学医学部総務係
〒113-0033 東京都文京区本郷7-3-1
TEL:03-5841-3304
Email:ishomu"AT"m.u-tokyo.ac.jp
AMED事業に関すること
日本医療研究開発機構 戦略推進部 脳と心の研究課
〒100-0004 東京都千代田区大手町1-7-1 読売新聞ビル
TEL:03-6870-2222 FAX:03-6870-2244
E-mail:brain-d"AT"amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成31年4月12日
最終更新日 平成31年4月12日


