プレスリリース 多くの疾患に関与する「Wntタンパク質」の立体構造をついに解明!!
プレスリリース
大阪大学
日本医療研究開発機構
本研究成果のポイント
- 多細胞生物の発生と組織形成に必須のタンパク質Wnt(ウィント)※1の立体構造を、ほ乳類由来のものについて初めて解明
- 得られた構造により、受容体の二量体化がWntシグナル伝達の鍵となることが示唆された
- 様々な疾患の原理究明や、再生医療研究および医薬品開発を加速することに期待
概要
大阪大学蛋白質研究所の高木淳一教授のグループは、ヒトを含むあらゆる多細胞生物の発生と組織形成に必須であるタンパク質、Wnt(ウィント)を受容体との複合体の状態で結晶化し、その立体構造を解明しました。
Wntは細胞に作用してその細胞の運命を制御する分泌タンパク質であり、がんや骨粗鬆症を含む、様々な疾患に関わっていますが、その「水に溶けない」性質のために大量の組み換え発現や精製が難しく、これまでヒトや哺乳動物由来のWntについては立体構造情報が得られていませんでした。
高木淳一教授と平井秀憲元特任研究員、有森貴夫助教らは、ヒト由来Wnt3タンパク質を水に溶かすために様々な工夫を施し、細胞上の受容体であるFrizzled8(Fz8)の断片を大量に同時発現することで安定なWnt3-Fz8が得られることを発見しました。さらに、今まで知られていなかったWnt3中の疎水性領域を意図的に欠失させることで水溶性で安定なWnt3-Fz8複合体を得てこれを結晶化し、大規模放射光施設SPring-8の蛋白質研究所ビームライン(BL44XU)における回折実験を経て、その原子分解能(2.9Å)での構造決定に成功しました(図1)。
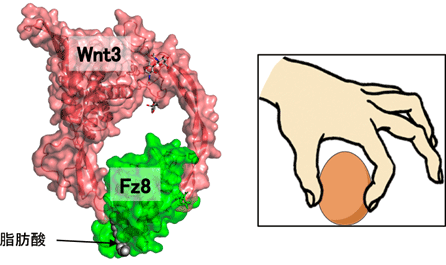
図1 Wnt3Fz8 CRDの複合体の結晶構造
明らかになったWnt3-Fz8複合体の構造から、Wntタンパク質が分子内に備えている様々な「しかけ」が明らかになり、これによってWntが幹細胞に増殖シグナルを伝えるメカニズムの解明が進んだことは、再生医療研究を加速するものとして注目されます。
本成果は英科学誌「Nature Structural & Molecular Biology」に2019年4月29日付け(英国標準時間16時00分、日本時間30日1時00分)で掲載されました。
研究の背景
今世界中で注目を集めている「再生医療」において、肝臓なら肝臓、小腸なら小腸の細胞を無限に創り出せれば、たとえば人工臓器を創らせたり、あるいはこれらの細胞を使って薬の毒性を試験したりすることが出来ると期待されています。これら特有の組織細胞の「もと」になる細胞を幹細胞と呼びますが、幹細胞はそれぞれの組織中にごく微量しか存在しないため、取り出してきて増やすことは非常に困難です。それを解決するために開発されたのがiPS細胞ですが、iPS細胞から誘導して作られる幹細胞もやはり培養系でたくさん増やすことは難しく、再生医療のネックとなっています。
これらの組織幹細胞は再生医療だけでなく、がん研究にも極めて重要な役割を果たします。がん研究は、患者由来のがん細胞を実験室で培養してその性質を解析することにより進展してきましたが、近年、患者由来の腫瘍組織を、より生体内に近い三次元的な培養(オルガノイド培養と呼びます)をすることにより、実際のがんの性質をより忠実に再現し、がんのメカニズム解明や治療法に役立てることが重要視され始めています。
この「幹細胞(がんオルガノイドを含む)を培養系で維持し、増殖させる」ために必須な因子が、Wnt3を代表とするWntタンパク質群です。Wntが幹細胞を活性化する経路は「Wntシグナル経路」と呼ばれますが、この経路が正常に働かなくなると、たとえば骨が出来なくなって骨粗鬆症になったり、増殖が暴走してがんになったりします。すなわち、このWntシグナル経路の分子メカニズムを明らかにすることは、生物学や医学分野で大変重要になってきています。
とくに望まれるのが、Wntタンパク質が細胞上の受容体に結合してシグナル伝達を開始するところの分子の姿(構造)をX線結晶構造解析などの手法で明らかにすることであり、これがわかるとWntシグナル経路を人工的に制御するためのツール(医薬)の開発が加速されます。ところがWntタンパク質は特殊な脂肪酸で修飾されているため遺伝子組み換えによる生産が非常に難しく、これまでカエル由来の特殊なWntについての結晶構造解析が2012年に報告されたのみで、ヒトの幹細胞研究に重要なほ乳類Wntの構造情報は皆無でした。
研究の成果
高木グループの平井秀憲元特任研究員は、ヒトWnt3の組み換え発現と細胞からの分泌を抑制している要因を一つ一つ特定し、それらを回避する変異を導入することによって実験方法を改良し、ついにミリグラム単位の高品質Wnt3タンパク質を得ることに成功しました。また、受容体であるFz8のCys-rich domain(CRD)という部分断片との複合体の状態で結晶化に成功し、有森貴夫助教の協力により、これを用いた放射光施設SPring-8の蛋白質研究所ビームライン(BL44XU)での高輝度X線回折実験によって、原子分解能(2.9Å)での構造決定に成功しました。得られた結晶構造から、Wnt3がその脂肪酸修飾部分を巧みに使い、あたかも親指と人差し指で受容体(Fz8 CRD)を“つまむ”ように結合している様子が明らかになりました(図1)。さらに重要なことに、このWnt3-Fz8の1:1のペアが、結晶中で二つ向き合って対照的な2:2複合体を形成していることも判明しました。この2:2複合体の「界面」では、Wntの生物活性に重要な脂肪酸鎖部分が、互いにその先端を相手方に差し込む形で交換しており(図2)、タンパク質間相互作用において脂質が直接関与している珍しい例であることもわかりました。この事実は、幹細胞においてWntシグナルが伝達される際に、Wntが細胞膜上のFz受容体に結合して対称性の二量体の形成を誘導することを示唆しています。
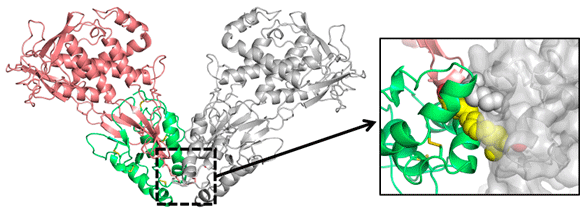
図2 Wnt3:Fz8の2:2複合体構造
今回の構造決定によるもう一つの発見は、「補助受容体結合部位の同定」です。Wntのシグナル伝達には実はFzだけでは十分でなく、もう一つの受容体(補助受容体とも呼ばれる)であるLRP6という分子が必要であることが知られていました。つまり、Wnt、Fz、LRP6という3者が細胞膜上で複合体を形成すると予想されていましたが、その実態は不明でした。今回解明した構造から、Fzに結合したWnt3の上部に特徴的なβヘアピン領域があり、その先端に存在するアルギニン残基が横から近づいてくるLRP6の結合に最適の位置にあることが示唆され、実際にこの領域でWnt3-Fz8複合体がLRP6に結合する(つまり3者複合体になる)ことを直接的に示すことができました(図3中央)。
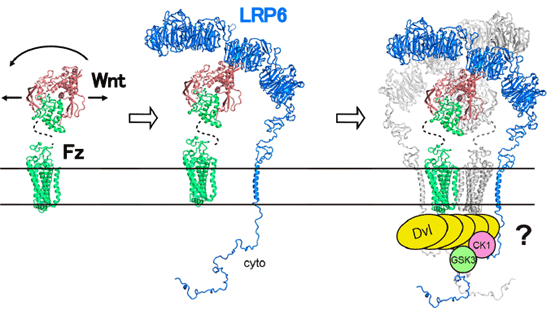
図3 Wnt:Fz:LRP 3者複合体とシグナリング機構
FzはいわゆるGタンパク質※2共役型受容体(GPCR)に分類されますが、典型的なGPCRと違ってGタンパク質に共役していないことが報告されており、これまで下流へのシグナル伝達機構が謎でした。今回の結果により、WntによるFzの二量体化がシグナルの引き金であり、さらにそこに側方からLRP6が近づいてきて3者複合体を単位とした高次のクラスターが形成する可能性(図3右)を示せたことは、霧に包まれていたWntシグナル経路のメカニズム解明において大きな前進であり、非常に遅れていたWntシグナル機構の総合的理解とそれを用いた各種疾患の治療法開発を一気に加速する可能性があります。
本研究成果が社会に与える影響(本研究成果の意義)
Wntシグナル経路を理解し、それを人工的に制御するツールを開発することは、発生生物学分野のみならず、幹細胞生物学、再生医療、がん研究、がん創薬研究など様々な分野で長年の課題でした。今回構造情報が得られたヒトWnt3は、乳がん、大腸がん、肺がん、胃がんなど様々ながん細胞の異常増殖に関与し、また骨の形成や免疫細胞の機能にも根源的に関わることが知られており、その詳細な立体構造情報が得られたことは、これら疾患の原因究明と治療法開発、とくに構造に基づいたWntシグナル阻害剤や活性化剤のデザインに扉を開く可能性を秘めています。
用語説明
- ※1 Wntタンパク質
- もともとショウジョウバエでWingless(羽根無し)と呼ばれる、文字通り羽根が生えない変異体の原因遺伝子として見つかった。ヒトなどの高等動物ではこのタンパク質が細胞に与える信号(Wntシグナルと呼ばれる)が、様々な細胞の運命決定に関わり、その異常は骨の形成不全やがんなどの原因となる。
- ※2 Gタンパク質
- Gタンパク質は、グアニンヌクレオチド結合タンパク質の略称であり、GTPまたはGDPを結合して活性のON/OFFを行うことにより、細胞内情報伝達に関与する。Gタンパク質のなかでも、「三量体Gタンパク質」と呼ばれる一群はGタンパク質共役受容体(GPCR)と共役してセカンドメッセンジャーカスケードに関連する。市販の薬の半数以上がGPCRを標的にしている。
論文情報
本研究成果は、英科学誌「Nature Structural & Molecular Biology」に2019年4月29日付け(英国標準時間16時00分、日本時間30日1時00分)で掲載されました。
- 論文タイトル
- Crystal structure of mammalian Wnt–frizzled complex
- 著者
- Hidenori Hirai, Kyoko Matoba, Emiko Mihara, Takao Arimori, and Junichi Takagi
特記事項
本成果は、以下の事業・研究課題によって得られました。
- 日本学術振興会(JSPS)科学研究費補助金 基盤研究(A)
- 研究課題名:「Wntリガンド-受容体相互作用の構造メカニズム」(17H01420)
- 研究代表者:高木淳一(大阪大学 蛋白質研究所 教授)
- 研究期間:2017年4月~2020年3月
- 日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業
- 研究課題名:「Structure-based protein designを駆使した抗体代替物の創成と高難度組換え蛋白質生産の支援」
- 研究代表者:高木淳一(大阪大学 蛋白質研究所 教授)
- 研究期間:2017年4月~2022年3月(予定)
お問い合わせ先
本件に関するお問い合わせ先
大阪大学蛋白質研究所
教授 高木 淳一(たかぎ じゅんいち)
電話:06-6879-8607 FAX:06-6879-8609
E-mail:takagi"AT"protein.osaka-u.ac.jp
AMED事業に関するお問い合わせ先
日本医療研究開発機構(AMED)創薬戦略部 医薬品研究課
電話:03-6870-2219
E-mail:20-DDLSG-16"AT"amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和元年5月9日
最終更新日 令和元年5月9日


