宿主がHIV-1感染を抑制する新たなメカニズムの解明―N4BP1によるRNA分解とその調節がウイルス再活性化を調節する―
プレスリリース
京都大学
日本医療研究開発機構(AMED)
概要
京都大学大学院医学研究科 竹内理 教授らの研究グループは、エイズ発症の原因となるヒト免疫不全ウイルス1型(HIV-1)(*1) の感染を抑制する新たな宿主タンパク質としてN4BP1(*2) を同定し、その分子メカニズムを明らかにしました。
HIV-1は宿主細胞に侵入後、組み込まれたウイルスゲノムDNAからウイルスmRNAを転写し、新たなウイルス粒子を産生、感染を拡大します。宿主には、HIV-1感染を抑制する免疫機構が存在しますが、これまでウイルスmRNAを標的とした防御機構は分かっていませんでした。
本研究では、HIV-1感染を抑制する新たな宿主因子としてN4BP1を同定しました。N4BP1はCD4陽性T細胞などHIV-1感染標的細胞で、ウイルスmRNAと結合し、これを分解することで、HIV-1感染を抑制しました。しかし、活性化CD4陽性T細胞ではN4BP1が宿主タンパク質分解酵素MALT1(*3) により分解され、その機能を失うことが明らかとなりました。また、HIV-1潜伏感染細胞においては、MALT1でN4BP1が分解されることが、HIV-1の再活性化に寄与することが分かりました。本研究は、今後の抗HIV-1ウイルス療法の進展や、潜伏感染細胞の根絶療法の開発へと発展することが期待されます。
本研究成果は、日本時間2019年5月28日に英国科学雑誌「Nature Microbiology」のオンライン速報版に掲載されます。
1.背景
ヒト免疫不全ウイルス1型(HIV-1)は、免疫細胞であるCD4陽性T細胞やマクロファージに感染し、細胞中で増殖します。産生された新たなHIV-1は、次のCD4陽性T細胞やマクロファージに感染、これらの細胞を破壊することで、免疫細胞の減少や機能不全を引き起こします。その結果、感染患者が感染症にかかり易くなり、後天性免疫不全症候群(AIDS、エイズ)を発症します。
HIV-1はレトロウイルス科に属するウイルスで、感染標的細胞に侵入すると、ウイルスの一本鎖RNAゲノムを鋳型に逆転写反応により二本鎖DNAを合成し、これが核へ移行、宿主の染色体へ組み込まれます。組み込まれたウイルスDNAは宿主の遺伝子転写機構によりウイルスメッセンジャーRNA (mRNA) が転写され、ウイルスタンパク質へと翻訳されます。Gagタンパク質などウイルスタンパク質が集合し、ウイルスRNAと結合、ウイルス粒子が組み立てられ、細胞外へ遊離されることで、新たなHIV-1ウイルスが誕生し、次の標的細胞へ感染します。
近年の抗ウイルス療法の発展により、ほとんどのエイズ症例でHIV-1の増殖を抑制することが可能となりましたが、体内に潜伏感染しているHIV-1を完全に排除することは出来ず、治療を中断するとすぐにウイルスが再活性化し増殖することが分かっています。現在、HIV-1潜伏感染細胞(リザーバー)をどのように排除し、エイズを根治に導く方法の開発に向けてさまざまな研究が進められています。
ヒト細胞は、HIV-1感染を抑制する様々な防御因子を有していることが知られています。例えば、ヒトAPOBEC3タンパク質は、逆転写により合成されたウイルスDNAを加え、ウイルスの増殖を阻害します。また、ヒトテザリンタンパク質は、ウイルスの細胞からの遊離を阻害します。しかし、これらの宿主防御因子は、ウイルスタンパク質により抑制され、HIV-1と宿主免疫系のせめぎあいが行われています。
これまで明らかとなっている宿主防御因子は、HIV-1感染の初期のステップや、ウイルス遊離を抑制するものがほとんどです。しかし、ウイルスmRNAが作られ、様々なウイルスタンパク質や粒子産生の中心をなすことから、本研究では、RNAに結合しHIV-1感染を抑制する新たな宿主因子の同定を目的として研究を行いました。
2.研究手法・成果
まず、RNAを介してHIV-1感染を抑制する新たな宿主因子を探索する目的で、その構造からRNAと結合することが予想される62種類のタンパク質(RNA結合タンパク質:RBP)を、HIV-1を発現するDNAと共に導入し、HIV-1産生量を比較しました。多くのRBPの強制発現は、HIV-1産生に影響を与えませんでしたが、その中でN4BP1というタンパク質を発現させることで、ウイルス増殖が20分の1以下に抑制されることを見出しました。N4BP1の発現は、様々な種類のHIV-1株を抑制することができ、また、T細胞株やヒトマクロファージにおいてN4BP1を欠損させることにより、HIV-1感染に対し有意に易感染性となることが分かりました。つまり、N4BP1は新たなHIV-1抑制宿主因子として機能しています。
N4BP1は、RNA分解酵素として機能する領域を持ち、核内に存在するタンパク質です。実際に、HIV-1 RNAに結合し、これを分解する活性を持つこと、RNA分解酵素活性を持たない変異N4BP1がHIV-1を抑制しないことを見出しました。また、N4BP1はインフルエンザウイルスなどの感染を抑制することは出来ず、宿主のI型インターフェロン産生にも変化を与えないことから、N4BP1はHIV-1 mRNAを直接認識し分解することで、ウイルス増殖を抑えていると考えられました。
これまでに明らかとなっている宿主HIV-1防御因子の多くは、HIV-1タンパク質により抑制されていることが知られています。これに対し、N4BP1はHIV-1タンパク質による抑制は認められませんでした。しかし、T細胞をT細胞受容体やphorbol 12-myristate 13-acetate (PMA) などの刺激で活性化すると、N4BP1タンパク質が切断を受け、HIV-1抑制能を失うことが分かりました。この切断は、T細胞受容体刺激で活性化するタンパク質分解酵素MALT1により行われます。MALT1は、ヒトN4BP1タンパク質を509番目のアルギニン残基の後ろで切断することが分かり、このアルギニンをアラニンに置換した変異体は、MALT1によっても切断されないことが分かりました。
HIV-1潜伏感染細胞は、T細胞受容体刺激などにより再活性化することが知られています。これまで、HIV-1再活性化には、NF-kBなど転写因子の活性化によるHIV-1 mRNAの転写制御が関わることが知られていましたが、N4BP1によるHIV-1 RNA分解も関与する可能性を考え研究を行いました。まず、JNLGFP細胞を始めとしたHIV-1潜伏感染細胞株をPMA刺激し、再活性化させた場合に、MALT1によるN4BP1分解が起こる事を見出しました。さらに、MALT1により分解されない変異N4BP1は、HIV-1潜伏感染細胞のPMA刺激による再活性化を抑制することから、MALT1によるN4BP1分解は、HIV-1潜伏感染細胞の再活性化に寄与することが明らかとなりました(図)。
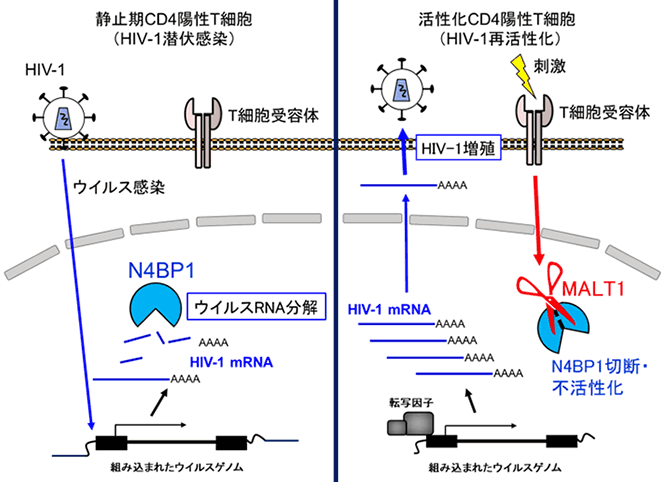
図:N4BP1によるHIV-1mRNA分解とその制御モデル
3.波及効果、今後の予定
本研究では、HIV-1 RNAを標的とした新たな宿主抑制因子としてN4BP1を同定しました。また、MALT1によるN4BP1の分解が、HIV-1潜伏感染細胞の再活性化に寄与することを明らかにしました。N4BP1の役割を検討することで、HIV-1感染やその潜伏感染、再活性化機構のさらなる病態解明に発展することが期待されます。また、MALT1やN4BP1の機能を調節することで、例えばHIV-1潜伏感染細胞を再活性化させ抗ウイルス治療に対し効果を示すように制御するショック&キル療法など、新たなエイズの治療につながることが期待されます。
本研究では、HIV-1制御に焦点を当ててN4BP1の機能を検討しました。N4BP1を切断するMALT1はT細胞活性化に重要なシグナル分子であり、この標的となるN4BP1も免疫細胞自身の制御にも関わる可能性も考えられます。今後、N4BP1の機能に関しても新たな視点から取り組んでいく予定です。
4.研究プロジェクトについて
本研究は、日本学術振興会科学研究費補助金基盤(S)18H05278(研究開発代表者:竹内 理)および国立研究開発法人日本医療研究開発機構(AMED)エイズ対策実用化研究事業「HIV感染制御の網羅的解析による潜伏機序の解明とその治癒戦略策定」18fk0410014h0001(研究開発代表者:小柳 義夫、研究開発分担者:竹内 理)の一環で行われました。
本研究は、京都大学ウイルス・再生医科学研究所、東京大学、横浜市立大学、大阪大学、Ulm大学と共同で行ったものです。
論文タイトルと著者
- タイトル:
- N4BP1 restricts HIV-1 and its inactivation by MALT1 promotes viral reactivation
- 著者:
- Daichi Yamasoba, Kei Sato, Takuya Ichinose, Tomoko Imamura, Lennart Koepke, Simone Joas, Elisabeth Reith, Dominik Hotter, Naoko Misawa, Kotaro Akaki, Takuya Uehata, Takashi Mino, Sho Miyamoto, Takeshi Noda, Akio Yamashita, Daron M. Standley, Frank Kirchhoff, Daniel Sauter, Yoshio Koyanagi, Osamu Takeuchi
- 掲載誌:
- Nature Microbiology
用語解説
- *1 HIV-1:
- レトロウイルスの一種であり、CD4陽性T細胞やマクロファージに感染し、これらの細胞を破壊して後天性免疫不全症候群(エイズ)を引き起こす。
- *2 N4BP1:
- RNAを分解する酵素活性を持ち、HIV-1 mRNAに結合し、これを分解することで、ウイルス感染を抑制している。
- *3 MALT1:
- T細胞受容体シグナルや、PMA刺激に対し活性化、N4BP1を切断するタンパク質分解酵素として機能する。T細胞シグナル伝達において、NF-kBなど転写因子の活性化にも重要である。
お問い合わせ先
研究に関すること
竹内 理(タケウチ オサム)
京都大学大学院医学研究科 医化学分野 教授
Tel:075-753-9500 Fax:075-753-9502
E-mail:otake"AT"mfour.med.kyoto-u.ac.jp
報道に関すること
京都大学総務部広報課 国際広報室
TEL:075-753-5729 FAX:075-753-2094
E-mail:shimizu.tomoki.7z"AT"kyoto-u.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 感染症研究課(エイズ対策実用化研究事業)
TEL:03-6870-2225
E-mail:aids"AT"amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和元年5月28日
最終更新日 令和元年5月28日


