皮膚バリアと感覚神経の関係を可視化―アトピー性皮膚炎などの痒みのメカニズムに新知見―
プレスリリース
理化学研究所
日本医療研究開発機構
理化学研究所(理研)生命医科学研究センター組織動態研究チームの岡田峰陽チームリーダー、髙橋苑子リサーチアソシエイトと皮膚恒常性研究チームの天谷雅行チームリーダー、久保亮治客員研究員らの共同研究グループ※は、皮膚の感覚神経が「皮膚バリア[1]」によって恒常的に保護される仕組みを解明しました。
本研究成果は、皮膚バリアの減弱により引き起こされる痒みのメカニズムの解明に寄与し、アトピー性皮膚炎などの痒みを抑制する新たな治療法の開発に貢献すると期待できます。
アトピー性皮膚炎などで、皮膚バリアの減弱が感覚神経を活性化し、痒みの誘導に至るメカニズムはよく分かっていませんでした。
今回、共同研究グループは、ヒトの正常皮膚の表皮内において、神経線維がタイトジャンクション(TJ)[2]と呼ばれる皮膚バリア構造の内側に、常に保持されていることを明らかにしました。その仕組みを直接観察するために、マウス表皮神経の生体イメージング解析を行った結果、表皮神経終末はダイナミックに伸縮しながら、時折、新しく形成されたTJのところで、“剪定”されることを初めて見いだしました。一方、アトピー性皮膚炎のマウスモデルではその剪定がうまく起こっておらず、神経がTJに貫入して外側へ突出しており、剪定異常の部分を起点として、感覚神経の異常な活性化が起こることが分かりました。さらに、TRPA1と呼ばれるイオンチャネル[3]を阻害することにより、この感覚神経の異常な活性化と、痒みの両方が抑制されることを見いだしました。
本研究は、英国の科学雑誌『Scientific Reports』(6月13日付け)に掲載されました。
- ※共同研究グループ
- 理化学研究所
- 生命医科学研究センター 組織動態研究チーム
- チームリーダー 岡田 峰陽(おかだ たかはる)
(横浜市立大学 大学院生命医科学研究科 大学院客員教授) - リサーチアソシエイト 髙橋 苑子(たかはし そのこ)
(研究当時:横浜市立大学大学院 生命医科学研究科 博士後期課程、生命医科学研究センター 組織動態研究チーム 研修生) - 研修生(研究当時) 石田 梓(いしだ あずさ)
- 基礎科学特別研究員 落合 惣太郎(おちあい そうたろう)
- チームリーダー 岡田 峰陽(おかだ たかはる)
- 生命医科学研究センター 皮膚恒常性研究チーム
- チームリーダー 天谷 雅行(あまがい まさゆき)
(慶應義塾大学 医学部 皮膚科学教室 教授) - 客員研究員 久保 亮治(くぼ あきはる)
(慶應義塾大学 医学部 皮膚科学教室 准教授)
- チームリーダー 天谷 雅行(あまがい まさゆき)
- 生命医科学研究センター 免疫器官形成研究チーム
- チームリーダー 古関 明彦(こせき はるひこ)
(科技ハブ産連本部 医科学イノベーションハブ推進プログラム 疾患機序研究グループ グループディレクター)
- チームリーダー 古関 明彦(こせき はるひこ)
- 科技ハブ産連本部 医科学イノベーションハブ推進プログラム
疾患機序研究グループ- 上級研究員 川崎 洋(かわさき ひろし)
(生命医科学研究センター 皮膚恒常性研究チーム 上級研究員、慶應義塾大学 医学部 皮膚科学教室 非常勤講師)
- 上級研究員 川崎 洋(かわさき ひろし)
- かずさDNA研究所 先端研究開発部
-
- ユニット長 中山 学(なかやま まなぶ)
※研究支援
本研究は、日本医療研究開発機構(AMED)免疫アレルギー疾患実用化研究事業「アトピー性皮膚炎の慢性掻痒を引き起こす末梢神経変化の解明」、科学技術振興機構(JST)イノベーションハブ構築支援事業「高精度の予測に基づく予防医療の実現に向けた疾患ビッグデータ主導型イノベーションハブ」による支援を受けて行われました。
背景
皮膚バリアは水分などの体内物質を保持し、外来物の侵入を阻止するという、体の恒常性になくてはならない役割を果たしています。皮膚構造は外側の表皮と内側の真皮、および皮下組織に分けられますが、皮膚バリア機能を持つ構造は二つあり、どちらも表皮に存在します。一つは、一番外側にある死んだ角化細胞[4]からなる角質層であり、もう一つは、そのすぐ内側で死ぬ少し前の角化細胞が形成する「タイトジャンクション(TJ)」です。
表皮は常に再生を繰り返しています。表皮の一番内側の基底層にある角化細胞の幹細胞が分裂し、徐々に外側に向かって移動しながら皮膚バリア形成の準備をします(図1)。有棘層を過ぎて顆粒層に達すると、角化細胞は平べったい多面体状の形になり、横隣の角化細胞間でジッパーのようにTJバリア構造を形成します(図1)。顆粒層の細胞は同時に、天然保湿成分などが詰まった細胞内顆粒の放出と細胞死の準備、つまり角質形成の準備を行います。
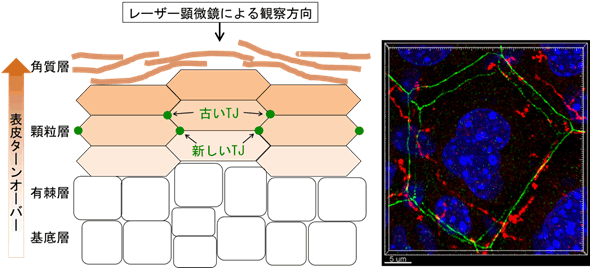
図1 表皮断面の模式図とマウス表皮顆粒層のレーザー顕微鏡画像
皮膚バリア機能は、さまざまな原因で減弱しますが、遺伝的要因や環境の影響による天然保湿成分の減少も、代表的な原因の一つです。皮膚バリアの減弱が続くと、異常な痒みが誘導されます。乾燥皮膚では、皮膚バリアが減弱して痒みを引き起こします。それに引っ掻きも加わることで、さらに皮膚バリアが減弱すると、さまざまな外来物の侵入が継続的に起こり、それがアトピー性皮膚炎の原因になると考えられています。このような発症メカニズムにおいて、これまで角質層のバリア機能の減弱が寄与することが、多くの研究から分かっていました。一方、もう一つのバリア構造であるTJについても、その減弱がアトピー性皮膚炎発症に寄与すると提唱されていました。しかし、TJバリア減弱から発症に至るメカニズムは、十分に分かっていませんでした。
痒みとして認識される刺激を、皮膚から中枢神経系へ伝えるのは感覚神経です。近年、進行したアトピー性皮膚炎において、炎症細胞が産生するインターロイキン-4(IL-4)やIL-31といったサイトカイン[5]が、感覚神経を直接活性化することで痒みを引き起こすことが明らかになってきており、治療標的として実用化されています。しかし、発症前後の時期の皮膚バリアの減弱自体が、どのように痒みを引き起こすのかは不明でした。
神経を保護する皮膚バリアの減弱によって、外からの刺激が入りやすくなり、皮膚感覚が過敏になるのだろうという仮説は立てられていましたが、実際に何が起こっているのかは明らかになっていませんでした。そのような仮説があるにもかかわらず、皮膚バリア構造と表皮内の感覚神経の位置関係についてさえ、詳細な報告はほとんどありませんでした。
そこで、共同研究グループは、表皮のTJバリア構造と神経の3次元イメージング解析を試みました。
研究手法と成果
共同研究グループは、ヒトの皮膚検体を、切片を切らずにそのまま蛍光ラベルした抗体で染色し、表皮TJと神経の位置関係をレーザー蛍光顕微鏡[6]により3次元的に解析しました。ヒト正常皮膚検体では、神経線維は表皮TJのすぐ内側まで伸びていることが明らかになりました。TJに内側から接触しているように見える神経線維が数多くありましたが、TJに貫入して外側に突き出ている神経線維はほとんど見つかりませんでした。
一方、アトピー性皮膚炎の病変部検体では、生化学的解析や切片染色による以前の報告どおり注2)、表皮TJが全く観察できないほど減弱していました。さらに、臨床上は非病変部とされる、症状が軽く肉眼では病変を確認し難い部位の検体でも、TJ構造が非常に減弱している部分があることも、以前の報告どおり確認できました。これらのことから、表皮TJは感覚神経を保護するバリアとして、重要な役割を持っていると考えられます。
しかし、ヒトの検体の解析では、アトピー性皮膚炎の病態が進行してしまう前の発症時期に、何が起こっているかを調べることは非常に困難です。そこで、以前の研究により理研で作製したアトピー性皮膚炎のモデルマウス(Spadeマウス)注3)を使って、発症時期の表皮でバリアと神経を観察しました。SpadeマウスはJak1[7]の点突然変異[8]マウスで、生後間もなく角質層バリアの異常から乾燥皮膚となり、その後7週齢以降に激しい掻痒(そうよう)を伴う皮膚炎を自然発症します。
このマウスの皮膚を、染色してイメージング解析した結果、発症直前の時期になると、角質層に加えて顆粒層TJのバリアにも異常が起こることを観察しました。症状が進行した表皮とは異なり、TJの構成タンパク質の集積は確認できましたが、通常直線的なTJが曲線的になりゆがんでいる場所が見られました。このような場所では、ところどころ神経がTJに貫入しているようでした。こうした症状は、野生型マウスや6週齢より若いSpadeマウスではほとんど見られず、ヒトの正常皮膚と同様に、神経はTJの内側に維持されていました。
次に、感覚神経特異的に蛍光タンパク質を発現する遺伝子改変マウスを用い、生体内の表皮神経をライブ観察することを試みました。表皮の神経線維は非常に細く、これまで生体内ライブ観察が満足にできる報告がほとんどありませんでしたが、今回検出感度の高いレーザー蛍光顕微鏡を用いることによって成功しました。その結果、表皮神経終末は活発に伸び縮みを繰り返し、時折、その一部が突然断片化・消失する様子を観察しました。
さらに、TJ構成タンパク質を蛍光標識する遺伝子改変を組み合わせることにより、TJバリアが新しいものへと入れ替わっていく様子と、表皮神経の動態を同時観察しました。その結果、古いTJバリアのすぐ内側に神経があり、そこに新しいTJバリアが形成されると、その交点で神経線維が切れて、そこから末端部分の線維が断片化・消失していることを見いだしました(図2)。つまり表皮内では、神経は新しいTJ形成のところで“剪定”されており、その結果としてTJバリアから神経が突出せずに内側に維持されることが示されました。ところが、発症時期のSpadeマウスでは、神経のあるところに新しいTJが形成されても速やかに剪定されず、数時間以上もTJに貫入している神経線維も観察しました(図2)。
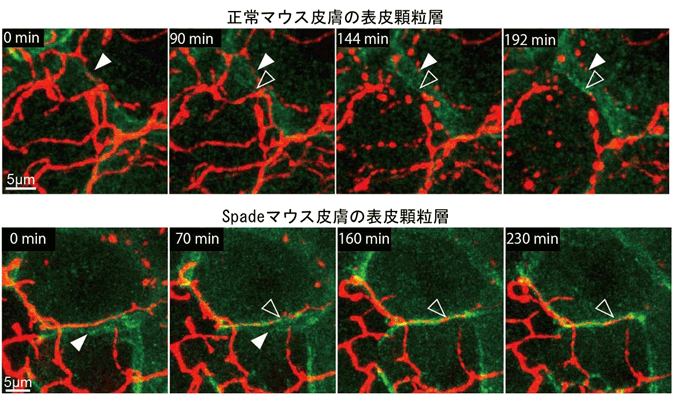
図2 表皮顆粒層のTJ(緑)形成時の神経(赤)の剪定とそのSpadeマウスにおける異常
このような状況下での神経活動を調べるために、感覚神経特異的にカルシウムイオン(Ca2+)感受性蛍光タンパク質[9]を発現する遺伝子改変マウスを用いて、神経が活性化するときに上昇する細胞内Ca2+濃度変化を、イメージング解析しました。すると、正常な表皮においては、神経が新しいTJ形成のところで剪定されると同時に、消失していく部分の神経断片だけでCa2+濃度が上がって、それ以外ではほとんど上昇しませんでした。このCa2+濃度上昇は、神経が活性化するためではなく、剪定された部分で細胞膜構造が乱された結果として起こっている可能性が高いと考えられます。
しかし、発症時期のSpadeマウスの表皮では、剪定される前から、剪定される部分のCa2+濃度が上昇することや、剪定される部分だけでなく、剪定される部分とつながっていた神経線維で広範囲に上昇することを観察しました。つまり、剪定に異常をきたすのに伴い、神経の異常な活性化が起こっていることが示されました。
さらに、この異常なCa2+濃度上昇を担う分子と、その痒みへの寄与を調べるために、表皮の感覚神経に強く発現するイオンチャネルの遺伝子を探索し、痒みへの関与も示唆されているTRPA1というイオンチャネルに着目しました。そして、TRPA1阻害剤を皮膚に塗布すると、既に痒みが出始めているSpadeマウスの表皮神経の、異常なCa2+濃度上昇が抑制され、さらに痒み自体も抑えられることが分かりました。さらに、SpadeマウスにおいてTRPA1の遺伝子を欠損させると、掻痒皮膚炎が著しく減弱しました。
以上の結果より、TJバリアの減弱により感覚神経終末の剪定に異常をきたし、神経のTJバリアへの貫入や外側への突出が起こり、そこを起点に神経の異常な活性化が起こり、これが痒みの誘導に寄与しているという可能性が示されました(図3)。
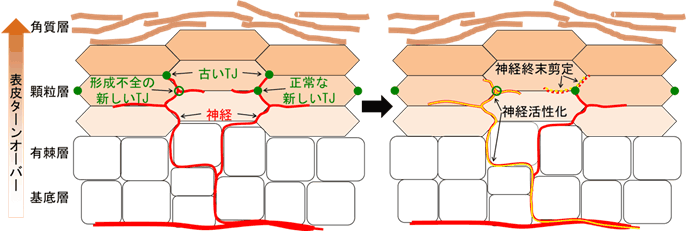
図3 TJバリアでの感覚神経終末の剪定とその異常に伴う神経活性化
- 注1)
- 2016年4月26日プレスリリース「皮膚が新陳代謝しつつバリアを維持する仕組みを解明」(慶應義塾大学)
- Mariko Yokouchi, Toru Atsugi, Mark van Logtestijn, Reiko J Tanaka, Mayumi Kajimura, Makoto Suematsu, Mikio Furuse, Masayuki Amagai, Akiharu Kubo., Epidermal cell turnover across tight junctions based on Kelvin's tetrakaidecahedron cell shape. Elife 2016, 5. e19593.
- 注2)
- Takuo Yuki, Megumi Tobiishi, Ayumi Kusaka-Kikushima, Yukiko Ota, Yoshiki Tokura., Impaired Tight Junctions in Atopic Dermatitis Skin and in a Skin-Equivalent Model Treated with Interleukin-17. PLoS One 2016, 11, e0161759.
- 注3)
- 2016年4月26日プレスリリース「アトピー性皮膚炎モデルの原因遺伝子を解明」(理化学研究所)
今後の期待
本研究から、表皮角化細胞と神経の相互作用による神経剪定が、皮膚感覚の恒常性維持に関わるという、新しい学説が提唱されます。今後、この相互作用に関わる分子が明らかになれば、痒みなどの感覚を人為的に制御するための新たなターゲットとなる可能性があります。
また、本研究で、Spadeマウスのような強い痒みを引き起こす皮膚バリア減弱マウスにおいても、TRPA1阻害剤の皮膚への塗布が、痒み抑制に有効であることが示されました。今後、さまざまなTRPA1阻害剤について、ヒトに対する有効性や安全性の研究が進めば、皮膚バリア機能異常による痒みを抑制する、新たな薬剤が生み出される可能性があります。
論文情報
- タイトル
- Homeostatic pruning and activity of epidermal nerves are dysregulated in barrier-impaired skin during chronic itch development
- 著者名
- Sonoko Takahashi, Azusa Ishida, Akiharu Kubo, Hiroshi Kawasaki, Sotaro Ochiai, Manabu Nakayama, Haruhiko Koseki, Masayuki Amagai, & Takaharu Okada
- 雑誌
- Scientific Reports
- DOI
- 10.1038/s41598-019-44866-0
補足説明
- [1]皮膚バリア
- 皮膚の表面側の重層上皮組織である表皮において、角化細胞が形成する体の最も外側を覆うバリアのことを指す。分化を終えて死んだ角質細胞でできた最も外側の角質層と、そのすぐ内側の最終分化段階に近づいた角化細胞が形成するタイトジャンクションが、バリア機能を果たすと考えられている。
- [2]タイトジャンクション(TJ)
- 横隣の上皮細胞間に形成される密着結合。形質膜上に、特殊な接着タンパク質と、これを細胞骨格にアンカーするタンパク質が集積してできる。上皮細胞間の隙間を埋め、ある程度以上の大きさを持つ分子の通過を阻む。
- [3]イオンチャネル
- 生体内では細胞の内外にさまざまなイオンが存在するが、その濃度は細胞の内外で差がある。細胞膜などの生体膜上にあり、細胞の内外のイオンの濃度差を調節する分子のうち、イオンを濃度勾配に従って透過させるものをイオンチャネルという。
- [4]角化細胞
- 皮膚表皮を形成する上皮細胞。3次元的な層構造を形成し、最も内側の基底層に角化幹細胞が存在する。分裂した幹細胞は、分化しながら外側の層へと徐々に位置を移し、表皮組織に必要なさまざまな物質を産生し、最終的には死んで角質を形成する。
- [5]サイトカイン
- 細胞同士の情報伝達に関わるさまざまな生理活性を持つ可溶性タンパク質の総称。
- [6]レーザー蛍光顕微鏡
- レーザーによって蛍光物質を励起し、出てきた蛍光を検出して、3次元的に空間解像度の高い画像データを取得できる。
- [7]Jak1
- さまざまな細胞の増殖や分化に重要なサイトカインのシグナル伝達因子。
- [8]点突然変異
- ゲノムDNA上の1塩基がランダムに置き換わる変異。化学物質などを使って、人工的に誘発させることもできる。
- [9]カルシウムイオン(Ca2+)感受性蛍光タンパク質
- 周りのCa2+濃度に応じて、蛍光の波長や強度などが変化するように人工的にデザインされた蛍光タンパク質。神経など、目的の細胞だけに発現させることによって、その細胞内のCa2+濃度変化を調べることができる。
発表者・機関窓口
発表者
- 理化学研究所
- 生命医科学研究センター 組織動態研究チーム
- チームリーダー 岡田 峰陽(おかだ たかはる)
- リサーチアソシエイト 髙橋 苑子(たかはし そのこ)
- 生命医科学研究センター 皮膚恒常性研究チーム
- チームリーダー 天谷 雅行(あまがい まさゆき)
(慶應義塾大学 医学部 皮膚科学教室 教授) - 客員研究員 久保 亮治(くぼ あきはる)
(慶應義塾大学 医学部 皮膚科学教室 准教授)
- チームリーダー 天谷 雅行(あまがい まさゆき)
機関窓口
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press"AT"riken.jp
AMED事業について
日本医療研究開発機構(AMED)戦略推進部
難病研究課 免疫アレルギー疾患実用化研究事業担当
TEL:03-6870-2223
E-mail:nambyo-i"AT"amed.go.jp
※上記の"AT"は@に置き換えてください。
関連リンク
掲載日 令和元年6月19日
最終更新日 令和元年6月19日


