プレスリリース 統合失調症の新しい治療薬候補の発見―天然代謝産物ベタインの可能性―
プレスリリース
理化学研究所
日本医療研究開発機構
理化学研究所(理研)脳神経科学研究センター分子精神遺伝研究チームの大西哲生副チームリーダー、シャビーシュ・バラン研究員、吉川武男チームリーダーらの共同研究グループ※は、天然代謝産物ベタイン(トリメチルグリシン)[1]が統合失調症[2]の新しい治療薬候補になり得ることを発見しました。
本研究成果は、新しい観点からの統合失調症の理解や治療法開発およびプレシジョンメディシン[3]に向けた取り組みに貢献すると期待できます。
現在、統合失調症の治療薬のほとんどは、神経伝達物質[4]の受容体に作用するものです。しかし、薬効が不十分であったり、副作用に悩まされる患者が多くいることから、従来とは作用機序の異なる治療薬の開発が喫緊の課題となっています。
今回、共同研究グループは、ベタイン合成酵素遺伝子[5]をノックアウトしたマウスを作製したところ、抑うつ傾向および統合失調症患者の死後脳で見られる遺伝子発現に類似したパターンが観察されました。また、覚醒剤であるメタンフェタミン(MAP)[6]や幻覚剤であるフェンサイクリジン(PCP)[7]を用いて作製した統合失調症の薬理モデルマウスに対して、ベタインは治療効果を発揮しました。さらに、ベタインの作用機序として抗酸化ストレス[8]作用が関係していることを見いだしました。また、ベタインの効果を予測するバイオマーカー[9]をゲノムデータベース[10]を活用して調べたところ、rs35518479というゲノム配列の個人差が有効であることが分かりました。
本研究は、英国の科学雑誌『EBioMedicine』のオンライン版(6月26日付け:日本時間6月27日)に掲載されます。
- ※共同研究グループ
- 理化学研究所 脳神経科学研究センター
- 分子精神遺伝研究チーム
- チームリーダー 吉川 武男(よしかわ たけお)
- 副チームリーダー 大西 哲生(おおにし てつお)
- 研究員 シャビーシュ・バラン(Shabeesh Balan)
- 研究員 前川 素子(まえかわ もとこ)
- 研究員 豊島 学(とよしま まなぶ)
- 研究員 島本(光山)知英(しまもと・みつやま ちえ)
- 研究員 江崎 加代子(えさき かよこ)
- テクニカルスタッフⅠ 大羽 尚子(おおば ひさこ)
- テクニカルスタッフⅡ 渡邉 明子(わたべ あきこ)
- テクニカルスタッフⅠ 野崎 弥生(のざき やよい)
- 大学院生リサーチ・アソシエイト 和田 唯奈(わだ ゆいな)
- 生体物質分析ユニット
- ユニットリーダー 俣賀 宣子(またが のぶこ)
- 専門技術員 岩山 佳美(いわやま よしみ)
- 千葉大学 社会精神保健教育研究センター 病態解析研究部門
-
- 教授 橋本 謙二(はしもと けんじ)
- 特任助教 藤田 有子(ふじた ゆうこ)
- 大学院生 ユンフェイ・タン(Yunfei Tan)
- 福島県立医科大学 医学部 神経精神医学講座
-
- 教授 矢部 博興(やべ ひろおき)
- 准教授 國井 泰人(くにい やすと)
- 講師 松本 純弥(まつもと じゅんや)
- 医師 長岡 敦子(ながおか あつこ)
- 博士研究員 日野 瑞城(ひの みずき)
- 群馬大学 生体調節研究所 脳病態制御分野
-
- 教授 林(高木)朗子(はやし・たかぎ あきこ)
- 新潟大学 脳研究所 病理学分野
-
- 教授 柿田 明美(かきた あきよし)
研究支援
本研究は、日本医療研究開発機構(AMED)脳科学研究戦略推進プログラム『臨床と基礎研究の連携強化による精神・神経疾患の克服(融合脳)』「細胞内代謝・ダイナミクス制御から切り拓く発達障害・統合失調症の病理の解明・新規治療法の開発(代表:吉川武男)」、「うつ症状の神経基盤モデルに基づく診断・治療法の開発-皮質・側坐核・中脳系への着目(代表:橋本謙二)」、「日本ブレインバンクネットの構築(代表:齋藤祐子)」、および日本学術振興会(JSPS)科学研究費補助金新学術領域研究「マルチスケール精神病態の構成的理解(領域代表者:林(高木)朗子)」、同基盤研究(A)「統合失調症生起・転帰の縦断的メカニズムの解明(代表:吉川武男)」による支援を受けて行われました。
背景
統合失調症は、一般人口の約100人に1人の割合で発症する比較的頻度の高い精神疾患です。思春期に好発しますが、適切な治療や医療を受けないと生涯にわたって生活の質(QOL)が障害される可能性が高いという問題があります。
現在利用できる治療薬のほとんどは、神経伝達物質の受容体をブロックするものですが、薬が効かない、いわゆる「治療抵抗性」の患者は3割にのぼるという報告があり、副作用に悩まされる患者も多く存在します。このような状況の中で、統合失調症の治療薬をどのような原理に基づいて開発すればいいのかが模索され、これまでの薬とは作用機序の異なる新しい有効な治療薬の開発が喫緊の課題となっています。また、薬ごとに効く患者を選別できるバイオマーカーの開発も、プレシジョンメディシン(精密医療)の流れの中で求められています。
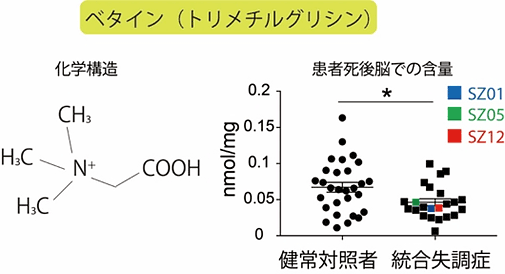
一方、ベタイン(トリメチルグリシン)は、植物や海産物などに広く存在するため食事からも摂取できますが、脳を含む体の細胞で合成されている天然代謝産物です。2014年に、統合失調症患者の血液中の代謝産物を網羅的に測定した結果、初発(治療薬の影響がほとんどないと予想される)の患者の一部では、健常者と比べてベタインの濃度が低下しているという研究が日本から報告されました注1)。
そこで、共同研究グループは、この報告に基づき、ベタインを補充すれば統合失調症の治療薬になるのではないかと考えました。- 注1)
- Koike et al., “A snapshot of plasma metabolites in first-episode schizophrenia: a capillary electrophoresis time-of-flight mass spectrometry study”Translational Psychiatry 4, e379, 2014
研究手法と成果
ベタインは、体内ではアミノ酸であるメチオニンやホモシステインの代謝に関わるメチオニンーホモシステイン回路にて機能を果たしています(図1)。
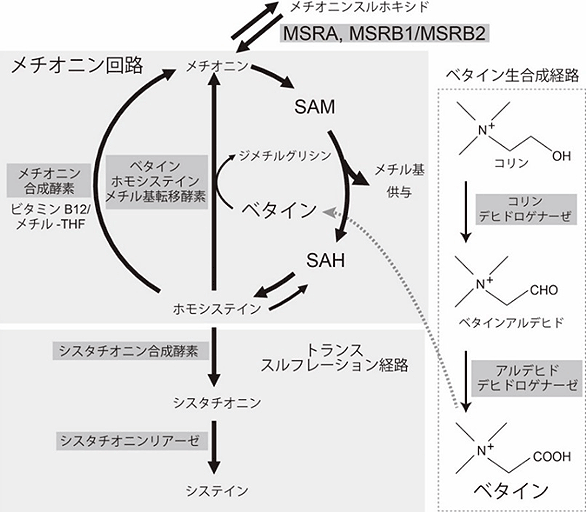
図1 ベタインが関係するメチオニン-ホモシステイン回路
共同研究グループはまず、ベタインの脳内での代謝を詳しく調べるために、ベタイン合成酵素のコリンデヒドロゲナーゼをコードしているChdh遺伝子をノックアウトしたマウスを作製しました。その結果、Chdh遺伝子ノックアウトマウスは抑うつ傾向を示し、その脳内遺伝子発現パターンは統合失調症患者の死後脳で報告されている所見と重なることが分かりました。
また、Chdh遺伝子ノックアウトマウスでは、脳内のベタイン濃度がほぼゼロとなり、ベタインを飲み水で投与するとベタイン濃度が回復しました(図2)。このことから、通常は脳内のベタインは、餌からというよりも体内で合成したもので賄われていること、また経口からベタインを投与すると脳に移行し、脳内ベタイン濃度が上昇することが分かりました。
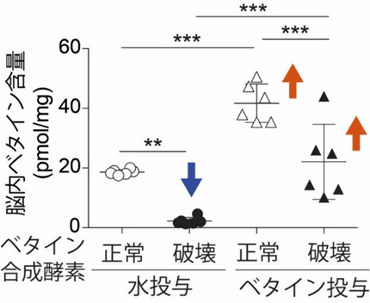
図2 Chdh遺伝子ノックアウトマウスを使った脳内ベタイン濃度の解析結果
次に、ベタインを体外から補充した場合、向精神作用(精神症状を改善させる作用)を示すかどうかを調べました。覚醒剤であるメタンフェタミン(MAP)は、ヒトに慢性投与すると統合失調症類似の幻覚妄想状態を引き起こします。また、MAPをマウスに反復投与すると運動量が増加しますが、これを行動感作と呼びます。
B6Nというある遺伝的背景をもつ近交系マウスにMAPを反復投与したところ、明らかな行動感作が生じ、その行動感作はベタインを投与すると抑制されました(図3B, C)。一方、C3Hという別の遺伝的背景をもつ近交系マウスでは、行動感作がB6Nマウスよりも弱く、ベタインによる行動感作の抑制作用は認められませんでした(図3D, E)。これらの結果と統合失調症の遺伝的背景はさまざまであることを合わせて勘案すると、ベタインは統合失調症の一部の患者には効果がある可能性があると考えられます。
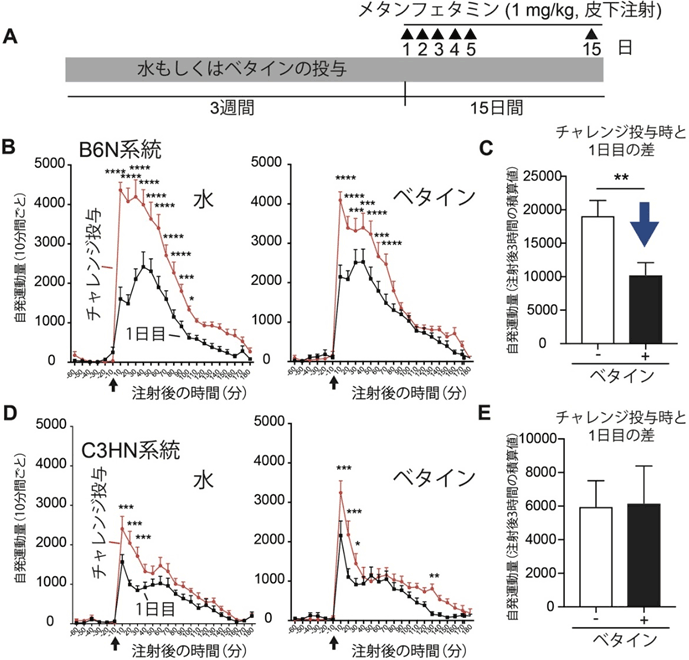
図3 マウスにおけるメタンフェタミンを用いた行動感作に対するベタインによる作用
B:B6N近交系マウスでのMAPの反復投与に対するベタインの効果。左側の水投与では、15日目のMAP投与(チャレンジ投与)後、行動量は大きく亢進しているが(赤線)、右側のベタイン投与群では行動感作が抑制された。
C:B6N近交系マウスでの15日目から1日目の自発運動量を差し引いたもの。ベタイン投与では、青矢印で示すように行動感作が抑制されたことが分かる。
D:C3HN近交系マウスでのMAPの反復投与に対するベタインの効果。左側の水投与では、15日目のMAP投与(チャレンジ投与)後の行動量の亢進はB6N近交系マウスよりも弱い(赤線)。右側のベタイン投与群では行動感作は抑制されなかった。
E:C3HN近交系マウスでの、15日目から1日目の自発運動量を差し引いたもの。ベタインの行動感作抑制作用が見られない。
さらに、他の薬理学的モデルとして、幻覚剤であるフェンサイクリジン(PCP)を検討しました。PCPは、ヒトで慢性投与すると幻覚・妄想などの陽性症状ばかりでなく、意欲減退、感情の平板化などの陰性症状類似の症状を引き起こすことが知られています。PCPをマウスに反復投与したところ、認知機能を評価する新規物体認識テスト[11]の成績が不良となりましが、ベタインの併用投与でこの障害を完全に防ぐことができました。新規物体認識テストの成績不良は、記憶障害や古いものに執着する性質(陰性症状)を表していると考えられています。
以上の動物実験のほかに、福島ブレインバンク、新潟ブレインバンクから供与されたヒト死後脳を解析したところ、ベタイン濃度が低下し(図4A)、酸化ストレスの一種であるカルボニルストレス[12]が亢進している統合失調症の一群が存在することが判明しました。
そこで、ゲノム編集技術[13]を用いて、カルボニルストレス解消の働きをする酵素GLO1をコードする遺伝子を破壊したヒト由来iPS細胞[14]を作製しました(図4B)。その結果、このiPS細胞では、実際にカルボニルストレスが亢進しており、ベタイン濃度が低下していることが分かりました(図4C上)。これは、酸化ストレス状態を改善するために、ベタインが過剰に消費されているからだと考えられます。GLO1の破壊では、ベタイン濃度の低下に加えて、メチオニンーホモシステイン回路の回転率に関係のあるS-アデノシルメチオニン(SAM)/S-アデノシルホモシステイン(SAH)比[15](メチル化指数)も低下していました(図4C下)。一方、このiPS細胞にベタインを添加したところ、カルボニルストレス状態は改善されました。
以上のことから、ベタインの作用機序の一部として抗酸化ストレス作用が考えられます。このことは、上記のMAP投与マウス、PCP投与マウスでも確かめられました。
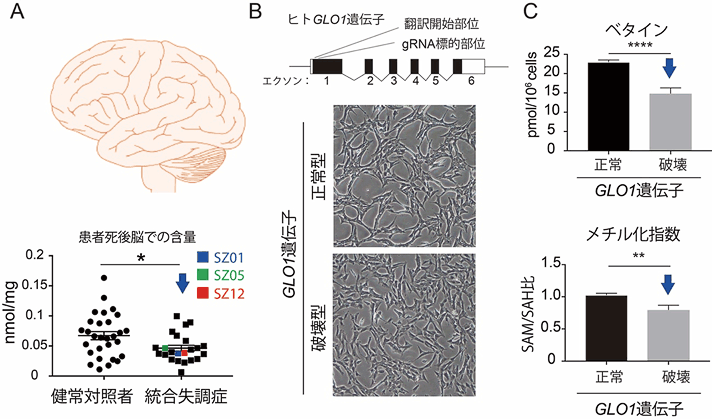
図4 死後脳の解析とベタインの作用機序
B:ゲノム編集技術によりGLO1遺伝子を破壊し、カルボニルストレス亢進細胞を作製した。顕微鏡観察では、GLO1遺伝子の破壊による細胞の形態や増殖には大きな変化は認められなかった。
C:カルボニルストレス亢進細胞では、ベタイン含量の低下(上)に加えて、SAM/SAH比(メチル化指数)が低下していた(下)。後者は、タンパクやDNAのメチル化が影響を受ける可能性のあることを示す。
一般に、向精神薬は効果がある患者とない患者が存在します。ベタインの場合も、前述のように、動物実験から遺伝的背景によって効果の出方が異なることが明らかになりました。そのため、ベタインをヒトで用いる場合、あらかじめ薬効の見られる可能性のある患者をバイオマーカーである程度見分けることが望ましいと考えられます。
そこで、ベタイン合成酵素遺伝子であるCHDHの脳内発現量を予測する一塩基多型(SNV)[16]について、GTEx (Genotype-Tissue Expression)データベース注2)で候補を絞り、日本人死後脳で調べました。その結果、rs35518479というSNVが、CHDH遺伝子の発現量ばかりでなく、メチル化指数にも影響を与えることが分かりました(図5)。この結果から、rs35518479というSNVを調べることで脳内ベタイン代謝の程度が予測でき、ベタインは特にG/G(グアニン/グアニン)という遺伝子型を持つ患者に効果が見られる可能性があると考えられます。
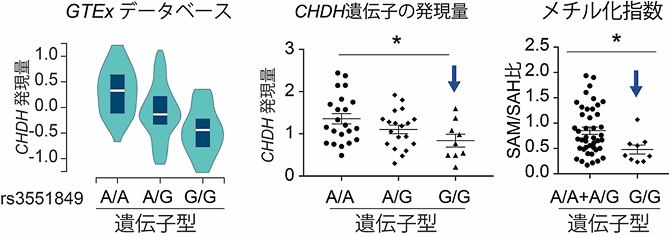
図5 rs3551849の遺伝子型のCHDH遺伝子発現量、およびSAM/SAH比に与える影響
中央:日本人死後脳でも、Gという対立遺伝子が多いほどCHDH遺伝子の発現量が少なくなる。
右:rs3551849のG/G型は、それ以外の遺伝型に比較してSAM/SAH比(メチル化指数)が有意に低い。
- 注2)
今後の期待
これまで、統合失調症の治療が困難だった理由には、既存の治療薬が奏功しない難治群が存在すること、新しい薬を開発する原理が不明なため新規治療薬の開発が進まないこと、既存薬でもどの薬が効くかは順番に試さなければならないため、薬の作用を予測するバイオマーカーが必要であることなどが挙げられます。
今回の研究成果から、全く新しい作用機序を持つベタインは、臨床で統合失調症の治療薬としての効果を試験する価値があると期待できます。またその際、rs35518479というバイオマーカーの有効性を検討することには意義があると考えられます。なお、ベタインは今回の動物実験でも副作用は見られず、先天性ホモシスチン尿症[17]に対する医薬品として既に承認されていることから、安全性に関しては問題がないと考えられます。
論文情報
- タイトル
- Investigation of betaine as a novel psychotherapeutic for schizophrenia
- 著者名
- Tetsuo Ohnishi, Shabeesh Balan, Manabu Toyoshima, Motoko Maekawa, Hisako Ohba, Akiko Watanabe, Yoshimi Iwayama, Yuko Fujita, Yunfei Tan, Yasuko Hisano, Chie Shimamoto-Mitsuyama, Yayoi Nozaki, Kayoko Esaki, Atsuko Nagaoka, Junya Matsumoto, Mizuki Hino, Nobuko Mataga, Akiko Hayashi-Takagi, Kenji Hashimoto, Yasuto Kunii, Akiyoshi Kakita, Hirooki Yabe, Takeo Yoshikawa
- 雑誌
- EBioMedicine
- DOI
- 10.1016/j.ebiom.2019.05.062
補足説明
- [1]ベタイン(トリメチルグリシン)
- 最も単純なアミノ酸であるグリシンのアミノ基に三つのメチル基が結合した構造(そのためトリメチルグリシンとも呼ばれる)をしており、生体内で合成され、代謝物のメチル化反応に関与するなどさまざまな働きを示す。臨床では、ホモシスチン尿症という遺伝性疾患の治療薬として既に用いられている。
- [2]統合失調症
- 代表的な精神疾患であり、人口の約1%という比較的高い生涯発症率を持つ。多くは思春期から壮年期の間に発症し、幻覚や妄想に代表される「陽性症状」、感情の平板化、うつ病様症状に代表される「陰性症状」、認知学習機能の低下を伴う。ドーパミンと呼ばれる神経伝達物質の作用を抑える薬剤の投与が治療の中心となるが、その治療効果は不十分だったり、再燃を繰り返すうちに次第に重篤化したりすることも多い。そのため、発症メカニズムの理解とそれに基づく根本的な治療法、予防法の開発が長く望まれている。
- [3]プレシジョンメディシン
- 日本語では精密医療と訳す。各患者の遺伝情報やその他の生体試料などの分析結果から、患者を分類・階層化し、それぞれの群、患者に適した治療を施すこと。
- [4]神経伝達物質
- シナプス(神経細胞間などに形成される神経活動に関わる接合部位)で情報伝達を介在する物質。セロトニンやドーパミンは代表的な神経伝達物質である。
- [5]ベタイン合成酵素遺伝子
- ベタインは食物から摂取する以外に、哺乳類ではコリンと呼ばれる物質から二段階の反応で合成される。この第一段階で働くのがベタイン合成酵素(コリンデヒドロゲナーゼ)であり、この遺伝子を破壊すると生体内でベタインを合成できなくなる。
- [6]メタンフェタミン(MAP)
- 覚醒剤に分類される薬剤で、脳内のドーパミンと呼ばれる神経伝達物質を増やすことにより作用を発揮する。ヒトが摂取した場合、統合失調症で見られる幻覚が引き起こされる場合がある。マウスに投与した場合は、多動や認知機能の低下などが引き起こされる。反復投与すると、少量の用量でもこれらの反応性がより増強することが知られており、これを行動感作あるいは逆耐性と呼ぶ。MAPはmethamphetamineの略。
- [7]フェンサイクリジン(PCP)
- 幻覚剤の一種で、脳内のNMDA型グルタミン酸受容体と呼ばれる神経伝達物質の受容体の働きを抑制する。この薬物の乱用者では、統合失調症で見られるさまざまな症状が引き起こされる。マウスにこの薬剤を連続投与することで、統合失調症の薬剤誘発性動物モデルを作製できる。PCPはphencyclidineの略。
- [8]酸化ストレス、抗酸化ストレス作用
- 生体内で酸化還元状態の均衡が崩れたとき、過酸化水素やヒドロキシラジカルを代表とする活性酸素が生産される。これらが生体内のタンパク質、脂質、核酸などと反応し、生体にダメージを与える。これを酸化ストレスと呼び、酸化ストレスに対抗する作用を抗酸化ストレス作用という。
- [9]バイオマーカー
- 疾患の発症や病態の進展の予測に貢献する生体由来の物質。血液中の代謝産物や特定の遺伝子配列等が対象となる。
- [10]ゲノムデータベース
- 近年のゲノム(遺伝情報の総体)解析技術の進展に伴い、極めて多くのサンプルの解析により得られた塩基配列情報を、インターネットを通じて各研究者が自由に閲覧できるようなプラットフォーム環境が整備されてきた。これをゲノムデータベースと呼ぶ。
- [11]新規物体認識テスト
- マウスが初めて見るものに興味を示し探索行動を行う性質を利用し、認知学習機能を評価する方法。まず、マウスにニつの物体を提示し自由に探索させる。翌日、そのうち一つを色や形が異なる物体に取り替えると、正常なマウスは慣れ親しんだ物体より、新規の物体を認識し興味を示し探索する行動をとる。統合失調症で見られる認知学習機能の低下をマウスで調べられるテストと考えられている。
- [12]カルボニルストレス
- 生体が高い酸化ストレス状態に置かれると、生体内の糖質などから反応性カルボニル化合物と呼ばれる物質が生成される。反応性カルボニル化合物は、最終的にタンパク質を化学的に変化させ、終末糖化産物と呼ばれる細胞に有害な物質が生成される。終末糖化産物が多量に蓄積する状態をカルボニルストレスと呼ぶ。GLO1は、反応性カルボニル化合物を除去する酵素である。
- [13]ゲノム編集技術
- 核酸分解酵素を部位特異的に作用させることで、遺伝情報を改変する技術。
- [14]iPS細胞
- 脊椎動物の初期胚が持つ、全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。iPS細胞は、皮膚細胞などの体細胞・組織から採取した細胞に、OCT3、SOX2、KLF4遺伝子などを導入して初期化し多能性を持たせ、人工的に作製した多能性幹細胞である。
- [15]S-アデノシルメチオニン(SAM)/S-アデノシルホモシステイン(SAH)比
- メチル化指数(methylation index)とも呼ぶ。タンパクやDNAをはじめさまざまな生体物質のメチル化反応は、生体におけるさまざまな調節に関わる。その際、メチル基の供与体として働くのがSAMであり、SAMがメチル基の供与体として働いてメチル基を放出するとSAHを生じる。SAM/SAHの比が高いほど、生体内でメチル化反応が起こりやすい環境となっていると考えられる。また、SAM/SAHの比が高いほど、メチオニンーホモシステイン回路の回転率が高まっていると考えられ、それによって抗酸化作用を持つメチオニンの合成が高まるため、生体の抗酸化作用は高まると考えられる。
- [16]一塩基多型(SNV)
- ゲノムの個人間の違いのうち、A、C、T、Gからなるヒトゲノム塩基配列上の1カ所の違い(置換)が一塩基多型と定義される。Single nucleotide variant の略。
- [17]先天性ホモシスチン尿症
- メチオニンーホモシステイン回路において生成されるホモシステインというアミノ酸が生体内で蓄積した結果、その直接、間接の毒性により中枢神経症状、骨格異常など多彩な症状が現れる遺伝性疾患である。主な原因は、シスタチオニン合成酵素(図1参照)の遺伝子変異である。ベタインは、ホモシステインをメチオニンに代謝する反応に直接関与するため、ホモシステイン濃度を下げることで治療効果を発揮する。
発表者・機関窓口
発表者
理化学研究所 脳神経科学研究センター 分子精神遺伝研究チーム
副チームリーダー 大西 哲生(おおにし てつお)
研究員 シャビーシュ・バラン(Shabeesh Balan)
チームリーダー 吉川 武男(よしかわ たけお)
機関窓口
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press"AT"riken.jp
AMED事業について
国立研究開発法人 日本医療研究開発機構
〒100-0004 東京都千代田区大手町1-7-1 読売新聞ビル
戦略推進部 脳と心の研究課
E-mail:brain"AT"amed.go.jp
※上記の"AT"は@に置き換えてください。
掲載日 令和元年6月27日
最終更新日 令和元年6月27日


