プレスリリース ALSに特有なタンパク質の高精度な定量法の開発―将来の革新的なALS診断への端緒になる研究―
プレスリリース
京都府立医科大学
日本医療研究開発機構
研究の概要
京都府立医科大学分子脳病態解析学の徳田隆彦(とくだ たかひこ)教授、京都府立医科大学神経内科学の笠井高士(かさい たかし)講師らは、筋萎縮性側索硬化症(ALS, ルー・ゲーリック病)患者の脳・脊髄で異常に凝集した分子となり蓄積するTDP-43を、ヒトの脳脊髄液中および血液中で超高感度に定量できる測定システムを開発しました。このTDP-43測定システムと、神経細胞間の情報伝達に重要な神経軸索突起の障害を反映するニューロフィラメント軽鎖(NfL)を定量できる測定システムとを組み合わせて、ALS患者群と対照患者群との比較を行いました。その結果、ALS患者群では脳脊髄液中および血液中でTDP43とNfLがともに有意に高値であり、脳脊髄液中のTDPとNfLの定量とを組み合わせることによって、これまでは不可能であったALSの生化学的な診断が高精度で可能になることを、本年5月の日本神経学会総会において世界で初めて報告しました。さらに、血液中・脳脊髄液中のNfLがALS患者の生命予後と最も相関することも明らかにしました。今回の発表はこれらの報告を論文化したものであり、これまでは臨床症状からでしか診断ができなかったALSの診断および予後の判定を、生化学的なバイオマーカーを用いて、正確かつ迅速に診断できることを示した画期的な研究成果です。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の難治性疾患実用化研究事業からの委託研究開発費によって行われました(研究課題名「プリオノイド蛋白質の凝集・伝播を標的とした神経コンフォメーション病の分子標的治療薬・バイオマーカーの開発」, 研究代表者: 大阪大学大学院医学系研究科 神経難病認知症探索治療学寄附講座 永井義隆教授; 徳田は分担研究者)。今後は、本研究成果の実用化に向けて、診断機器・試薬メーカーと共同研究を検討していきます。
本研究成果は、オンラインジャーナルである「Annals of Clinical and Translational Neurology」誌に、2019年11月11日(月曜日)(米国時間)に公開されます。
本研究成果のポイント
- 笠井・徳田らは、超高感度なデジタルアッセイ技術であるSimoa(Single molecular array; 米国Quanterix社)(注1)を導入して、TDP-43(注2)、NfL(注3)、tau(注4)を、ヒトの脳脊髄液(髄液)・血液において検出・定量しました。これまでの研究において、これらのタンパク質はそれぞれ個別に検討され、ALSの診断や予後の予測における有用性が指摘されていましたが、これら全ての濃度を包括的に測定した研究はありませんでした。
- ALS患者由来の髄液および血液におけるこれらのタンパク質の濃度を対照患者由来の髄液・血液との間で比較したところ、ALS患者群において髄液中TDP-43、髄液中NfL、血液中NfLが有意に増加していました。特に髄液中TDP-43と髄液中NfLを組み合わせることによって、非常に高い精度のALS診断を実現することができました。また、髄液中・血液中いずれにおいてもNfLは高値であることが、生命予後の不良と有意に関係していました。
- ALSはこれまで、神経学的な診察と電気生理学的な検査の組み合わせによって診断されてきました。しかし、診察・検査技術の習得が困難なため診断できる医師が限られており、結果として正確な診断を得るまでに時間を要することが問題でした。これまでの報告からNfLはALS発症の早期から上昇していることが明らかになっていましたが、NfLには疾患特異性がなく多くの神経疾患で上昇するため、NfLを補完してALSを特異的に診断できる疾患特異的なマーカーが強く求められています。今回の報告はNfLを補完する疾患特異なマーカーとして脳脊髄液中のTDP-43の意義を確認した、最先端の画期的なものです。
- 今回我々が開発した新規の定量システムは、一般病院での髄液検査によってALSを迅速かつ正確に診断できるようになる可能性があり、日常診療から臨床研究までの全ての局面で、ALSの診断過程を革新的に進歩させると期待されます。
研究の背景
ALSは進行性の筋力低下と筋萎縮を特徴とする疾患です。この疾患は経験を積んだ専門医でないと診断が難しいため、診断の確定に時間を要することが問題でした。こうした問題を克服するため髄液や血液におけるタンパク質の濃度を測定し、ALS診断のバイオマーカーとして利用する試みが過去10年間にわたって活発に行われてきました。これまでに髄液中バイオマーカーの候補としてTDP-43、NfL、tauの有用性が報告されており、TDP-43、NfLについては血液中濃度でも診断に有効であるとする報告もあります。しかしながら、これまでの研究は、それぞれのバイオマーカーを個別に測定した報告がほとんどであり、全てのバイオマーカーを包括して測定した報告はありませんでした。我々は、上記のバイオマーカーを髄液だけでなく血液も含めて測定し、複数のバイオマーカーを組み合わせることによって診断の精度を向上させることを目標に研究を行いました。一部のタンパク質(特にTDP-43)に関して、従来の方法では安定した測定ができませんでしたが、今回の研究では測定方法の高感度化によって克服しました。
ALSは病気の進行を遅らせることが非常に困難な疾患として知られており、世界中で根本治療薬が開発されています。しかし、これらの治療薬が病気の進行を本当に遅らせていることを知るためには、現在の病気の進行度を反映するマーカーを開発する必要があります。これまでの報告では、髄液中・血液中のNfLが進行度を反映するという結果が得られていましたが、TDP-43、tauについては意見が分かれていました。今回の研究では、TDP-43、NfL、tauそれぞれについて進行を予測するマーカーとしての有用性があるかどうかも検証しました。
研究の内容
1) 超高感度のデジタルアッセイ技術の利用
我々は、近年のバイオマーカー研究におけるブレークスルーであり、最近実用化された超高感度なデジタルアッセイ技術であるSimoa(Single molecular array; 米国Quanterix社)を導入し、2016年1月から、アルツハイマー病などの様々な神経変性疾患の診断に応用する研究に着手してきました。今回のTDP-43、NfL、tauの定量には一貫してSimoaを用いています。本技術を利用することによって、従来の方法では安定した定量が困難であった血液中のTDP-43、NfL、tauを、ほとんどの検体で測定することに成功しました。
2) ALS患者と対照患者間の比較
次に我々は、これらのバイオマーカーをALS患者群と対照患者群(探索コホートでは神経変性疾患を有さない髄液検査施行患者、検証コホートではALSに類似した運動障害を呈する神経筋疾患患者)において比較検討しました。正確を期すために検討は二つの集団(探索コホートと検証コホート)に分けて行い、両方の集団において再現性が得られた結果は、①髄液中のTDP-43がALS患者において有意に上昇していること(図1A、1B)、②髄液中のNfLがALS患者において有意に上昇していること(図1C、1D)、③血液中のNfLがALS患者において有意に上昇していること (図1E、1F)の3点でした。さらにこれらのバイオマーカーを組み合わせ(掛け合わせ)ると、髄液TDP-43と髄液NfLの組み合わせにおいて、各々を単独で使用した場合よりも診断の精度が向上することが明らかになりました (図2A、2B)。この結果はALSの診断において、髄液中のNfLとTDP-43の濃度はお互いに補完的な役割があることを意味しています。NfLは髄液中だけでなく血液中でもALSにおいて上昇することが、最近の研究でおおよそ明らかになっていましたが、神経軸索突起の障害の程度を反映する指標であるため、ALSに限らず多くの神経疾患で上昇してしまいます。したがって、仮にNfLにおいて異常値を検出しても、患者が具体的にALSに罹患しているかを判定するには結局、神経学的な診察や電気生理学的な検査を経なければ特定できない点に問題がありました。これに対して、TDP-43はALSの病態に直接関連する分子であり、自分たちの過去の研究においても髄液中のTDP-43の上昇はALS以外の疾患では見られないことを示しています。したがって、これら二つの指標を組み合わせることによって診断の検出感度を高く維持したまま、他の疾患を除外してALSだけを抽出することが可能になると期待されます。実際にALSと類似した神経疾患との鑑別を行った検証コホートでは、臨床診断によらずバイオマーカーの組み合わせのみで診断可能なレベルの精度(ROC解析におけるAUC>0.9: 注5)を達成し、診断の感度/特異度とも非常に高い成績を得ました。
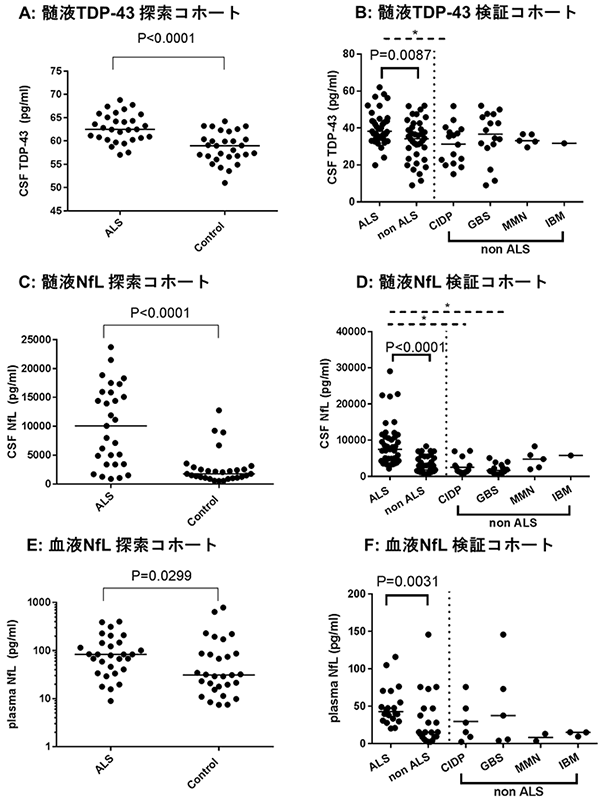
図1.ALS患者群と対照(control)患者群の髄液TPD-43、髄液NfL、血液NfLの比較
検証コホートでは対照をALSに類似した神経症状を示すがALSとは異なる疾患(慢性炎症性脱髄性ニューロパチー:CIDP, ギランバレー症候群:GBS, 多巣性運動ニューロパチー:MMN, 封入体筋炎:IBM)を対照として用いた。
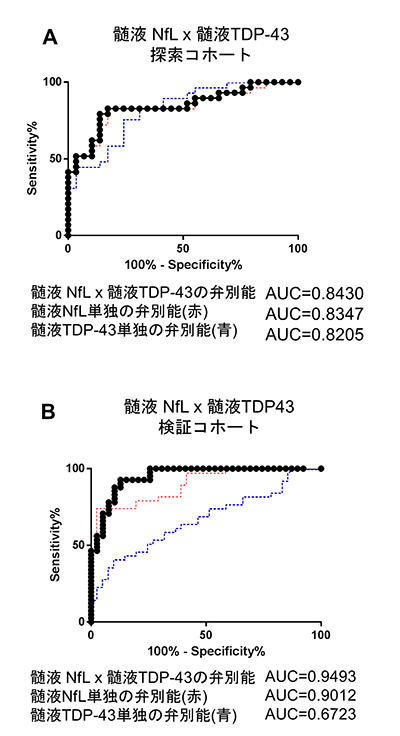
図2.髄液TDP43と髄液NfLの組み合わせ(掛け合わせ)による診断精度の向上
3)髄液中および血液中NfLと生命予後の関係
さらに、我々は全てのバイオマーカーとALS患者の生命予後(検体の採取時点から死亡または人工呼吸器の永続的な使用までの期間)を比較しました。すると、髄液中および血液中のNfLが高いALS患者は生命予後が悪い傾向にあることが明らかになりました(図3C、3D)。この結果はNfLが神経細胞の軸索突起の構成成分であり、その破壊を反映している指標であることを考えると合理的なものです。つまりNfLはALSによって神経細胞が現在、障害されている程度、すなわち時間当たりの神経細胞の障害速度を反映していると理解することができます。この結果は、これまでの研究において確認されていた事実を再確認した形になります。ALSの客観的な重症度を生化学的なバイオマーカーによって判定することは、まとめの項で示すように、新たな治療薬の開発を行う上で重要な意義を有しています。
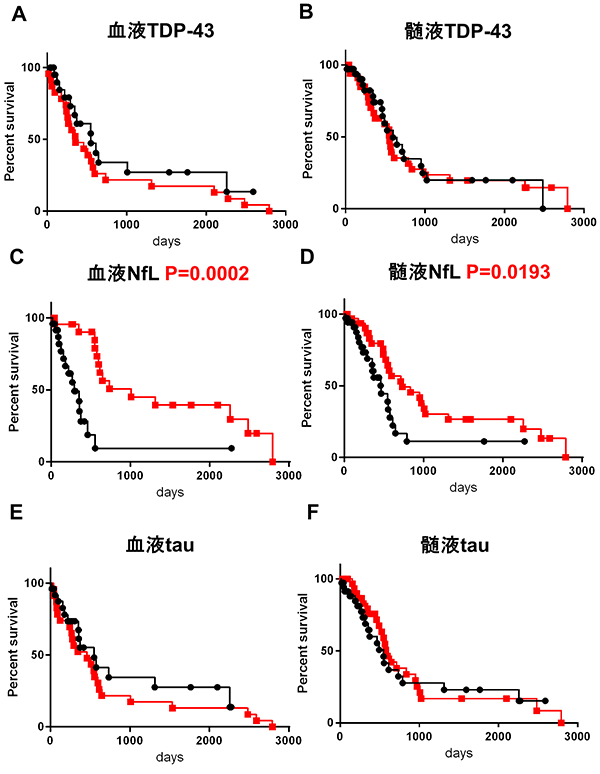
図3.髄液・血液NfL濃度と生命予後
以上の1)2)3)の結果を主な内容として、「Annals of Clinical and Translational Neurology」誌(オンラインジャーナル, 2017/2018 Impact Factor: 4.656)に、今回の研究成果を発表しました。
まとめと今後の展開
今回の研究は、ALSの病変部位に特異的に蓄積するTDP-43と神経軸索の障害を反映するNfLの髄液中の定量が、生化学的なバイオマーカーによるALS診断を実現できることを示した画期的な成果です。我々は今回の結果が『ALSを専門的なトレーニングを経た熟練した医師だけが診断できる特殊な疾患から、一般診療において診断可能な普通の疾患に変える』ための重要なステップになると考えています(図4)。神経は一度障害されると回復しない組織ですので、疾患の性質に関わらず治療はできるだけ早期に行うことが望まれています。しかしALSの診療では、症状の自覚から、かかりつけ医の受診、総合病院・専門医への紹介、熟練した技術者による電気生理的な検査などを経る過程で、診断確定までの時間が大きく浪費され、ALS発症の早期から治療介入することが難しい点が問題でした。今回の生化学的なバイオマーカーの開発は、少なくとも血液中のNfLを測定することによって、ALSを発症している可能性がある人をかかりつけ医の段階で簡便にスクリーニングできる可能性を示しました。さらにこのスクリーニングの結果、異常があった場合に髄液検査を行えば、髄液中のTDP-43/NfLの組み合わせによってALSの診断を行うことができます。この生化学的なバイオマーカーによる診断プロセスは、従来の診療に比べて診断確定までの時間を大幅に短縮することができます。このように診断された極早期のALS患者は、既存の治療薬あるいは今後開発が期待されるより効果の高い治療薬のいずれに対しても、より恩恵を受けやすい状態にあると想像されます。
さらに、今回の検討で改めて確認された髄液中・血液中のNfLによる神経障害の進行速度の数値化は、ALSの新たな治療法を開発する上で重要な技術基盤になります。ALSは病気の進行を遅らせることが非常に困難な疾患であり、様々な治療薬が開発され臨床治験が行われています。しかし、こうした研究が必ずしも成功しない理由の一つに、『病気の進行速度を正確に判定することが難しい』ことが挙げられていました。患者毎に進行の速度は様々であり障害されている部位も異なるので、臨床症状や日常生活上の障害度を指標にすると、トレーニングを十分に受けた専門家であっても治療効果の判定の正確性を担保することは容易ではありませんでした。NfLを神経障害の程度の指標となる代理マーカーとして利用することによって、ALS治療薬の効果がより客観的かつ正確に判定できるようになり、ALS治療薬の開発がスムーズになる可能性があります。
この数年、ALSの研究領域では、世界的にもバイオマーカーの開発研究が活発かつ非常な競争のもとに行われています。今回の報告は、AMEDからの研究費の支援を受けて行った難治性疾患実用化研究事業:「プリオノイド蛋白質の凝集・伝播を標的とした神経コンフォメーション病の分子標的治療薬・バイオマーカーの開発」(研究代表者: 大阪大学 永井義隆教授)の成果であり、世界的なALSのバイオマーカーの開発競争をリードする、最先端の画期的な報告です。
今後は、今回開発したTDP-43、NfL、tauの定量系の有用性を、より大規模な患者コホートにおいて、横断的・縦断的に採取した多数の検体で検証する必要があります。このような、今後の大規模試験で我々の定量系の有用性が検証されれば、それによってALSの診断を、客観的・効率的・非侵襲的かつ安価に行えるようになることが期待できます。例えば、我々が開発した測定法は、一般の健常者を対象にした健診において、迅速なスクリーニング検査として用いることができます。また、今後開発されることが予想される新規の根本治療薬の開発研究でも、その臨床治験においてエントリーする患者をより客観的で正確に診断することが可能になり、新薬の開発研究に大きく貢献できます。これら応用例のように、今回我々が開発したALSに関連したバイオマーカーの定量が可能な新規の測定法は、ALSの臨床研究、日常診療、および治療薬開発のすべての局面で、診断過程を革新的に進歩させることが可能になると考えられます(図4)。
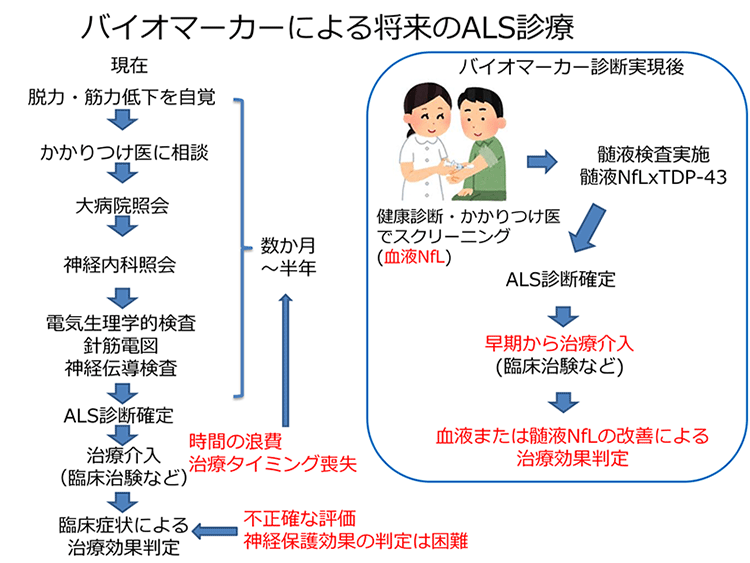
図4.今回のバイオマーカー開発が意図する将来のALS診断
論文情報
- 論文名
- Combined use of CSF NfL and CSF TDP-43 improves diagnostic performance in ALS.
- ジャーナル名
- Annals of Clinical and Translational Neurology
Impact Factor=4.656 - 著者
- Kasai T, Kojima Y, Ohmichi T, Tatebe H, Tsuji Y, Noto Y, Kitani-Morii F, Shinomoto M, Allsop D, Mizuno T, Tokuda T(以上、全員記載)
用語解説
- (注1)Simoa
- Single molecular arrayの略で、2010年に発表された極微量なタンパク質の定量技術(図5も参照)。従来からバイオマーカーの定量に用いられていたELISA法などと同様に、目的とするタンパク質とそれを捕捉・検出する抗体との反応によって定量を行うが、反応によって生じた生成物の検出方法を大幅に改良することによって、極微量な抗原(目的とするタンパク質)の検出を可能にしている。この方法により、従来のサンドイッチELISA法で用いていた捕捉抗体と検出抗体と同じセットを用いても、検出の感度を500倍から1000倍に増強することができる。米国Quanterix社がこの技術を製品化している。
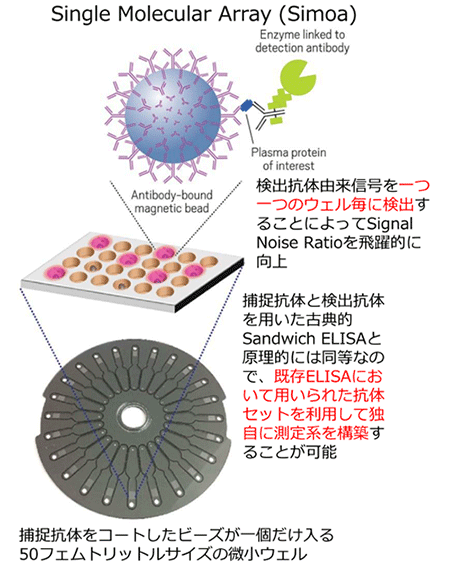
図5.Simoaの原理
- (注2)TDP-43
- TAR DNA-binding protein 43kDaの略。正常では核内に存在するRNA結合タンパク質であり、DNAからRNAへの転写の調整を行っている。ALS患者では、リン酸化されたTDP-43が神経細胞内(核外)に異常な凝集体として蓄積する。この凝集体の出現はALSの97%に見られ、ALSの重要な病理学的な特徴であり、本症の神経障害のメカニズムに深く関与していると推察されている。我々は過去の研究においてALS患者の脳脊髄液中ではTDP-43濃度が高いこと、髄液中のTDP-43濃度の上昇はALSに類似した疾患(末梢神経障害など)では見られず疾患特異性が高いことを既に報告している。(Kasai T, Tokuda T, Ishigami N, et al. Increased TDP-43 protein in cerebrospinal fluid of patients with amyotrophic lateral sclerosis. Acta Neuropathol 2009;117:55-62. Noto Y, Kasai T, Tokuda T. et al. Elevated CSF TDP-43 levels in amyotrophic lateral sclerosis: specificity, sensitivity, and a possible prognostic value. Amyotroph Lateral Scler 2011;12:140-143.)
- (注3)NfL
- Neurofilament Light chain (ニューロフィラメント軽鎖)の略。神経細胞の軸索突起に豊富に含まれる細胞骨格の成分である。神経細胞に特有のタンパク質であり、神経細胞の障害を反映して髄液中で上昇し、その一部は血液中に漏出して血液中でも上昇がみられる。このバイオマーカーの上昇は神経疾患の存在を示唆しているが、アルツハイマー病、脳梗塞、および末梢神経障害など、多くの神経疾患において髄液中・血液中での上昇がみられる。したがって、NfLの増加を捉えても、神経細胞に障害が生じていることは診断できるが、原因疾患の鑑別診断(多くの病気の中から原因となっている病気を特定すること)を行うことは難しい(疾患特異性がないバイオマーカー)。
- (注4)tau
- 神経細胞の微小管に結合するタンパク質である。このタンパク質がリン酸化された状態(リン酸化tau)の凝集体は、アルツハイマー病および前頭側頭型認知症の一部に見られる。髄液中および血液中のリン酸化tau濃度の上昇はアルツハイマー病の診断に有用とされているが、今回は特にリン酸化の有無を問わない総tauの濃度を測定している。総tauの濃度は神経障害全体の程度を反映すると考えられており、ALS患者の診断に有用であるという報告がある一方で、あまり変化しないという報告が混在しており、評価が定まっていなかった。
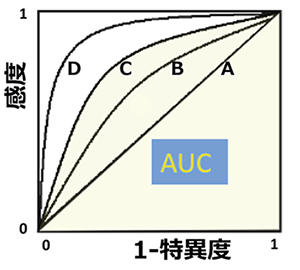
- (注5)ROC曲線, AUC値
- ROC曲線(Receiver Operating Characteristic curve)は、もともとレーダーシステムの通信工学理論として開発されたものであるが、臨床研究では、しばしば診断検査の有用性を検討する手法として利用されている。具体的には、ROC曲線は縦軸に陽性率(=感度)、横軸に偽陽性率(=(1-特異度))をプロットして線で結んだものであり、AUCはArea under the curve の略で曲線下の面積を示しており0.5-1.0の値を取る(下図)。
診断用検査の結果判定において、感度が上がるようにカットオフ値を低く設定すると特異度は下がるので、感度と特異度は相殺する。ROC曲線において、全く診断能がなく結果がランダムな検査の場合には下図のAのように対角線となりAUC値は0.5であり、感度・特異度ともに高い場合にはROC曲線は左上方に位置することになりAUCは1に近い値を取る。一般的には、このAUC値の大きさにより検査の診断能の優劣を判定する(下図での診断能はA<B<C<D)。
お問い合わせ先
研究について
京都府立医科大学 分子脳病態解析学
徳田 隆彦(とくだ たかひこ)
TEL:075-251-5793 FAX:075-211-8645
その他:大学広報部門
京都府立医科大学 企画・研究支援課
土屋 ちひろ
TEL:075-251-5804 FAX:075-251-5275
AMED事業に関すること
日本医療研究開発機構 戦略推進部 難病研究課
TEL:03-6870-2223 FAX:03-6870-2243
E-mail:nambyo-info“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和元年11月12日
最終更新日 令和元年11月12日


