プレスリリース 分子ナノシステムの設計から筋収縮の原理を解明―心筋症における精密医療への応用に期待―
プレスリリース
理化学研究所
日本医療研究開発機構
理化学研究所(理研)生命機能科学研究センター細胞動態計測研究チームの藤田恵介基礎科学特別研究員、大町優史研究員、岩城光宏副チームリーダー、柳田敏雄チームリーダーらの共同研究チーム※は、筋収縮の機能単位であるサルコメア[1]構造の一部となる分子ナノシステムを設計し、収縮中のモーター分子[2]の動態を世界最高の解像度で直視することに成功しました。
本研究成果は、直接的にモーター分子の機能を制御する低分子化合物の効果を精密に分析することを可能にし、新たな心不全治療薬の開発に貢献すると期待できます。
筋収縮の分子機構に関する研究は70年以上の歴史がありますが、収縮の瞬間におけるモーター分子の動態を直接的に捉えることはできていませんでした。
今回、共同研究チームは、DNAオリガミ技術[3]とヒト筋肉のモータータンパク質[2](ミオシンII[4])を用いて、サルコメアの一部(分子ナノシステム)を人工的に設計し、高速原子間力顕微鏡(高速AFM)[5]による画像化とレーザー暗視野顕微鏡[6]による超高速観察を行いました。サルコメア構造が厳密に再現された空間内で、ミオシンII分子がブラウニアンラチェット機構[7]によって収縮に最適となる場所の探索を行い、2段階の可逆的な構造変化を経て力が発生している瞬間を画像化しました。
本研究は、英国のオンライン科学雑誌『Communications Biology』(11月27日付)に掲載されます。
- ※共同研究チーム
-
- 理化学研究所 生命機能科学研究センター 細胞動態計測研究チーム
- チームリーダー 柳田 敏雄(やなぎだ としお)
- 副チームリーダー 岩城 光宏(いわき みつひろ)
- 基礎科学特別研究員 藤田 恵介(ふじた けいすけ)
- 研究員 大町 優史(おおまち まさし)
- 東京大学 理学部 物理学科
- 助教 池崎 圭吾(いけざき けいご)
- ※研究支援
- 本研究は、日本医療研究開発機構(AMED)革新的先端研究開発支援事業「メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出(研究開発統括:曽我部正博)」における「DNAナノバイオデバイスを用いた心筋細胞の力場イメージングと光制御技術の開発(代表者:岩城光宏)」による支援を受けて行われました。
背景
肥大型心筋症[8]は500人に1人の割合で発症する心臓の病気であり、心機能低下と若年性突然死などを引き起こすことが知られています注1)。その発症には遺伝的な要因が大きく、なかでも心臓を拍動させるモータータンパク質であるミオシンII(以下、ミオシン)の変異が主要な原因となっていることが分かってきました。そのため、直接的にミオシンの機能を正常に戻す低分子化合物の開発が盛んに行われており、心不全治療への応用が期待されています。
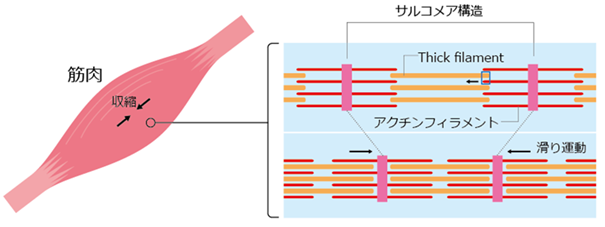
こうした化合物を開発するには、収縮の瞬間におけるモーター分子の動態を調べる必要があります。筋肉は、サルコメアと呼ばれる構造の中で、ミオシンが集団になったフィラメント(thick filament)とアクチンフィラメント[9]が平行になり、互いに滑りあうことで収縮します(図1)。サルコメア内ではミオシンが“稲穂の米粒”のように密に詰まっており、しかも個々のミオシンは揺らぎながら非常に速く運動した後、すぐにアクチンから外れてしまいます。そのため、従来の一分子解析法[10]ではミオシンの個々の分子の動きを直接捉えることができず、アクチンの動きから間接的にミオシンの動きを推定していました。
しかし従来法では、分子レベルで直接的かつ詳細に観察・画像化することが難しく、治療薬の候補となる化合物の効果を精密に調べることに大きな制約がありました。そこで、共同研究チームは、収縮時にミオシンの構造変化が起こり力を発生する瞬間を、これまでにない解像度で直接観察するための技術開発を試みました。
注1)James A. Spudich. Hypertrophic and Dilated Cardiomyopathy: Four Decades of Basic Research on Muscle Lead to Potential Therapeutic Approaches to These Devastating Genetic Diseases. Biophysical Journal Volume 106 March 2014 1236–1249
研究手法と成果
今回、共同研究チームは、DNAオリガミ技術で作成した足場とヒト筋肉のミオシンを用いて、モータータンパク質のミオシン分子を天然の状態と同じように厳密に配置しつつ、その密度を調整できるナノシステム(人工thick filament)を設計しました(図2)。
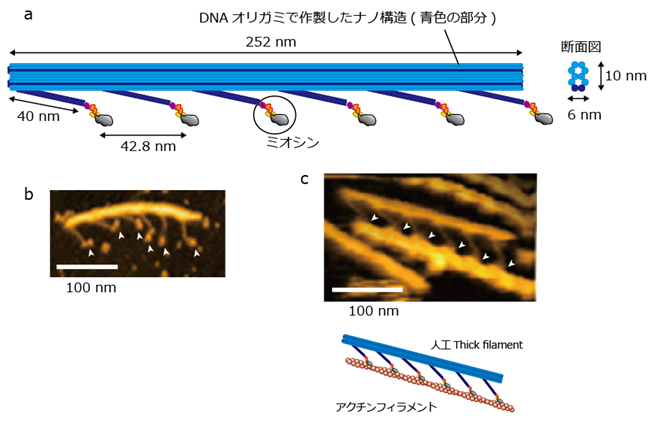
b)高速原子間力顕微鏡(高速AFM)で観察した人工thick filament。白矢頭はミオシンを示す。
c)アクチンフィラメントに結合した人工thick filament。上が高速AFMでの観察(白矢頭はミオシン分子)、下は模式図を示す。天然のサルコメアで観察された構造と同じものが再現できたことが分かる。
これにより、人工thick filamentに沿ってアクチンフィラメントが滑るときの筋肉ミオシンの分子形状を、高解像度で画像化することに世界で初めて成功しました(図3)。ミオシンの「レバーアーム」と呼ばれる部位が収縮時に2段階で構造変化を起こし力が発生することで、十分な収縮が引き起こされます(図3b)。しかし、レバーアームがthick filament内の別のミオシンの影響を受け、1段階目の構造変化によって力が発生し停止したまま運動を終了したり(収縮)、1段階目の力が発生した後に逆方向に構造変化し、力が発生する前の構造に戻り(弛緩)、再度、構造変化を起こして力が発生したりする(収縮)(図3c)など、柔軟なダイナミクスを持ちながら収縮を引き起こしていることが分かりました。
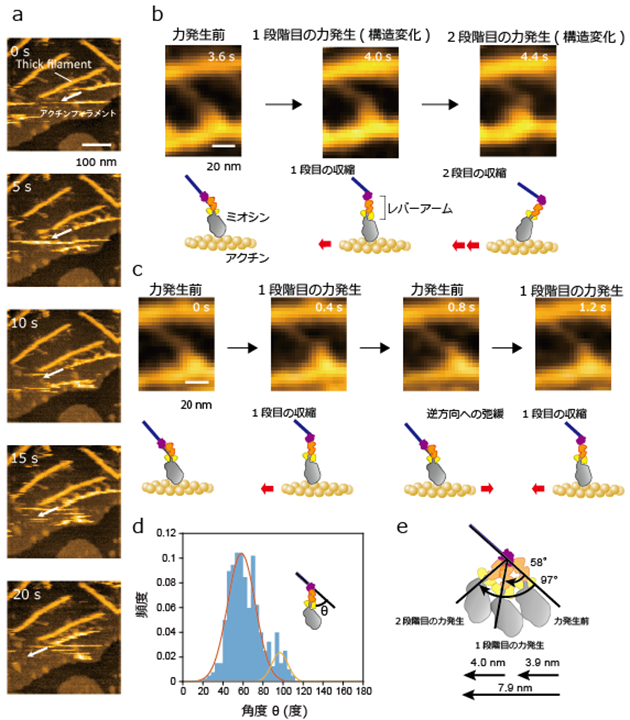
b)ミオシンの2段階の構造変化を捉えた高速AFM像。レバーアームの左方向への構造変化に合わせて、アクチンの滑り運動(収縮)が起こる。
c)1段目の力発生(収縮)後に、レバーアームが逆方向(右方向)に構造変化し、力発生前の状態に戻り、アクチンが弛緩する。その後、再度1段目の力発生が起こり、アクチンが収縮する。
d)レバーアームの角度の分布。20~110度の範囲で構造変化を起こした。
ミオシンの力発生時に起こる角度と収縮の動き。これらの微小で柔軟な変位が積み重なって、筋収縮が起こる。
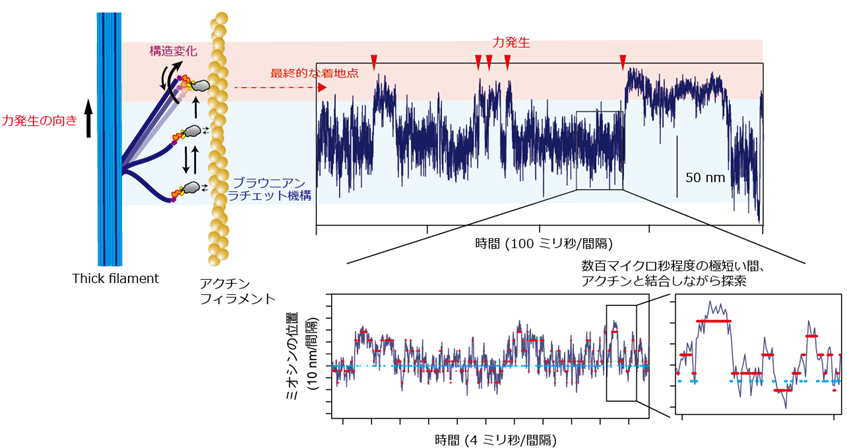
次に、人工thick filamentの一部に、アクチンと安定な結合を保持するタンパク質を導入することで、ミオシンがアクチンから外れにくい状態を作れるよう設計しました。そして、レーザー暗視野顕微鏡と高速撮影カメラを用いて、収縮の瞬間におけるミオシン分子の動きを世界最高の時間分解能で直接的に捉えることに成功しました。マイクロ秒(100万分の1秒)の時間分解能で動きを捉えると、ミオシン分子がアクチンフィラメントに沿ってランダムに動きながら、収縮に必要な構造変化を起こすための最適な場所を探索しているのが分かりました。また、ランダムな動きから方向性を持って最終的な着地点を選んでおり、「ブラウニアンラチェットと呼ばれる機構」が働いていることも分かりました(図4)。
今後の期待
筋収縮の瞬間においてミオシン分子の構造変化が起こり力を発生する全ての過程を、直接的に画像化できたのは、70年以上の筋研究の歴史の中でも初めてであり、今後、肥大型心筋症を引き起こすミオシン変異体の分子レベルでの診断について、詳細に行うことが可能になると期待できます。
肥大型心筋症の症状を改善させる従来の心不全治療薬は、アドレナリン受容体などをターゲットにしたカルシウム動員性強心薬[11]であり、原因となるミオシンの機能不全を直接的に改善するものではないため、副作用が生じます。そこで、直接的にミオシンの運動機能を改善させるための低分子化合物の開発が活発化してきています。今回の研究によって、収縮時に構造変化が起こり力を発生する過程で、候補となる化合物がどのプロセスにどの程度効くのか直接的に解析できるようになるため、個別の遺伝的な変異に対するミオシンの機能の改善を精密に評価できると期待できます。
また、医療応用とは別に、今回開発したモーター分子に関するナノシステムの設計技術と、その動態のナノレベルでの解析技術は、人工筋肉やナノアクチュエータ[12]の開発、メカノバイオロジー[13]にも大きく貢献すると期待できます。
論文情報
- タイトル
- Direct visualization of human myosin II force generation using DNA origami-based thick filaments
- 著者名
- Keisuke Fujita, Masashi Ohmachi, Keigo Ikezaki, Toshio Yanagida, Mitsuhiro Iwaki
- 雑誌
- Communications Biology
補足説明
- [1]サルコメア
- 筋繊維をミクロのスケールで観察したときに見られる、筋収縮の最小機能単位の構造。モーター分子であるミオシンのフィラメントと細胞骨格であるアクチンのフィラメントが平行に並び、各々の分子が結晶のように整然と配置された構造を持つ。
- [2]モーター分子、モータータンパク質
- アデノシン三リン酸(ATP)を加水分解する際に得られる化学エネルギーを力学エネルギーに変換する分子(タンパク質)の総称。
- [3]DNAオリガミ技術
- DNAを材料にして折り紙のように折りたたむことで、思い通りの2次元または3次元のナノ構造物を作り上げる技術。DNAナノテクノロジーの一種。
- [4]ミオシンII
- 筋肉中でATPの加水分解を行い、そのときに得られる化学エネルギーを機械的な運動に変換するモータータンパク質。
- [5]高速原子間力顕微鏡(高速AFM)
- カンチレバーと呼ばれる微細な針で、マイカなどの平坦性の高い基板上に張り付けたタンパク質をスキャンし、分子の凹凸を画像化する顕微鏡。1枚の画像化を数百ミリ秒で行うことができる。AFMはAtomic Force Microscopeの略。
- [6]レーザー暗視野顕微鏡
- ミオシンにラベルした金ナノ粒子などに、レーザーを照射し出てくる散乱光を観察するための顕微鏡。強い散乱光を発するため、高速撮影カメラにて速い現象を撮影することができる。
- [7]ブラウニアンラチェット機構
- 水溶液中を漂うナノサイズの粒子が、周囲の水分子の衝突によってランダムに揺り動かされる現象をブラウン運動と呼び、そのランダムな運動から方向性を取り出すための機構をブラウニアンラチェットと呼ぶ。
- [8]肥大型心筋症
- 心室の壁が厚くなって硬くなることで、心機能が低下する心疾患。主に遺伝的な異常によって引き起こされる。
- [9]アクチンフィラメント
- アクチンとは細胞骨格タンパク質の一つ。単量体のG-アクチンが重合して繊維状アクチン(F-アクチン)を形成する。
- [10]一分子解析法
- タンパク質一分子の動きや力を解析する手法。特殊な顕微鏡を用いて蛍光分子1個を検出する一分子蛍光イメージング法やレーザー光を用いて生体分子を捕捉する光ピンセット法など。
- [11]カルシウム動員性強心薬
- アドレナリン受容体を刺激し細胞内のcAMPを上昇させPKA(Aキナーゼ)の活性化を引き起こすことで、心筋細胞内のカルシウム濃度を上げて強心作用を得る薬のこと。
- [12]アクチュエータ
- 外界から得たエネルギー(電力・磁力・圧力・温度など)を、伸縮・屈曲・回転などの運動に変換する装置や物質のこと。
- [13]メカノバイオロジー
- 生体における“力”の役割と仕組みを解明して、発生やがん、再生医療などの臨床的課題の解決を目指す分野。
発表者・機関窓口
発表者
理化学研究所 生命機能科学研究センター 細胞動態計測研究チーム
基礎特別研究員 藤田 恵介(ふじた けいすけ)
研究員 大町 優史(おおまち まさし)
副チームリーダー 岩城 光宏(いわき みつひろ)
チームリーダー 柳田 敏雄(やなぎだ としお)
機関窓口
理化学研究所 生命機能科学研究センター センター長室 報道担当
山岸 敦(やまぎし あつし)
TEL:078-304-7138 FAX:078-304-7112
E-mail:ayamagishi[at]riken.jp
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
E-mail:ex-press[at]riken.jp
AMED事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
TEL:03-6870-2224 FAX:03-6870-2246
E-mail:kenkyuk-ask[at]amed.go.jp
※上記の[at]は@に置き換えてください。
掲載日 令和元年11月27日
最終更新日 令和元年11月27日


