本邦におけるリー(Leigh)脳症の予後調査に関する研究成果の発表について
プレスリリース
千葉県こども病院
千葉県がんセンター(研究所)
国立研究開発法人日本医療研究開発機構
千葉県こども病院遺伝診療センター・代謝科/千葉県がんセンター研究所の研究グループは、日本医療研究開発機構(AMED)のサポートのもと、ミトコンドリア病に関する研究を行ってきました。この度、埼玉医科大学、順天堂大学、日本大学と共同で、日本人のリー脳症患者166名の分子遺伝学的な特徴と予後について分析を行い、その研究成果が論文誌『Journal of Inherited Metabolic Disease(JIMD)』に掲載されましたので、ご報告いたします。
概要
ミトコンドリア病は5000人に1人の頻度で発症するエネルギー代謝系の先天代謝異常症です。リー脳症は小児期に発症するミトコンドリア病としては最多の病型を示すものであり、その多くが早期に死亡するといわれています。原因遺伝子は、ミトコンドリア遺伝子だけでなく核遺伝子など多岐にわたります。しかしながら、これまで本邦におけるリー脳症の長期的な予後は全く明らかになっていませんでした。
我々は、村山らのグループによって構築された診断システム・レジストリシステムを用いて、2007年から2017年までに診断されたリー脳症の日本人166例を対象にした予後と分子遺伝学的な特徴の関係について分析を行いました。分析の結果、全体の約75%が生存しており、生存症例の年齢の中央値は8歳(1~39歳まで分布)でした。罹病期間の中央値は、生存症例で91ヶ月、死亡症例で23.5ヶ月であり、死亡症例の約90%が6歳までに亡くなっていました。生後6ヶ月未満の発症例は、生後6ヶ月以降の発症例と比較して有意に死亡率が高いことが明らかになりました。新生児期に発症した全症例が、死亡もしくは寝たきりになっていました。また、原因遺伝子ごとに検討すると、ミトコンドリア遺伝子であるMT-ATP6(m.8993T>G)、 MT-ND5の変異をもつ症例では予後が悪く、核遺伝子であるNDUFAF6, ECHS1, SURF1の変異をもつ症例は比較的軽症で、予後が良い傾向が確認されました。また、原因遺伝子ごとに発症年齢に違いがあり、NDUFAF6変異の症例では発症年齢が遅いほど、予後が比較的に良いことも分かりました。
今回の研究により、日本人のリー脳症における原因遺伝子ごとの詳細な自然歴について、初めて明らかになりました。この研究成果は、本症の治療薬の開発や国内外の臨床治験の推進に大きく貢献するものと期待されます。
※当該研究は、国立研究開発法人日本医療研究開発機構(AMED)「難治性疾患実用化研究事業」の研究費を用いて行われました。
内容
リー(Leigh)脳症は、小児期に発症するミトコンドリア病※1の代表的な病型の一つです。乳幼児期に発症し、精神運動の発達の遅れや退行(それまでできていたことができなくなること)を示す難治性の慢性進行性の疾患です。予後は不良で、発症後に数年で死亡するとされています。
村山らのグループは、3年前に我が国のリー脳症106例の遺伝学的・生化学的な特徴を明らかにしました。その後、新たに診断された症例などを加え、今回、2007年から2017年までに診断されたリー脳症166例の診断後の現況(2018年4月現在)を調べることにより、我が国のリー脳症の予後に関する報告を取りまとめました。
166例のうち、調査時点で生存していた例は124例であり、死亡例が40例、追跡不能が2例でした(表)。生存例124例を調査した時点における年齢は、中央値が8歳であり1歳から39歳まで分布していました。発症から調査時点または死亡時点までの罹病期間の中央値は、生存例で91か月、死亡例で23.5か月でした。死亡例40例の9割が6歳までに亡くなっていました。生後6か月未満で発症した場合、生後6か月以降に発症した症例と比較して有意に生存率が低く、特に新生児期に発症した例は、全例が死亡または寝たきりでした。原因遺伝子と予後について原因遺伝子の変異が分かっている103例について分析した結果、ミトコンドリア遺伝子※2のMT-ATP6遺伝子(m.8993T>G変異)やMT-ND5遺伝子の変異によるリー脳症は予後が不良である一方で、核遺伝子※3のECHS1遺伝子やSURF1遺伝子、NDUFAF6遺伝子の変異によるリー脳症の予後は比較的良いことが分かりました。発症時期が予後にもたらす影響は、原因遺伝子によっても異なることが分かりました。生存例の臨床症状は多くの場合に重篤でしたが、その中には自発呼吸を維持し、経口摂取が可能で、歩行できる例もあることが分かりました。
本報告は我が国で初めて取りまとめられたリー脳症の予後に関する大規模な報告であり、治療薬の開発や臨床試験に必要な基礎的エビデンスを提供するものです。本研究結果は、先天代謝異常分野で最も権威ある科学雑誌『Journal of Inherited Metabolic Disease』に掲載されました。
対象・方法
2007年~2017年に診断した166例のリー脳症を対象に、2018年4月時点での現況を調べました。
結果
166例のうち、生存が124例、死亡が40例、追跡不能が2例でした(表)。
| 全体 | 166 |
|---|---|
| 生存 | 124 |
| 死亡 | 40 |
| 追跡不能 | 2 |
| 遺伝子異常 | 103 |
| 核遺伝子異常 | 49 |
| ミトコンドリア遺伝子異常 | 54 |
| ミトコンドリア呼吸鎖複合体※4の活性低下 | 98 |
| Complex I | 49 |
| Complex IV | 21 |
| Compound complex | 25 |
124例の調査時点の年齢は、中央値が8歳であり、1歳から39歳まで分布していました(図1)。
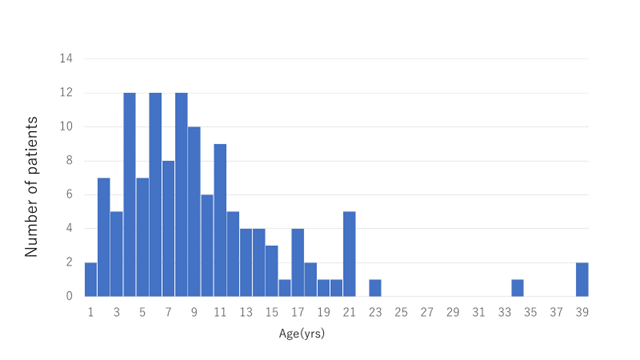
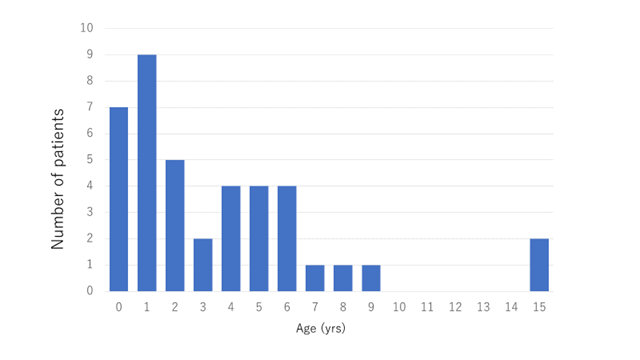
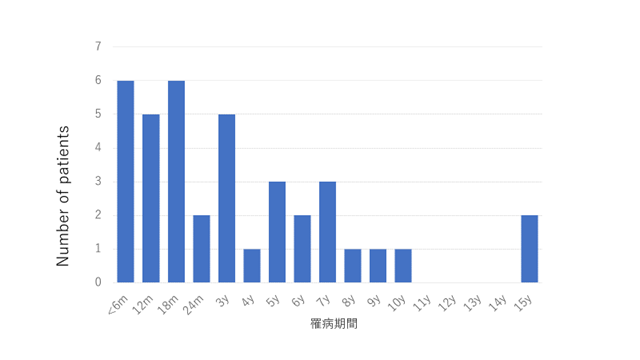
死亡時の年齢は、中央値が31.5か月であり、最も多くの患者が1歳台に亡くなっており、9割近くの患者が6歳までに亡くなっていました(図2a)。発症から死亡までの期間(罹病期間)の中央値は23.5か月でした(図2b)。
全体の生存曲線は図3aに示すとおりであり、我が国のリー脳症患者の15歳時点の生存率は約7割と推計されました。
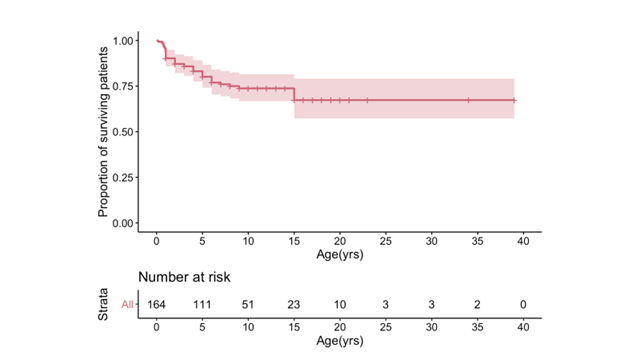
生存率は発症時期により異なり、生後6か月未満で発症した症例(early)は、生後6か月以降に発症した症例(late)に比較し、有意に生存率が低いことが確かめられました(p<0.0001)(図3b)。
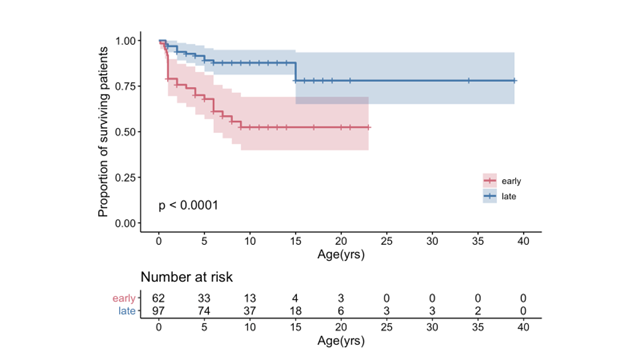
リー脳症は、乳幼児期に発症するとされていますが、発症時期を遺伝子別にみると、図4に示すとおり、ほとんどの症例が乳児期の早期に発症する遺伝子変異もあれば、時期にある程度の幅をもって発症する遺伝子変異もあることが分かりました(図4)。
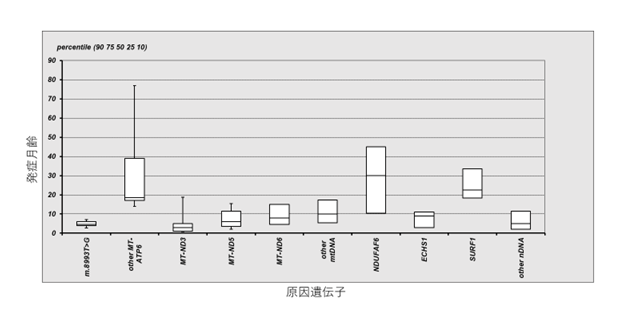
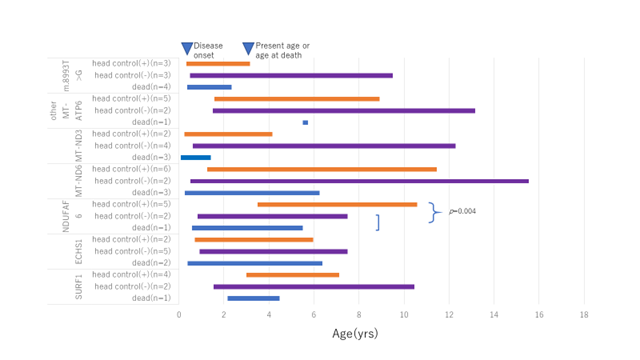
更に、発症時期が予後に与える影響は、遺伝子ごとに異なり、発症時期のばらつきが小さい原因遺伝子の場合は、発症時期によりその予後を予測することは困難でしたが、発症時期のばらつきが大きいNDUFAF6遺伝子変異の場合は、発症時期が遅いほど予後が良いことが分かりました。
まとめ
今回、我が国のリー脳症の予後について、初めて大規模な取りまとめを行いました。リー脳症は非常に重篤な疾患ですが、今回、原因遺伝子や発症時期によりその予後が異なることが示されたことから、個々の患者の診療にあたり、できるだけ速やかに遺伝子レベルまで診断を確定することが、より重要になってくると思われます。また、今回得られた知見は、今後の新たな治療薬の開発や既に行われている臨床試験に必要な基礎的エビデンスを提供するものであり、国内のみならず国際的にも広く共有されていくものであると考えます。
本研究に係わる学会発表
E Ogawa, Y Okazaki,I Morioka, A Ohtake, K Murayama, et al. Mortality of Japanese patients with Leigh syndrome: A follow-up survey. ASMRM, 2019, Oct 3-5, Fukuoka, Japan.
用語解説
- ※1 ミトコンドリア病
- ミトコンドリア病とは、ミトコンドリアの働きが低下することが原因で起こる病気の総称であり、エネルギー代謝系の先天代謝異常症です。出生 5,000人に 1人の割合で発症し、あらゆる臓器・組織においてさまざまな症状を呈し、何歳でも発症します。常染色体劣性遺伝、伴性劣性遺伝、ミトコンドリア遺伝(母系遺伝)など、いかなる遺伝形式でも発病します。特に幼少時期に発症する症例は、症状が多様で重篤致死となる症例も多いとされています。また、現在は根治的治療法がなく、対症療法による治療が行われます。
- ※2 ミトコンドリア遺伝子
- ミトコンドリアは、ミトコンドリア内にあるDNA(ミトコンドリアDNA)と細胞核にある核DNAによる二重支配を受けています。ミトコンドリアDNAがコードする遺伝子をミトコンドリア遺伝子といいます。ミトコンドリアDNAは16,569塩基対を有し、13個の呼吸鎖のサブユニットを含む37個の遺伝子をコードします。各ミトコンドリアには2~10コピーのミトコンドリアDNAがあります。
- ※3 核遺伝子
- ミトコンドリアは、ミトコンドリアDNAと細胞核にある核DNAによる二重支配を受けているため、ミトコンドリア病は、核遺伝子の異常によっても発症します。現在、ミトコンドリア病の原因として約300の核遺伝子の異常が知られており、新たな原因核遺伝子が次々に報告されています。
- ※4 ミトコンドリア呼吸鎖複合体
- ミトコンドリアではエネルギー源であるATP を合成しており、ミトコンドリア呼吸鎖複合体(Complex)のI~V までがその合成に関わっています。Complex I~IV は、酸化還元反応を利用し、ミトコンドリア内膜を介してプロトン(H+)を輸送します。ComplexⅤは逆向きのプロトンの流れを利用して、ATPを作り出します。
本件に関するお問い合わせ先
千葉県こども病院
事務局医事経営課
Tel:043-292-2111
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構
戦略推進部 難病研究課
Tel:03-6870-2223
E-mail:nambyo-info"AT"amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年2月6日
最終更新日 令和2年2月6日


