プレスリリース 自己免疫疾患の発症を防ぐ新たなタンパク質を特定―クロマチン制御因子Chd4は自己抗原の発現を制御し、自己免疫疾患の発症を防ぐ―
プレスリリース
東京大学
日本医療研究開発機構
発表者
友藤 嘉彦(東京大学大学院医学系研究科 病因・病理学専攻 免疫学講座免疫学分野医学部医学科6年生;研究当時)
高場 啓之(東京大学大学院医学系研究科 病因・病理学専攻 免疫学講座免疫学分野 助教)
高柳 広(東京大学大学院医学系研究科 病因・病理学専攻 免疫学講座免疫学分野 教授)
発表のポイント
- クロマチン制御因子Chd4は、自己免疫疾患に関わる自己抗原の発現を制御するタンパク質であることを明らかにしました。
- 次世代シーケンサーデータの統合解析により、Chd4はこれまで報告されてきた自己抗原を誘導するタンパク質Fezf2とAireの双方へ働きかけることを明らかにしました。
- 自己免疫疾患の発症をChd4が防いでいることを明らかにし、免疫寛容という免疫システムの根源的なメカニズムの一端を解明しました。
発表概要
免疫系は、病原体から我々の身体を守るシステムです。T細胞は免疫系において中心的な役割を担っている細胞集団であり、我々の体内に進入してきた病原体を攻撃します。一方で、T細胞は“自己を攻撃しない”性質も持っており、この性質は免疫寛容と呼ばれています。T細胞は胸腺という臓器でつくられますが、胸腺では、 末梢組織で機能している多種多様なタンパク質が自己抗原として異所的に発現しており、これらに強く反応する自己反応性T細胞が予め胸腺内で除去されることにより免疫寛容が維持されています。
東京大学大学院医学系研究科病因・病理学専攻免疫学の友藤 嘉彦(医学部医学科;研究当時)、高場 啓之 助教、高柳 広 教授らの研究グループは、胸腺において、末梢組織自己抗原の発現を制御するクロマチン制御因子Chd4を同定しました。研究グループは、胸腺上皮細胞でのみChd4を欠損する遺伝子改変マウスを作成し、胸腺の遺伝子発現パターンやクロマチン構造について検討しました。その結果、Chd4はプロモーター領域(注1)、スーパーエンハンサー領域(注2)の二領域のクロマチン構造を制御することによって、末梢組織自己抗原の遺伝子発現を制御していました。また、胸腺でChd4を欠損させたマウスは自己免疫疾患を発症しました。以上の結果から、Chd4が末梢組織自己抗原の発現制御を行い、免疫寛容を維持していることがわかりました。
この研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「組織修復型免疫細胞の解明とその制御による疾患治療の開発」(研究開発代表者:高柳 広)の一環として行われました。
本研究成果は日本時間6月30日にNature Immunology(オンライン版)にて発表されました。
発表内容
研究の背景
T細胞は免疫系の中で中心的な役割を担っているリンパ球であり、細胞ごとに独自のT細胞受容体(TCR: T cell receptor)を持つことを特徴としています。T細胞はTCRを介して抗原ペプチドと主要組織適合遺伝子複合体(MHC: major histocompatibility complex)(注3)を認識し、抗原特異的な免疫反応を引き起こします。TCRは胸腺内において、ランダムな遺伝子組み換えによって創出され、その種類は一個人あたり、およそ10の18乗にも上ると推定されています。T細胞はこの多様性ゆえに、多種多様な病原体を認識して免疫反応を起こすことになりますが、一方で、TCRがランダムな遺伝子組み換えによって創出されるがゆえに、しばしば自己を認識するTCRを持つ自己反応性T細胞ができてしまいます。そのような自己反応性T細胞が胸腺外へ出ていくと自己に対して免疫反応を起こしてしまうので、胸腺内において自己抗原を強く認識した自己反応性T細胞には細胞死が誘導されます。このT細胞の選別過程において胸腺髄質上皮細胞(mTEC: medullary thymic epithelial cell)が重要な役割を果たすことが知られており、mTECは全身のさまざまな組織で機能しているタンパク質を“末梢組織自己抗原”として異所的に発現させることで、自己反応性T細胞を効率的に取り除いています。
mTECにおいて末梢組織自己抗原の発現を制御する分子として、2002年に転写制御因子Aireが発見されました。一方で、Aire非依存的に発現している末梢組織自己抗原の存在が報告されており、Aire以外にもmTECにおいて末梢組織自己抗原の発現制御を行っている分子があるのではないかと考えられました。2015年に発表者らはAireとは独立して末梢組織自己抗原の発現制御を行う転写因子Fezf2を見出しました(Takaba et al., Cell)。当時行った遺伝子発現プロファイル解析の結果から、Fezf2とAireが異なる末梢組織自己抗原遺伝子の発現制御に関与していることが明らかとなりましたが、それぞれの因子が遺伝子発現を制御する分子メカニズムの違いについてはわかっておらず、mTECにおける末梢組織自己抗原遺伝子の発現制御機構の全貌は明らかになっていませんでした。
研究結果の概要
本研究グループは先ず、Fezf2を欠損させた遺伝子改変マウスと、Aireを欠損させた遺伝子改変マウスのmTECを使ってRNA-seq(注4)を行い、Fezf2により制御される遺伝子とAireにより制御される遺伝子とが異なることを確認しました。次に、その遺伝子リストを公共データベース上のエピジェネティクス情報(ChIP-seq, ATAC-seq)(注5, 6)や一細胞RNA-seqのデータと統合して横断的オミクス解析を行いました。その結果、Fezf2により発現制御される遺伝子は、Aireにより発現制御される遺伝子よりも、活性化型クロマチン修飾に富んでおり、mTECでのmRNAの発現量が高いことがわかりました。このことから、Fezf2による遺伝子発現制御とAireによる遺伝子発現制御の間には、エピジェネティックレベルで異なることが明らかとなりました。
そこで、Fezf2と協調的に働くエピジェネティック制御分子を探索するため、本研究グループは、Flagタグ(注7)をつけたFezf2タンパク質を培養細胞株に大量発現させて、免疫沈降-質量分析法(注8)を行いました。その結果、Fezf2と結合するクロマチンリモデリング分子Chd4を同定しました。さらに、実際にmTECにおいてFezf2とChd4が相互作用しているかどうかを調べるために、Flagタグ付きのFezf2を発現する遺伝子改変マウス(Flag-Fezf2 マウス)を、CRISPR/Cas9法(注9)を用いて作成しました。Flag-Fezf2マウスの胸腺を使って、免疫沈降-ウエスタンブロット法(注10)を行ったところ、Fezf2とChd4の相互作用が確認され、Fezf2はNuRD複合体(注11)を形成していることが明らかなりました。
次に、mTECでChd4を欠損する遺伝子改変マウス(Chd4 cKOマウス)を作成し、mTECの遺伝子発現プロファイル(RNA-seq)とクロマチンの状態(ATAC-seq)について検討しました。その結果、Fezf2とChd4が協調的にプロモーター領域近傍のクロマチン構造を制御し、末梢組織自己抗原遺伝子の発現制御を行っていることがわかりました(図1A)。一方、予想外なことに、Chd4とAireは、直接相互作用をしていないのにもかかわらず、協調的にスーパーエンハンサーのクロマチン構造を制御し、末梢組織自己抗原遺伝子の発現制御を行っていることが明らかとなりました(図1B)。すなわちChd4は、Fezf2とAireという2つの異なる転写制御因子に働きかけ、異なる遺伝子サブセットの発現制御に関わっていることが明らかとなりました。mTECでChd4を欠損するマウスではmTECにおける末梢組織自己抗原の発現に異常が起きるため、胸腺での自己反応性T細胞の除去が妨げられることが予想されましたが、実際にChd4 cKOマウスの臓器ではT細胞の浸潤などの自己免疫疾患様症状が観察され、免疫寛容の破綻が起きていると考えられました(図1C)。
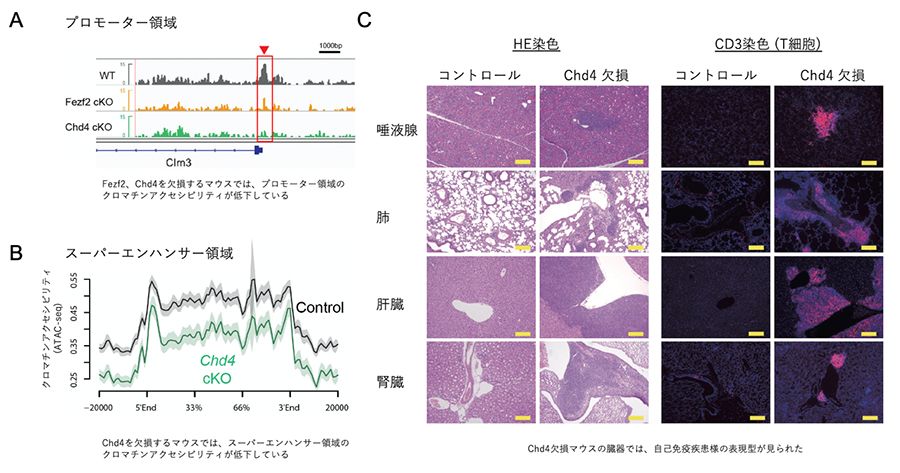
B:Chd4を欠損するマウスのmTECを用いてATAC-seq解析を行ったところ、スーパーエンハンサー領域でクロマチンアクセシビリティの低下が見られ、Chd4はスーパーエンハンサー領域を介してAireによって制御される末梢組織自己抗原遺伝子の発現制御も行っていることが示唆されました。
C:胸腺上皮細胞特異的Chd4欠損マウスでは、野生型マウス(コントロール)と比較して、炎症性細胞の浸潤(左)やT細胞の浸潤(右)が見られました。
研究成果の意義
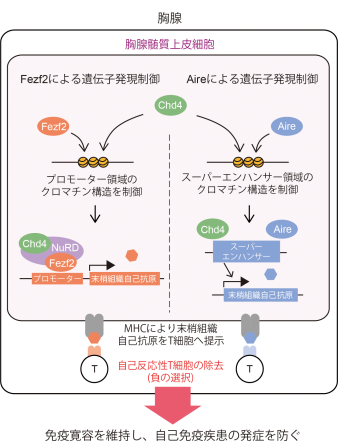
本研究により、mTECにおいてFezf2の発現制御下にある末梢組織自己抗原とAireの発現制御下にある末梢組織自己抗原とが、異なる発現パターンとエピジェネティック修飾を持つことが明らかになりました。またmTECのChd4は、Fezf2とAireという2つの異なる転写制御因子と協調的に働くことによって、多様な末梢組織自己抗原の遺伝子発現を制御し、自己免疫疾患の発症を防いでいることが明らかとなりました(図2)。Chd4による発現制御を受ける遺伝子の中には、全身性エリテマトーデス(注12)などの自己免疫疾患における自己抗原が含まれており、Chd4依存的な自己抗原と自己免疫疾患との関連が示唆されました。本研究成果によって、胸腺内における自己反応性T細胞の除去機構、並びに自己免疫疾患の発症機序についての理解が進み、新たな診断・治療技術の開発につながると期待されます。
発表雑誌
- 雑誌名:
- 「Nature Immunology」(オンライン版:6月30日)
- 論文タイトル:
- Chd4 choreographs self-antigen expression for central immune tolerance
- 著者:
- Yoshihiko Tomofuji, Hiroyuki Takaba, Hiroshi I. Suzuki, Rayene Benlaribi, Cristian David Peña Martinez, Yoshihiro Abe, Yasuyuki Morishita, Tadashi Okamura, Akashi Taguchi, Tatsuhiko Kodama, and Hiroshi Takayanagi *
- DOI番号:
- 10.1038/s41590-020-0717-2
- アブストラクトURL:
- https://www.nature.com/articles/s41590-020-0717-2
用語解説
- (注1)プロモーター領域:
- 遺伝子をコードする領域の上流に存在し、その遺伝子の転写開始・停止を調節する配列を含む領域のこと。
- (注2)スーパーエンハンサー領域:
- 巨大なエンハンサー領域であり、H3K27acなどの活性化ヒストン修飾に対するChIP-seq解析などによって定義される。細胞種特異的遺伝子や疾患関連遺伝子の発現制御に関与していると報告されている。
- (注3)主要組織適合遺伝子複合体(MHC: major histocompatibility complex):
- 細胞表面に存在する細胞膜貫通型の糖タンパク質。さまざまなタンパク質の断片(ペプチド)を細胞表面に提示する働きをもつ。
- (注4)RNA-seq: 細胞の中のmRNAの配列を網羅的に解読し、発現量の定量などを行う手法。
- (注5)ChIP-seq:
- ヒストンなどの特定の分子を認識する抗体を用いて、目的の分子を含む複合体を混合物中から選択的に分離(免疫沈降)し、その中からDNA断片を抽出して、配列を網羅的に解読し、定量する方法。ヒストンメチル化などのエピジェネティックな修飾をゲノムワイドに調べることができる。
- (注6)ATAC-seq:
- クロマチンのアクセシビリティをゲノムワイドに評価する方法。オープンクロマチン領域を網羅的に同定することができる。
- (注7)Flagタグ:
- 人工的なポリペプチド標識。目的のタンパク質に組み込むことによって、Flagタグに対する抗体をつかって、目的のタンパク質を検出することができる。
- (注8)免疫沈降-質量分析法:
- 免疫沈降で回収した複数タンパク質を、質量分析法によって網羅的に同定する手法。
- (注9)CRISPR/Cas9法:
- 細菌由来のDNA切断酵素Cas9と人工的に作成したガイドRNAを用いることで、ゲノム配列の任意の場所を削除、置換、挿入することができる遺伝子改変技術。
- (注10)免疫沈降-ウエスタンブロット法:
- 免疫沈降で回収したタンパク質を電気泳動によって分離、膜に転写し、目的のタンパク質に対する抗体を用いてそのタンパク質の存在を検出する手法。
- (注11)NuRD複合体:
- クロマチンリモデリング分子Chd4やヒストン脱アセチル化酵素HDAC1/2などによって構成されるタンパク質複合体。クロマチン構造の制御において重要な役割を担っていることが知られている。
- (注12)全身性エリテマトーデス:
- 若年女性に好発する、原因不明の自己免疫疾患であり、多様な自己抗体の出現や多彩な臓器障害(腎臓障害、中枢神経障害、心臓障害など)を特徴とする。
お問い合わせ先
教授 高柳 広(たかやなぎ ひろし)
TEL:03-5841-3373
FAX:03-5841-3450
E-mail:takayana"AT"m.u-tokyo.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課
TEL:03-6870-2224
E-mail:[email protected]
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年6月30日
最終更新日 令和2年6月30日


