プレスリリース 腫瘍組織における血管内皮細胞からの因子により、がんが進展するしくみを解明―がん微小環境ネットワークシグナルを標的とした新規治療法の開発に期待―
プレスリリース
国立大学法人東京医科歯科大学
国立研究開発法人日本医療研究開発機構
ポイント
- 血管内皮細胞由来のがん関連線維芽細胞(CAF)※1がトランスフォーミング増殖因子β2(TGF-β2)※2を分泌することで、がん細胞の悪性化を誘導するメカニズムを明らかにしました。
- TGF-βと腫瘍壊死因子α(TNF-α)※3により血管内皮細胞から分化転換するCAFのがん細胞に対する悪性化作用が、TGF-βシグナルを中和抗体※4により阻害することで抑制できました。
- がん微小環境ネットワークを媒介するTGF-βを標的とした新規治療法開発への応用が期待できます。
東京医科歯科大学大学院医歯学総合研究科硬組織病態生化学分野の渡部徹郎教授と吉松康裕講師(現新潟大学)の研究グループは、東京大学大学院医学系研究科分子病理学分野の宮園 浩平教授と赤津裕一氏(現 日本化薬株式会社)、北海道大学大学院歯学研究院口腔病態学分野の樋田京子教授との共同研究で、TGF-βとTNF-αにより血管内皮細胞から形成されるがん関連線維芽細胞(CAF)が、がん細胞の悪性化を促進するメカニズムをつきとめました。この研究は国立研究開発法人日本医療研究開発機構(AMED)次世代がん医療創生研究事業(P-CREATE)「口腔がんの悪性化機構の解明とそのメカニズムに基づく新規治療標的探索研究」(研究開発代表者:渡部徹郎)、国立研究開発法人科学技術振興機構(JST)の戦略的創造研究推進事業(さきがけ)「生体における動的恒常性維持・変容機構の解明と制御」(研究代表者:渡部徹郎)、文部科学省科学研究費補助金等の支援のもとでおこなわれたもので、その研究成果は国際科学誌Cancer Scienceに、2020年7月10日午前10時(米国東部時間)にオンライン版で発表されます。
研究の背景
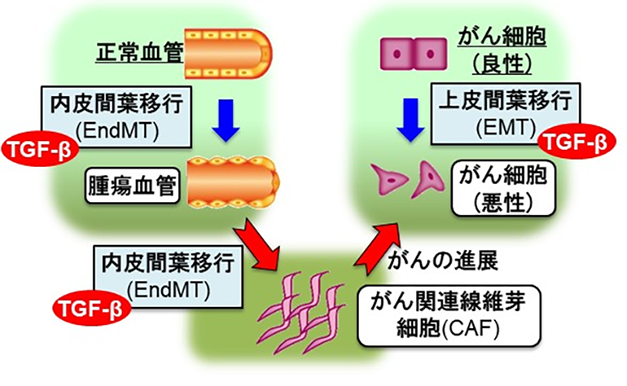
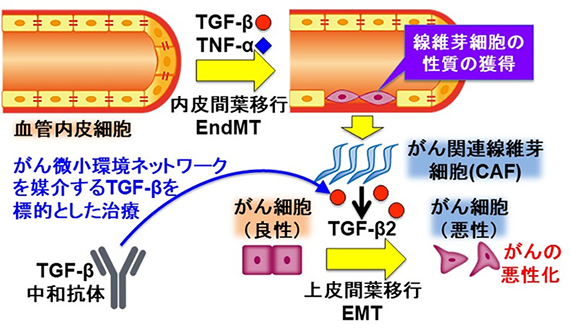
腫瘍組織には、がん細胞のみならず腫瘍血管やがん関連線維芽細胞(CAF)など様々な種類の細胞が存在し、がん微小環境が構成されています。こうした構成細胞は様々な液性因子(サイトカイン)を介して相互作用をし、がんの進展を誘導しています(図1)。つまり、がん微小環境ネットワークをより良く理解することは新規がん治療法を開発するために重要です。多くの種類のがんにおいて高いレベルで発現しているトランスフォーミング増殖因子β(TGF-β)は、上皮がん細胞から転移能の高い間葉系細胞(線維芽細胞など)への分化転換(上皮間葉移行:EMT)のみならず、血管内皮細胞からCAFへの分化転換(内皮間葉移行:EndMT)を誘導します。研究グループは以前EndMT由来のCAFががんの悪性化を亢進することを報告しましたが、この現象のメカニズムについてはこれまで解明されていませんでした。さらに、腫瘍組織に浸潤する炎症細胞は腫瘍壊死因子(TNF-α)を含む様々な炎症性サイトカインを分泌しますが、これら2つの因子によるシグナルがどのように相互作用しているかについては未解明な部分が多く残されていました。
研究成果の概要
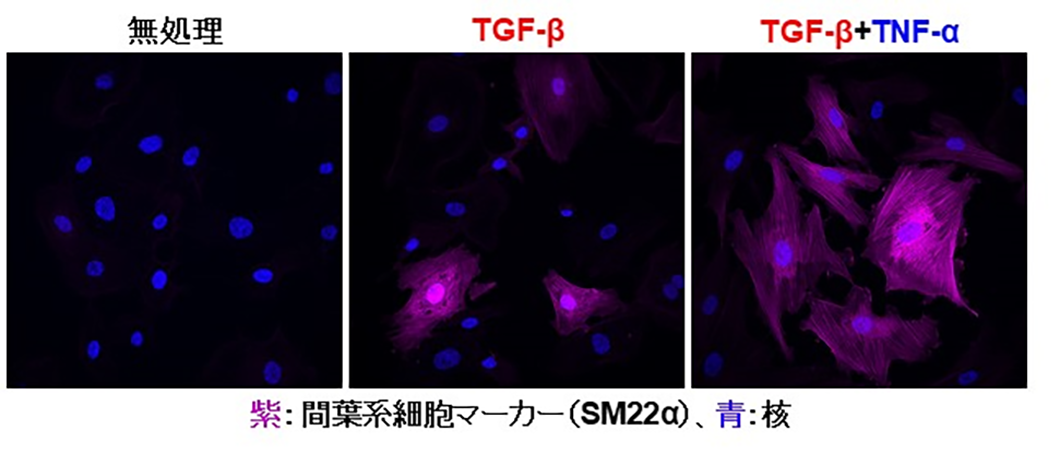
本研究グループは複数の種類のヒト血管内皮細胞を用いてTGF-βによりCAFへと分化転換する過程におけるTNF-αの役割について解析を行いました。その結果、血管内皮細胞はTGF-β存在下で培養すると間葉系細胞の性質を獲得しますが、TNF-αを添加するとTGF-βによるEndMTはさらに亢進することがわかりました(図2)。
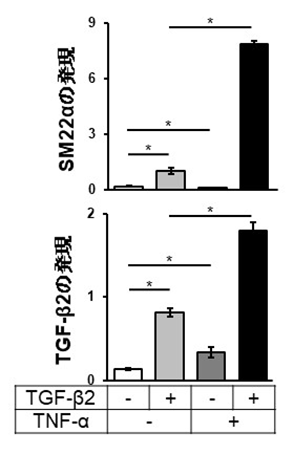
さらに血管内皮細胞をTGF-βとTNF-αで処理することで分化転換するCAFにおいて、TGF-βシグナルが長時間維持されることが明らかとなりました。これについて、TGF-βシグナルを活性化するTGF-β自身をCAFが産生するのではないかという予測が立てられたため、TGF-βファミリーメンバーの発現に対するTGF-βとTNF-αの効果を検討したところ、TGF-β2の発現が上昇していることが示されました(図3)。以上の結果から、TNF-αはTGF-βによるEndMT誘導をTGF-βシグナルの増強により亢進することが示唆されました。
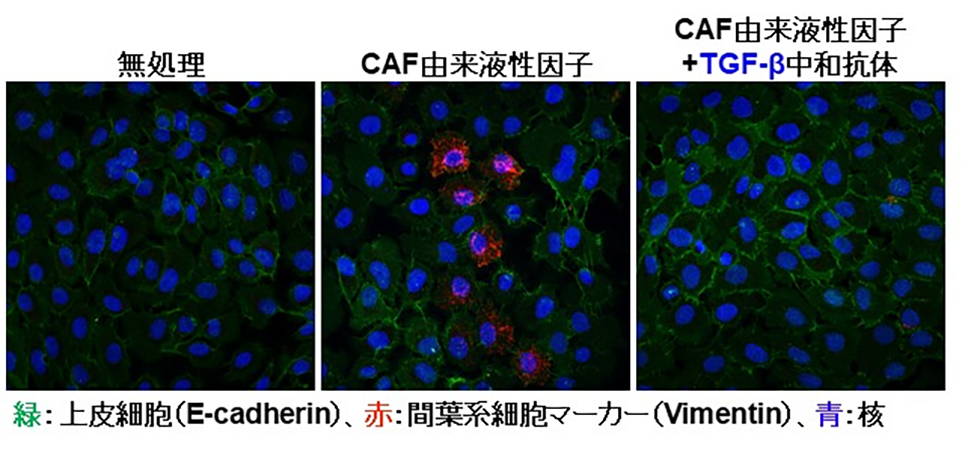
TGF-βとTNF-αによるEndMTにより形成したCAFにおいて、がん細胞の悪性度の指標であるEMTを誘導するTGF-β2が産生されているということが示されたことから、次に産生されたTGF-β2が実際にがん細胞のEMTを誘導できるか検討しました。そこで、TGF-βとTNF-αの存在下で培養した血管内皮細胞(CAF)の培養上清に含まれる液性因子を加えて、口腔扁平上皮がん細胞を培養したところ、上皮細胞マーカーであるE-cadherinの発現が低下し、間葉系細胞マーカーであるVimentinの発現が上昇しました。次に、この効果がCAFから分泌されたTGF-βによるものであるか検討するために、中和抗体を用いたTGF-βの阻害実験を行ったところ、CAF由来液性因子によるEMT誘導作用が抑制されました。以上の結果から、TNF-αがTGF-βによるEndMT誘導を亢進することで、がんの悪性化に寄与することが示唆されました。
研究成果の意義
近年、がん治療の標的として、がん悪性化を制御するCAFに注目が集まっています。CAFの起源としては腫瘍組織に存在する線維芽細胞が知られていますが、血管内皮細胞から分化転換するCAFが、CAFにおける3割程度を占めるという報告もあり、TGF-βによる血管内皮細胞からCAFへの分化転換はがん治療の標的として注目を集めています。
本研究の成果により、TGF-βとTNF-αが協調することで、血管内皮細胞からのCAFの形成を制御していることが示されました(図5)。また、血管内皮細胞由来のCAFがTGF-β2を分泌し、がん細胞のEMTを誘導することにより、がんの悪性化を亢進することが示されました。今回、中和抗体を用いたTGF-βシグナル阻害によってがんの悪性化を抑制することができたことから、将来腫瘍組織におけるTGF-βシグナルを抑制することで、がん微小環境ネットワークを標的とした新たながん治療法の開発へ応用されることが期待されます。
用語の説明
- ※1がん関連線維芽細胞(cancer-associated fibroblast: CAF):
- がん間質組織を構成する線維芽細胞であり、がん細胞の増殖促進に働くさまざまな増殖因子を産生することが報告されている。
- ※2トランスフォーミング増殖因子β(transforming growth factor-β:TGF-β):
- 線維芽細胞の形質転換を促進する因子として同定されたが、現在では多くの種類の細胞に対して増殖抑制作用を有することが明らかになっている。さらに、細胞の分化・運動などにも関与し、個体発生やがんの浸潤・転移など様々な病態生理学的現象において重要な役割を果たすことがわかっている。TGF-βはTGF-β1~3からなるファミリーを形成している。
- ※3腫瘍壊死因子α(tumor necrosis factor-α:TNF-α):
- 腫瘍壊死作用を有する活性化マクロファージ由来のサイトカインとして同定された。その生物活性は多彩であり、炎症性サイトカインであるインターロイキン-1(IL-1)など産生を介して発熱や種々の炎症反応を惹起することから、炎症反応の一つのメディエーターであると考えられている。
- ※4中和抗体:
- 特定のタンパク質の活性を中和できる抗体。TGF-βは様々な臓器の線維化を誘導するが、TGF-β中和抗体を用いて、肝臓や腎臓の線維化を抑制するための試みが進んでいる。
論文情報
- 掲載誌:
- Cancer Science
- 論文タイトル:
- TNF-α enhances TGF-β-induced endothelial-to-mesenchymal transition via TGF-β signal augmentation
研究者プロフィール
渡部徹郎(ワタベテツロウ) Watabe Tetsuro
東京医科歯科大学大学院医歯学総合研究科
硬組織病態生化学分野 教授
研究領域 がん生物学、血管生物学、生化学
吉松康裕(ヨシマツヤスヒロ) Yoshimatsu Yasuhiro
東京医科歯科大学大学院医歯学総合研究科
硬組織病態生化学分野 非常勤講師
(現・新潟大学大学院医歯学総合研究科 薬理学分野 准教授)
研究領域 がん生物学、脈管生物学、生化学
お問い合わせ先
研究に関すること
東京医科歯科大学大学院医歯学総合研究科
硬組織病態生化学分野 渡部徹郎(ワタベテツロウ)
TEL:03-5803-5449 FAX:03-5803-0187
E-mail:t-watabe.bch“AT”tmd.ac.jp
新潟大学大学院医歯学総合研究科
薬理学分野 吉松康裕(ヨシマツヤスヒロ)
TEL:025-227-2090 FAX:025-227-0759
E-mail:yyoshi85“AT”med.niigata-u.ac.jp
報道に関すること
東京医科歯科大学総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm“AT”tmd.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部医薬品研究開発課
TEL:03-6870-2221
E-mail:cancer“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年7月11日
最終更新日 令和2年7月11日


