プレスリリース 認知症の一群(FTLD類縁疾患)に共通の発症メカニズムを発見
プレスリリース
名古屋大学
日本医療研究開発機構
名古屋大学大学院医学系研究科の石垣診祐特任准教授(筆頭著者・責任著者)と祖父江元特任教授(愛知医科大学理事長)(責任著者)らの研究グループは、人格変化、情動異常、言語障害などを特徴とする認知症の1つである前頭側頭葉変性症(FTLD※1)と臨床症状が連続する神経変性疾患である筋萎縮性側索硬化症(ALS)、進行性核上性麻痺(PSP)、大脳皮質基底核変性症(CBD)など、認知症の一群(FTLD類縁疾患)に共通な病態として、FUS※2とSFPQ※3の神経細胞核内での微小局在の異常とそれに伴うタウアイソフォーム※4の変化が存在することを病理学的検討から明らかにしました。
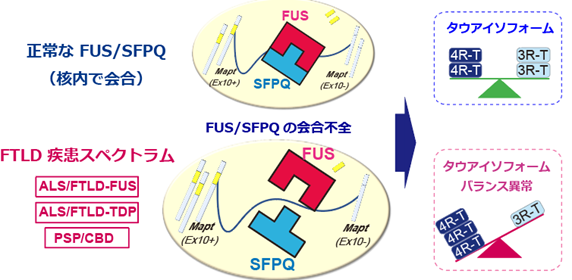
研究グループはこれまでにRNA結合タンパク質であるFUSが核内で高分子複合体を形成し、別のRNA結合タンパク質であるSFPQと結合すること、FUSとSFPQはどちらも選択的スプライシング※5を通じてタウアイソフォームのバランス変化を制御すること、FUSおよびSFPQの機能喪失マウスモデルは情動の異常を中心とするFTLDと同様の高次機能障害を呈することなどを報告してきました。今回、研究グループは剖検脳142例を用いて、海馬および前頭葉の神経細胞の核内におけるFUSとSFPQの微小局在と結合について、様々な疾患を横断的に病理組織学的、生化学的手法を用いて解析を行いました。その結果、家族性および孤発性のALS、FTLD、PSP、CBDといった広義FTLD疾患スペクトラムにおいてFUSとSFPQの会合不全とそれに伴うタウアイソフォームのバランス異常を認めました。一方で、アルツハイマー病およびピック病では変化がありませんでした。
これまでにFTLDにはALSとの疾患スペクトラム(ALS/FTLD)と4R-タウの蓄積を特徴とするタウオパチー※6(CBDやPSP)との疾患スペクトラム(FTLD-タウ)が知られていました。しかしながら、両者のスペクトラムに共通する分子メカニズムは明らかでありませんでした。今回の研究結果は、幅広いFTLD疾患スペクトラムにおける共通の分子メカニズムとしてFUS/SFPQの会合異常とそれに伴うタウ遺伝子スプライシング変化が存在することを示唆しています。研究グループの過去の研究結果ではタウアイソフォームの変化を正常に近づける介入実験によりマウスモデルのFTLDに類似した症状が回復することから、FUSとSFPQの質的な機能喪失とそれによるタウアイソフォームの変化を標的とした治療薬開発が根本治療につながる可能性があると期待されます。
本研究成果は国際科学誌「Brain」(2020年8月7日付けの電子版)に掲載されます。
ポイント
- 広義FTLD疾患スペクトラム(FTLD、ALS、CBD、PSP)の神経細胞の核内においてFUSとSFPQの微小局在と結合が障害されていることを見出しました。
- 同時にFUSとSFPQが制御するタウアイソフォームのバランスが広義FTLD疾患スペクトラムにおいては崩れ、4R-タウが増加することを見出しました。
- こうした変化はアルツハイマー病やピック病では存在しないため、ALS、FTLD、PSP、CBDといった広義FTLD疾患スペクトラム共通のメカニズムであることが示唆されました。
背景
前頭側頭葉変性症(FTLD)は人格変化、情動異常、言語障害などを特徴とする認知症の1つであり、若年性認知症の中では2割近くの割合を示すとも言われています。高度の性格変化や社会性の喪失、時には軽犯罪などを認めるために、とりわけ家庭や職場などで社会的な問題を引き起こすことがしばしばあり問題になることがあります。遺伝学的、病理学的側面よりFTLDは筋萎縮性側索硬化症(ALS)と疾患スペクトラムを形成することが知られている一方で、4R-タウの蓄積を特徴とするタウオパチーとして、進行性核上性麻痺(PSP)や大脳皮質基底核変性症(CBD)ともスペクトラムを形成すると考えられてきています。しかしながら、病態のメカニズムについてはほとんどが不明であり、根本治療法も存在しないため分子的基盤の解明は喫緊の課題となっています。研究チームはこれまでにRNA結合タンパク質であるFUSが核内で高分子複合体を形成し、別のRNA結合タンパク質であるSFPQと結合すること、FUSとSFPQはどちらも選択的スプライシングを通じてタウアイソフォームのバランス変化を制御すること、FUSおよびSFPQの機能喪失マウスモデルは情動の異常を中心とするFTLD様の高次機能障害を呈することなどを報告しており、この知見を発展させる形で、剖検脳を用いた病理学的解析を行いました。
研究成果
今後の展開
これまで指標とされてきた封入体を基準にした病理学的な解析では、ALSと臨床的・遺伝学的・病理学的に連続するFTLDの疾患グループとタウに関連するFTLDのグループに共通する分子メカニズムは明らかでありませんでした。今回の研究結果は、FTLDのみならずALS、PSP、CBDも含む幅広い「FTLD疾患スペクトラム」における共通の分子メカニズムとしてFUS/SFPQの会合異常とタウアイソフォーム変化が存在することを示唆しています。以前のマウス実験ではタウアイソフォームの変化(4R-タウ/3R-タウ比)を正常に近づけるレスキュー実験によりFTLDの症状が回復することから、FUSとSFPQの機能喪失とそれに伴うタウアイソフォームの変化を標的とした治療が、こうした神経変性疾患に広く応用できる可能性があり、今後の展開として核酸医薬などによる根本治療法の開発が期待されます。
用語説明
- ※1 FTLD(前頭側頭葉変性症):
- 認知症の一つであり著明な人格変化や行動障害、言語障害を主な特徴とする。
- ※2 FUS(fused in sarcoma):
- 家族性・孤発性のALSおよびFTLDと強く関連するRNA結合タンパク質。
- ※3 SFPQ(splicing factor、proline- and glutamine-rich):
- RNA結合タンパク質の1つであり選択的スプライシング機能に関与する。
- ※4 タウアイソフォーム:
- 選択的スプライシングの結果、主に3R-タウと4R-タウの2種類のタウが生成され、それぞれ異なる生理的役割を持つ。また認知症(タウオパチー)では蓄積するタウアイソフォームの割合が疾患の種類によって異なることが知られている。タウアイソフォームのバランスが崩れて4R-タウが3R-タウに比べて増加することがFTLD疾患スペクトラム(FTLD、ALS、PSP、CBD)の病態に共通であることを本研究で示した。
- ※5 選択的スプライシング:
- エキソンのスキッピングなどにより複数種の成熟mRNAが生じる生理的な現象。
- ※6 タウオパチー:
- 微小管結合蛋白のひとつであるタウ蛋白が、細胞内に異常蓄積する病変を有する疾患総称するものであり、アルツハイマー病、ピック病、前頭側頭葉変性症(FTLD)、進行性核上性麻痺(PSP)、大脳皮質基底核変性症(CBD)など多くの認知症が含まれる。4R-タウが優位に蓄積する疾患として、大部分のFTLD、CBD、PSPがあげられ、4Rタウオパチーと総称される。一方で、ピック病は3R-タウが優位に蓄積することが知られている。アルツハイマー病では4R-タウと3R-タウはほぼ1:1であるとされている。
- ※7 MAPT遺伝子:
- タウをコードする遺伝子であるmicrotubule associated protein tauの略。
発表雑誌
- 掲雑誌名:
- Brain
- 論文タイトル:
- Aberrant interaction between FUS and SFPQ in neurons of a wide-range of FTLD spectrum diseases
- 著者:
- Shinsuke Ishigaki1,2,4,#, Yuichi Riku1,3, Yusuke Fujioka1, Kuniyuki Endo1, Nobuyuki Iwade1, Kaori Kawai1,2, Minaka Ishibashi2, Satoshi Yokoi1, Masahisa Katsuno1, Hirohisa Watanabe1,4,5, Keiko Mori6, Akio Akagi3, Osamu Yokota7,8, Seishi Terada7, Ito Kawakami9,10, Naoki Suzuki11, Hitoshi Warita11, Masashi Aoki11, Mari Yoshida3, Gen Sobue2,4,12,#
- 所属:
- 1Department of Neurology, Nagoya University Graduate School of Medicine
2Research Division of Dementia and Neurodegenerative Disease, Nagoya University Graduate School of Medicine
3Department of Neuropathology, Institute for Medical Science of Aging, Aichi Medical University
4Brain and Mind Research Center, Nagoya University
5Department of Neurology, Fujita Health University
6Department of Neurology, Oyamada Memorial Spa Hospital
7Department of Neuropsychiatry, Okayama University Graduate School of Medicine, Dentistry and Pharmaceutical Sciences
8Department of Psychiatry, Kinoko Espoir Hospital
9Dementia Research project, Tokyo Metropolitan Institute of Medical Sciences
10Department of Psychiatry, Tokyo Metropolitan Matsuzawa Hospital
11Department of Neurology, Tohoku University Graduate School of Medicine
12Aichi Medical University - DOI:
- 10.1093/brain/awaa196.
- URL:
- https://academic.oup.com/brain/article-lookup/doi/10.1093/brain/awaa196
研究支援
本研究は、国立研究開発法人日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト」、「脳科学研究戦略推進プログラム」の支援を受けて行いました。
お問い合わせ先
研究について
名古屋大学大学院医学系研究科
特任准教授 石垣診祐
TEL:052-744-2026
E-mail:drshin758“AT”med.nagoya-u.ac.jp
名古屋大学大学院医学系研究科(愛知医科大学・理事長)
特任教授 祖父江元
TEL:052-744-2794
E-mail:sobueg“AT”med.nagoya-u.ac.jp
広報担当
名古屋大学医学部・医学系研究科総務課総務係
TEL:052-744-2228 FAX:052-744-2785
E-mail:iga-sous“AT”adm.nagoya-u.ac.jp
AMED事業について
日本医療研究開発機構 疾患基礎研究事業部・疾患基礎研究課
革新的技術による脳機能ネットワークの全容解明プロジェクト
TEL:03-6870-2225
E-mail:brain-m“AT”amed.go.jp
脳科学研究戦略推進プログラム
TEL:03-6870-2225
E-mail:brain-pro“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和2年8月7日
最終更新日 令和2年8月7日


