プレスリリース 肥満治療薬を用いて未分化iPS細胞を選択的に除去する手法を開発―再生医療で腫瘍が発生するリスクを低減し実現化を加速―
プレスリリース
慶應義塾大学医学部
日本医療研究開発機構(AMED)
慶應義塾大学医学部循環器内科学教室の遠山周吾特任講師、同救急医学教室の田野崎翔助教らの研究グループは、同医化学教室の末松誠教授らの研究グループ、同システム医学講座の洪実教授らの研究グループ、株式会社リピドームラボとの共同研究により、ヒトiPS細胞由来の分化細胞集団から、臨床応用の課題であった腫瘍化の原因となる未分化iPS細胞を高効率に除去し、より安全性を高めた移植用細胞を作製することに成功しました。
ヒト人工多能性幹細胞(ヒトiPS細胞)(注1)は、理論的に体を構成するすべての細胞種へと分化できる多能性を持つことから、体外で作製した治療細胞を体内に移入することによる「再生医療」の実現が期待されています。しかし、すべてのヒトiPS細胞を目的とする細胞へ分化誘導することは困難であり、分化できなかった細胞の中に腫瘍形成の原因となる細胞が残存してしまうことがさまざまな領域における再生医療実現化の大きな課題になっていました。
今回、共同研究グループは、ヒトiPS細胞において脂肪酸の合成が活発に行われていることを見出し、ヒトiPS細胞の増殖および生存に重要な役割を担っていることを明らかにしました。その性質を利用し、肥満治療薬としてFDA(米国食品医薬品局)に認可されているオルリスタット(注2)という薬を用いて脂肪酸合成を阻害することにより、腫瘍形成の原因となる未分化iPS細胞(注3)だけを選択的に死滅させ、ヒトiPS細胞から分化した心筋細胞や神経細胞等の分化した細胞だけを生きたまま選別する手法を確立することに成功しました。これによって、極めて単純な工程によって、臨床応用を視野に入れた高純度の心筋細胞を作製することが可能となりました。この研究成果は、安全性の高い移植用細胞を作製するという大きな課題を解決し、さまざまな領域の再生医療の実現化を大きく加速するものと考えます。
本研究成果は2020年9月5日(米国東部時間)に、Cell Pressが発刊する米科学誌「iScience」に掲載されました。
研究の背景
ヒトiPS細胞は、多種類の体細胞に分化出来る能力を有している反面、分化させた細胞集団の中に未分化iPS細胞が残存する性質があることがわかっています。仮にこうした未分化iPS細胞が生体内に移植されると、腫瘍を形成する危険性があるため、未分化iPS細胞を除去する手法の開発が望まれてきました。
細胞の生存にとって重要な栄養素は細胞の種類によって異なっているとされます。2016年に本研究グループは、ヒトiPS細胞においてグルコースおよびグルタミンの代謝が活発であること、心筋細胞は乳酸をエネルギー源とすることを明らかにし、培養液に含まれているグルコースおよびグルタミンを除去し乳酸を添加することで未分化iPS細胞を除去する手法を報告しました(Tohyama S, et al. Cell Metabolism 2016)。しかし、心臓以外の領域の再生医療では応用できないという問題がありました。
そこで、ヒトiPS細胞において特徴的な代謝経路を探索したところ、脂肪酸の合成が活発に行われていることを見出し、さらにヒトiPS細胞の生存に重要な役割を担っていることを明らかにしました。
研究の成果
(1)ヒトiPS細胞では脂肪酸の合成が活発に行われている
ヒトiPS細胞に特徴的な代謝経路を探索するため、ヒトiPS細胞と分化した心筋細胞における代謝酵素の発現の違いをプロテオーム解析(注4)により網羅的に調べました。その結果、ヒトiPS細胞では、分化した心筋細胞に比べて脂肪酸合成経路に関わる代謝酵素の発現が最も高いことがわかりました(図1A)。そこで、肥満治療薬としてFDA(米国食品医薬品局)に認可されているオルリスタットという薬を用いて脂肪酸合成を阻害したところ、ヒトiPS細胞の増殖が停止し、細胞が死滅することがわかりました(図1B)。その分子機序を明らかにするため、メタボローム解析(注5)を行ったところ、ヒトiPS細胞内におけるホスファチジルコリンをはじめとする細胞内の脂質の低下が原因であることがわかりました(図1C)。
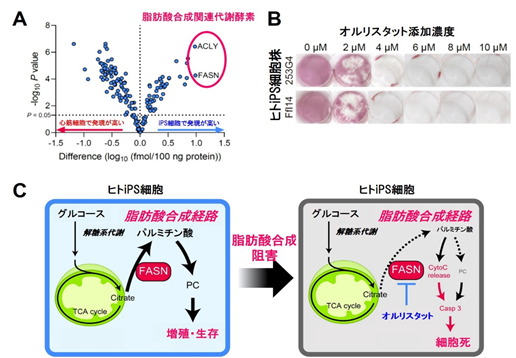
- ヒトiPS細胞では分化した心筋細胞に比べて脂肪酸合成経路に関わる代謝酵素の発現が最も高かった。横軸は代謝酵素の発現量の違い、縦軸は統計的優位性を示している。
- 脂肪酸合成阻害薬であるオルリスタットをヒトiPS細胞に添加したところ、オルリスタット濃度依存的にヒトiPS細胞が死滅した。
- ヒトiPS細胞では脂肪酸合成が活発に行われているが、脂肪酸合成酵素を阻害すると、パルミチン酸やホスファチジルコリンが低下し、細胞死が誘導される。
FASN:脂肪酸合成酵素 PC:ホスファチジルコリン
(2)オルリスタット添加により未分化iPS細胞を選択的に除去することができる
次に、脂肪酸合成阻害薬であるオルリスタットが他の細胞の生存に影響を及ぼさないかを評価したところ、ヒトiPS細胞から分化した心筋細胞のみならず、神経細胞や肝細胞の生存に対しても影響を及ぼさないことがわかりました(図2A)。
さらに、ヒトiPS細胞から分化させた細胞集団に未分化iPS細胞が残存している状況を再現するために、未分化iPS細胞とヒトiPS細胞から分化した心筋細胞を一緒に培養し、それらの細胞に脂肪酸合成阻害薬であるオルリスタットを添加したところ、未分化iPS細胞のみを選択的に除去できることがわかりました(図2B)。
また、ヒトiPS細胞から合成RNAを用いて神経細胞を分化誘導する過程において、脂肪酸合成阻害薬であるオルリスタットを添加したところ、未分化iPS細胞が除去されヒトiPS細胞由来の神経細胞のみを選別できることもわかりました(図2C)。
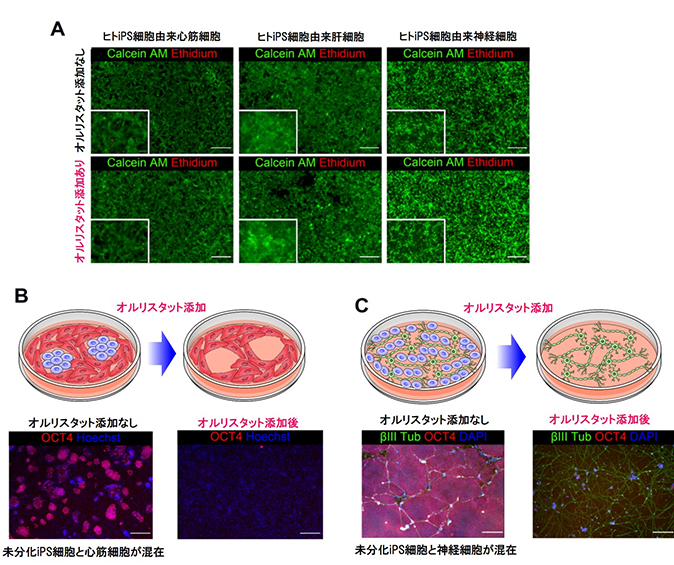
- オルリスタットはヒトiPS細胞から分化した心筋細胞のみならず、神経細胞や肝細胞の生存に対しても影響を及ぼさなかった。緑は生存細胞、赤は死細胞を示している。
- 未分化iPS細胞とヒトiPS細胞から分化した心筋細胞が混在した細胞集団にオルリスタットを添加したところ、未分化iPS細胞のみを選択的に除去することが可能であった。
赤は未分化iPS細胞、青はすべての細胞を示している。 - ヒトiPS細胞から合成RNAを用いて神経細胞を分化誘導する過程において、脂肪酸合成阻害薬であるオルリスタットを添加したところ、ヒトiPS細胞由来の神経細胞のみを選別することができた。赤は未分化iPS細胞、青はすべての細胞、緑は神経細胞を示している。
最後に、ヒトiPS細胞から分化させた細胞を移植する際、オルリスタットを使って未分化iPS細胞を除去することで移植後の腫瘍形成が抑えられるかどうかを調べるため、未分化iPS細胞とヒト線維芽細胞を混ぜて培養したものにオルリスタットを添加した後、免疫不全マウスの皮下に移植しました。2か月後に移植後のマウスを観察すると、オルリスタットを添加しなかった場合には、移植したマウス5匹中4匹で腫瘍が形成されたのに対して、オルリスタットを添加すると、いずれのマウスにも腫瘍は形成されませんでした。
今後の展開
本技術の確立により、培養液中に脂肪酸合成阻害薬であるオルリスタットを添加するという簡便な手法により、成熟した分化細胞には影響を与えることなく、未分化iPS細胞を選択的に除去でき、臨床応用を視野に入れた高品質の移植用細胞を作製することが可能となりました。
今回の発見は、これまで開発してきた手法との併用も可能であり、ヒトiPS細胞から分化させた心筋細胞を用いた心臓再生医療を行う際に、安全性が担保された移植用細胞を得る上で極めて重要な技術であると考えています。また、心臓再生医療のみならず他の領域の再生医療の実現化を促進する成果であると期待されます。
特記事項
本研究は、主に下記機関より資金的支援を受け実施されました。
国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム(技術開発個別課題)「多能性幹細胞の代謝機構に基づく機能制御とその応用」(研究代表者:遠山周吾)なお、末松誠教授は、本研究に関するAMEDからの研究費を受給しておりません。
論文
- 英文タイトル:
- Fatty Acid Synthesis Is Indispensable for Survival of Human Pluripotent Stem Cells
- タイトル和訳:
- ヒト多能性幹細胞の生存に脂肪酸合成は必須である
- 著者名:
- 田野崎翔、遠山周吾、藤田淳、染谷将太、菱木貴子、松浦友美、中西広樹、 大戸貴代、秋山智彦、森田唯加、岸野喜一、岡田麻里奈、谷英典、相馬雄輔、 中嶋一晶、金澤英明、杉本昌弘、洪実、末松誠、福田恵一
- 掲載誌:
- iScience, 2020 (e-pub online)
- DOI:
- 10.1016/j.isci.2020.101535
用語解説
- (注1)ヒト人工多能性幹細胞(ヒトiPS細胞:human induced pluripotent stem cell):
- 体細胞に特定因子を導入することにより樹立される、胚性幹細胞(ES細胞)に類似した多能性幹細胞。2007年に山中教授の研究グループにより世界で初めてヒト体細胞を用いて樹立された。ES細胞と異なり、受精卵受精を終えた卵で、発生を開始する。を破壊する必要がなく、患者自身の細胞からも作製することが可能なため、免疫拒絶の問題が理論上ない。
- (注2)オルリスタット:
- 脂肪酸合成酵素阻害薬。海外では「ゼニカル」あるいは「アリ」の商品名で肥満治療薬として販売されており、FDAでも認可されている。腸管内のリパーゼに作用し、腸管からの脂肪の吸収を阻害するため、肥満治療薬として使用されている。
- (注3)未分化iPS細胞:
- iPS細胞由来の分化細胞中に残存する腫瘍形成の原因となる細胞。 ES細胞やiPS細胞は様々な体細胞に分化することができるが、この未分化iPS細胞が残存することにより、細胞移植後に腫瘍を形成する可能性があることが知られてお り、ES細胞やiPS細胞を扱う上での大きな問題となっている。
- (注4)プロテオーム解析:
- 細胞に存在するタンパク質を網羅的に解析すること。プロテオ ーム解析により、細胞の特徴を予測することができる。
- (注5)メタボローム解析:
- 細胞や組織内に存在する全代謝産物を網羅的に解析すること。 メタボローム解析は、細胞における代謝を包括的に理解する目的以外にも、病気に おけるバイオマーカー探索や創薬開発への応用が期待されている。
お問い合わせ先
本発表資料のお問い合わせ先
慶應義塾大学医学部循環器内科学教室特任講師 遠山周吾(とおやましゅうご)
TEL:03-5363-3446 FAX:03-5356-3875
E-mail:shugotohyama“AT”keio.jp
本リリースの配信元
慶應義塾大学
信濃町キャンパス総務課:山崎・飯塚
〒160-8582 東京都新宿区信濃町35
TEL:03-5363-3611 FAX:03-5363-3612
E-mail:med-koho“AT”adst.keio.ac.jp
慶應義塾大学医学部・医学研究科
事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部
再生医療研究開発課
TEL:03-6870-2220
E-mail:saiseinw“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年9月8日
最終更新日 令和2年9月8日


