統合失調症の新たな治療標的を発見―核内受容体PPAR𝛼の活性化剤が役立つ可能性―
プレスリリース
理化学研究所
日本医療研究開発機構
理化学研究所(理研)脳神経科学研究センターキャリア形成推進プログラムの前川素子上級研究員(同分子精神遺伝研究チーム研究員)、分子精神遺伝研究チームの和田唯奈大学院生リサーチ・アソシエイト、大西哲生副チームリーダー、吉川武男チームリーダーらの共同研究グループ※は、核内受容体[1]PPAR𝛼[2]が統合失調症[3]の新しい治療標的になり得る可能性を発見しました。
本研究成果は、統合失調症の新しい治療薬開発に向けた取り組みに貢献すると期待できます。
今回、研究グループは、統合失調症患者のDNAサンプルを用いた遺伝子解析を行い、PPAR𝛼をコードするPPARA遺伝子に、機能不全を起こす可能性がある変異を同定しました。また、PPARA遺伝子破壊マウスを用いた解析から、PPAR𝛼の機能不全が統合失調症に似た行動変化および組織学的変化を引き起こすことを明らかにしました。さらに、NMDA受容体[4]阻害薬であるフェンサイクリジン(PCP)[5]を用いて作製した薬理学的統合失調症モデルマウスを用いた解析から、脂質代謝異常症の治療薬として臨床で広く使用されているPPAR𝛼活性化剤(アゴニスト)の「フェノフィブラート[6]」が、統合失調症様表現型の改善に役立つ可能性を見いだしました。
本研究は、科学雑誌『EBioMedicine』のオンライン版(2020年12月2日付:日本時間2020年12月2日)に掲載されます。
- ※共同研究グループ
- 理化学研究所研究所 脳神経科学研究センター
キャリア形成推進プログラム
上級研究員 前川素子(まえかわもとこ)(脳神経科学研究センター 分子精神遺伝研究チーム 研究員)
分子精神遺伝研究チーム
大学院生リサーチ・アソシエイト 和田唯奈(わだゆいな)(お茶の水女子大学博士課程 大学院生)
チームリーダー 吉川武男(よしかわたけお)
副チームリーダー 大西哲生(おおにしてつお)
研究員 シャビーシュ・バラン(Shabeesh Balan)
客員研究員 豊田倫子(とよたともこ)
テクニカルスタッフⅠ 大羽尚子(おおばひさこ)
テクニカルスタッフⅠ 久野泰子(ひさのやすこ)
テクニカルスタッフⅡ 渡辺明子(わたなべあきこ)
テクニカルスタッフ 野崎弥生(のざきやよい)
生体物質分析ユニット
専門技術員 岩山佳美(いわやまよしみ)
脳発達分子メカニズム研究チーム
チームリーダー 下郡智美(しもごおりともみ)
お茶の水女子大学
教授 小林哲幸(こばやしてつゆき)
東京都医学総合研究所
副所長 糸川昌成(いとかわまさなり)
大分大学 医学部
特任准教授 松岡茂(まつおかしげる)
熊本大学
教授 岩本和也(いわもとかずや) - 研究支援
- 本研究は、日本医療研究開発機構(AMED)脳科学研究戦略推進プログラム「臨床と基礎研究の連携強化による精神・神経疾患の克服(融合脳)」の「エピジェネティク変化を介した核内受容体遺伝子発現制御による統合失調症病態メカニズム解明と治療法の開発(代表:前川素子)」「細胞内代謝・ダイナミクス制御から切り拓く発達障害・統合失調症の病理の解明・新規治療法の開発(代表:吉川武男)」、日本学術振興会(JSPS)科学研究費補助金基盤研究(C)「一細胞遺伝子発現解析の実現による統合失調症病態メカニズム解明と創薬への応用(研究代表者:前川素子)」、同金基盤研究(C)「新規遺伝子発現調節メカニズムLDB2-EGR/ARC系と精神疾患」(研究代表者:大西哲生)、同新学術領域研究(研究領域提案型)「マルチスケール精神病態の構成的理解(領域代表者:林朗子、分担:吉川武男)」、公益財団法人先進医薬研究振興財団(前川素子)による支援を受けて行われました。
背景
統合失調症は将来への成長が期待される思春期前後に好発することから、大きな社会問題となっています。また、統合失調症は罹患者数が多いことから(生涯罹患率約1%)、発症による労働力低下や医療コスト増大が改善すべき重要な課題です。しかし現状では発症メカニズムの理解が不十分であり、新たな治療薬の開発が難しい状況です。
統合失調症の病因について、共同研究グループらはこれまでに、遺伝要因と環境要因の両方に関わる分子として、多価不飽和脂肪酸(不飽和結合を二つ以上持つ脂肪酸)と脂肪酸結合タンパク質[7]に着目してきました注1-5)。多価不飽和脂肪酸は、「核内受容体」の内因性リガンド[1]として遺伝子発現を調節することで、統合失調症の病態形成に関わる可能性が考えられましたが、核内受容体と統合失調症病態形成の関連についてはよく分かっていませんでした。
そこで共同研究グループは、ヒト遺伝学的解析、遺伝子改変動物や薬理学的統合失調症モデル動物を用いた解析により、核内受容体が統合失調症の病態メカニズムに関わる可能性について調べることにしました。
注1)2017年9月5日理化学研究所プレスリリース「発達期の脂肪酸不足が統合失調症発症に関連」
注2)2014年9月12日理化学研究所プレスリリース「頭皮の毛根細胞を利用した精神疾患の診断補助バイオマーカーの発見」
注3)2014年7月14日理化学研究所プレスリリース「脂肪酸の機能に関わる遺伝子の変異が統合失調症・自閉症に関連する可能性」
注4)Maekawa et al., Polymorphism screening of brain-expressed FABP7, 5 and 3 genes and association studies in autism and schizophrenia in Japanese subjects. J Hum Genet. 2010 Feb;55(2):127-30. doi: 10.1038/jhg.2009.133.
注5)Iwayama et al., Association analyses between brain-expressed fatty-acid binding protein (FABP) genes and schizophrenia and bipolar disorder. Am J Med Genet B Neuropsychiatr Genet. 2010 Mar 5;153B(2):484-493. doi: 10.1002/ajmg.b.31004.
研究手法と成果
多価不飽和脂肪酸を内因性リガンドとする核内受容体として、PPAR𝛼、PPAR𝛿、PPAR𝛾、RXR𝛼、RXR𝛽、RXR𝛾などが知られています。共同研究グループは、これらのタンパク質をコードする遺伝子について、統合失調症患者1,200人のDNAを用いて、遺伝子がコードされているエクソン領域の塩基配列を調べるエクソンリシークエンス解析を行い、機能不全をもたらす可能性のある変異を探索しました。その結果、PPAR𝛼をコードする「PPARA遺伝子」において、1種類のスプライスアクセプターサイト[8]変異、3種類のミスセンス変異[9]を同定しました。これらの変異は、東北メディカルメガバンク[10]で公開されている、一般人口のゲノム配列では見つかりませんでした。これらのPPARA遺伝子の変異は、統合失調症にしか見られなかったことから、統合失調症の発症に寄与している可能性があります。また、これらの変異について、機能解析を実施したところ、発見した4変異は全てPPARA遺伝子の機能不全を誘導する可能性が高いことが明らかになりました(図1)。
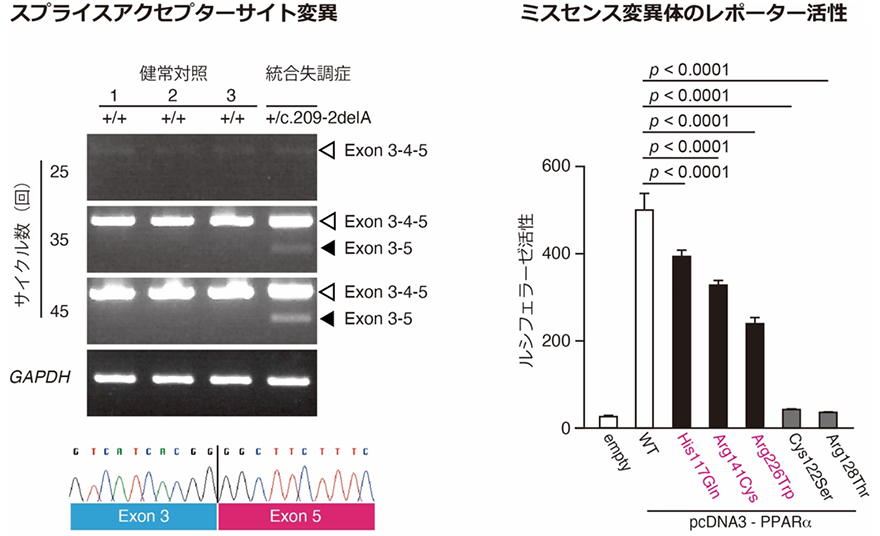
左下段:Exon 3-5の塩基配列。Exon 4がスキップしていることが確認できる。
右:PPARA遺伝子で見つかった三つのミスセンス変異(赤字)は、ルシフェラーゼ活性に表される転写活性化能の低下を引き起こす。
次に、PPAR𝛼の機能低下と統合失調症発症の脆弱性の因果関係を個体レベルで明らかにするため、CRISPR/Cas9n法[11]を用いてPPARA遺伝子破壊マウス(Ppara KOマウス)を作製して表現型の解析を行いました。その結果、Ppara KOマウスでは、統合失調症の中間表現型(疾患と関連する表現型で、検査によって定量可能なもの)の一つとして知られるプレパルス抑制[12]の低下、不安の行動評価に用いられるガラス玉覆い隠し試験[13]でガラス玉埋め隠し行動の亢進を示すことを見いだしました(図2上段)。また、Ppara KOマウスの脳の組織学的解析では、統合失調症の死後脳解析でも報告されている大脳皮質前頭前野のスパイン(神経細胞の樹状突起にある棘状の構造)密度の低下、スパイン形態の異常(未熟スパインの増加と成熟スパインの減少)が起こることを見いだしました(図2下段)。以上の結果から、PPARA遺伝子の機能不全が統合失調症の発症リスクにつながる可能性を示しました。
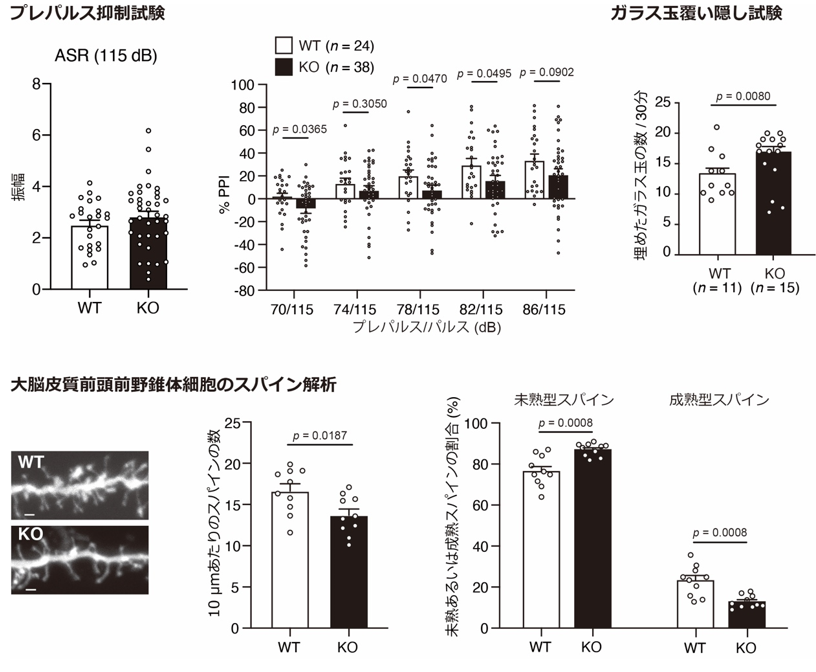
下段:Ppara KOマウスは、WTマウスと比較して、統合失調症患者の死後脳と同様のスパイン密度の低下(左、中央)、スパイン形態の異常(右)が認められた。
PPAR𝛼の下流因子を探索する目的で、Ppara KOマウスと野生型マウスの大脳皮質を用いて、RNA-seq法[14]により網羅的遺伝子発現解析を行いました。その結果、Ppara KOマウスでは、シナプス形成に関連する遺伝子の発現変動が起きていることが分かりました(図3)。これらの遺伝子については、プロモーター領域[15]にPPAR𝛼の結合コンセンサス配列[16]が複数存在していることから、PPAR𝛼が直接的にこれらの発現を制御している可能性が考えられます。
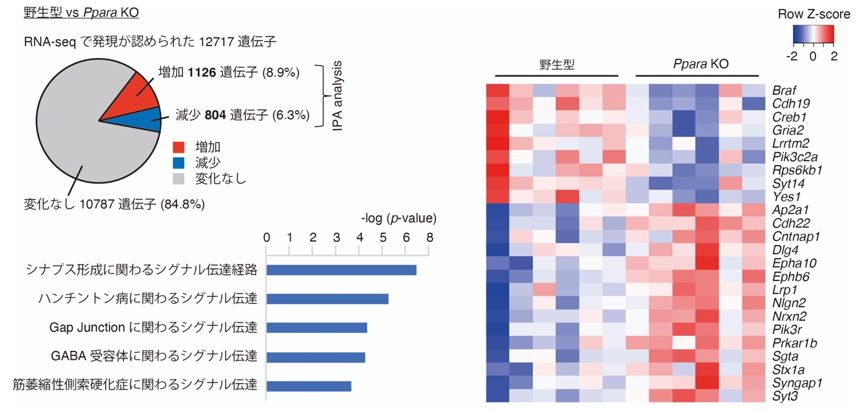
左下:Ppara KOマウスで発現の変動が認められた遺伝子に関するパスウェイ解析の結果。
右:シナプス形成に関わる遺伝子のヒートマップ(遺伝子発現のパターン)。マスの色は、遺伝子の発現量を示す。
最後に、PPAR𝛼の機能低下が統合失調症の病態形成に関わるとしたら、PPAR𝛼活性化剤(アゴニスト)が治療に使用できるのではないかと考え、統合失調症モデル動物を用いて検討しました。まず、NMDA受容体阻害薬であるフェンサイクリジン(PCP)を投与した薬理学的統合失調症モデルマウスを作製し、大脳皮質前頭前野の神経細胞にスパイン形態の異常(未熟型スパインの増加と成熟型スパインの減少)が起こることを見いだしました。この動物に対してPPAR𝛼アゴニストの一つであるフェノフィブラートを投与すると、これらのスパイン形態の異常が改善することが分かりました(図4)。また、野生型マウスに対して、フェノフィブラートを事前投与しておくと、NMDA受容体阻害薬でPCPと同様に統合失調症様症状を引き起こすMK-801による自発運動量の亢進が緩和されることが明らかになりました。
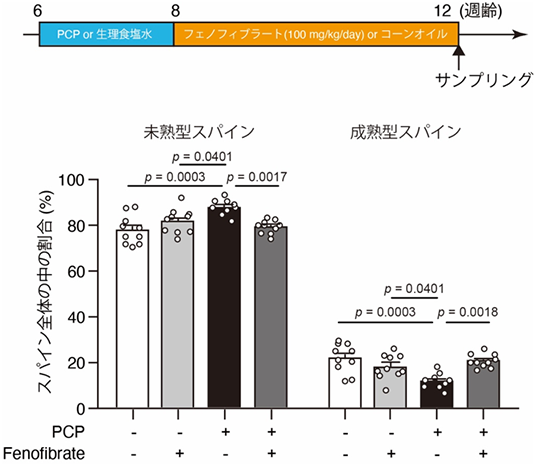
下段:フェノフィブラートにより、PCPによるスパインの形態異常(未熟型スパインの増加と成熟型スパインの減少)が改善した。
以上の結果から、PPAR𝛼の機能不全がスパイン形成不全を介して統合失調症の病態形成に関わり、PPAR𝛼が統合失調症の新しい治療標的になり得る可能性が示されました。
今後の期待
今回、共同研究グループは、統合失調症患者の中に核内受容体PPAR𝛼の機能不全を示す一群が存在する可能性を示しました(図5)。また、PPAR𝛼の活性化が統合失調症の治療に役立つ可能性を明らかにし、今後の統合失調症治療薬開発に新しい道筋を示しました。
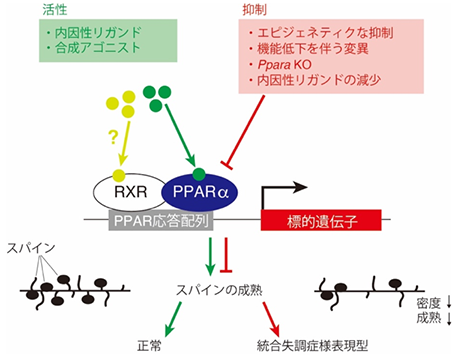
統合失調症の治療薬として、これまでは主にドーパミンD2受容体[17]阻害剤が使われてきましたが、その治療効果には限界があることが知られていました。今回、PPAR𝛼が統合失調症の治療ターゲットになり得ることが発見されたことで、新しい分子メカニズムによる統合失調症の治療薬開発への道が拓ける可能性があります。
また、今回の解析で用いたPPAR𝛼のアゴニストのフェノフィブラートは、脂質代謝治療薬として臨床で広く使用されています。ただ、フェノフィブラートには、重篤な副作用も報告されていることから、臨床応用に関しては、今後より副作用の少ないPPAR𝛼のアゴニストを開発するなどの工夫が必要であると考えられます。
論文情報
- タイトル
- Peroxisome proliferator-activated receptor α as a novel therapeutic target for schizophrenia
- 著者名
- Yuina Wada, Motoko Maekawa, Tetsuo Ohnishi, Shabeesh Balan, Shigeru Matsuoka, Kazuya Iwamoto, Yoshimi Iwayama, Hisako Ohba, Akiko Watanabe, Yasuko Hisano, Yayoi Nozaki, Tomoko Toyota, Tomomi Shimogori, Masanari Itokawa, Tetsuyuki Kobayashi and Takeo Yoshikawa
- 雑誌
- EBioMedicine
- DOI
- 10.1016/j.ebiom.2020.103130
補足説明
- [1]核内受容体、内因性リガンド
- 転写因子の一種。リガンドが結合することで、DNAの転写を調節する。内因性リガンドは、生体内に存在して受容体のリガンドとして働く物質のこと。
- [2]PPAR𝛼
- ペルオキシソーム増殖因子活性化受容体アルファ。核内受容体の一つ。
- [3]統合失調症
- 幻覚や妄想、意欲の低下、感情の平板化などを主症状とする精神疾患。
- [4]NMDA受容体
- NMDA(N-methyl-D-aspartate)型受容体。神経伝達物質として働くグルタミン酸の受容体の一つ。
- [5]フェンサイクリジン(PCP)
- NMDA阻害剤の一つ。フェンサクリジンをヒトに投与すると、幻覚、妄想、精神錯乱などを誘発し、統合失調症と類似した症状が出現するといわれている。PCPはphencyclidineの略。
- [6]フェノフィブラート
- PPAR𝛼の活性化剤(アゴニスト)。高脂血症の治療薬として臨床で使用されている。
- [7]脂肪酸結合タンパク質
- 疎水性の脂肪酸と結合し、輸送する役割が知られている。
- [8]スプライスアクセプターサイト
- エクソンの5'側のイントロン(遺伝子の一部分で、最終的に機能する転写産物から除外される塩基配列)にあるスプライシングに必要な配列。AG(アデニン・グアニン)を含む。
- [9]ミスセンス変異
- コドン内の塩基置換により、異なるアミノ酸に置き換わる変異。
- [10]東北メディカルメガバンク
- 東日本大震災の被災地を中心に進められている、生体試料・健康情報・診療情報などのバイオバンク。数千人規模の全ゲノム解析を実施し、日本人のリファレンスパネルをデータベース化して公開している。
- [11]CRISPR/Cas9n法
- 遺伝子編集技術の方法の一つ。標的DNAに対して相補的な配列を含む短いRNAとCas9という細菌に由来するDNAを切断する酵素を用いて、DNA配列を特異的に切断する機能を用いたゲノム編集方法。CRISPR/Cas9n法はCRISPR/Cas9法の改変版。
- [12]プレパルス抑制
- 音刺激に対する驚愕反応が、その直前に起こる弱い音によって抑制される現象。精神疾患のヒトでは、この機能が弱まっていることが知られている。
- [13]ガラス玉覆い隠し試験
- ガラス玉を床敷で覆い隠そうとするマウスの行動の試験。強迫行為、不安に関連した行動を測定する。
- [14]RNA-seq法
- 次世代シークエンサーを用いた、遺伝子発現量の定量方法の一つ。
- [15]プロモーター領域
- 遺伝子の上流に存在する領域で、基本転写因子や転写因子が結合して転写が開始される部位。
- [16]コンセンサス配列
- DNA、RNA、タンパク質中で、複数の異なる生物間で見られる共通配列(塩基あるいはアミノ酸配列)のこと。例えば、転写因子は調節する遺伝子のコンセンサス配列に結合する。
- [17]ドーパミンD2受容体
- 神経伝達物質として働くドーパミンの受容体の一つ。抗精神病薬の主要な標的として知られている。
発表者・機関窓口
発表者
理化学研究所 脳神経科学研究センター
キャリア形成推進プログラム
上級研究員 前川素子(まえかわもとこ)(脳神経科学研究センター 分子精神遺伝研究チーム 研究員)
分子精神遺伝研究チーム
大学院生リサーチ・アソシエイト 和田唯奈(わだゆいな)(お茶の水女子大学博士課程 大学院生)
副チームリーダー 大西哲生(おおにしてつお)
チームリーダー 吉川武男(よしかわたけお)
機関窓口
理化学研究所 広報室 報道担当
E-mail:ex-press“AT”riken.jp
*今般の新型コロナウイルス感染症対策として、理化学研究所では在宅勤務を実施しておりますので、メールにてお問い合わせ願います。
AMED事業について
日本医療研究開発機構
疾患基礎研究事業部 疾患基礎研究課
E-mail:brain-pro“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和2年12月2日
最終更新日 令和2年12月2日


