プレスリリース ゲノム編集のための最小のはさみ―CRISPR-Cas12fの立体構造を解明―
プレスリリース
東京大学
日本医療研究開発機構
発表者
武田聖(東京大学大学院理学系研究科生物科学専攻 修士課程1年)
西増弘志(東京大学先端科学技術研究センター 教授)
濡木理(東京大学大学院理学系研究科生物科学専攻 教授)
発表のポイント
- ゲノム編集への応用が期待されるCRISPR-Cas酵素(注1)として近年発見されたCas12fの立体構造を決定した。
- Cas12fは二量体として機能することを発見した。
- Cas12fがガイドRNAと協働して標的DNAを切断する仕組みの一端を解明した。
発表概要
ゲノム編集は、「生命の設計図」であるゲノム情報(DNAの塩基配列)を人為的に改変する革新技術であり、遺伝子治療や創薬、バイオ燃料の開発や農作物の品種改良、遺伝子改変生物を用いた基礎研究などさまざまな領域において広く利用されています。ゲノム編集にはII型CRISPR-Cas酵素であるCas9が利用されていますが、分子のサイズが大きいため細胞への導入効率が低いなどの問題点が残されています。一方、V型CRISPR-Cas酵素として近年発見されたCas12fはCas9の半分以下の分子サイズにも関わらず、Cas9と同様にガイドRNAと結合し標的DNAを切断するはたらきをもちます。したがって、Cas12fは小型のゲノム編集ツールとして期待されていますが、Cas12fがはたらく仕組みは不明でした。
今回、東京大学大学院理学系研究科の武田聖大学院生、濡木理教授、東京大学先端科学技術研究センターの西増弘志教授らは、クライオ電子顕微鏡(注2)を用いてCas12f–ガイドRNA–標的DNA複合体の立体構造を決定することに成功しました。その結果、予想外なことに、2つのCas12f分子が1つのガイドRNA分子に結合して機能することを発見しました。生化学的解析からも、構造も機能も異なる2つのCas12f分子が「非対称二量体」を形成して、標的DNAを切断していることが明らかになりました。
本研究の成果は、多様なCRISPR-Cas酵素のさらなる理解、および、小型ゲノム編集ツールの開発につながることが期待されます。
発表内容
原核生物のもつCRISPR-Cas獲得免疫システムはウイルスなどの外来核酸に対する防御を担い、6つのタイプ(I–VI型)に分類されます。II型CRISPR-Casシステムに関与するCas9はガイドRNA(gRNA)と複合体を形成し、gRNAのガイド配列と相補的な塩基配列をもつ2本鎖DNAを切断します(図1)。ガイド配列は任意の配列に変更可能であるため、CRISPR-Cas9(Cas9–gRNA複合体)を用いることにより、ゲノムDNAを狙った位置で切断することができます。したがって、CRISPR-Cas9はゲノム編集などさまざまな新規技術に応用されています。Cas9を遺伝子治療に利用する場合、アデノ随伴ウイルスなどのウイルスベクター(注3)を用いてCas9を目的の組織に導入する必要があります。しかし、Cas9は大きなタンパク質(1368アミノ酸残基)であるため、ウイルスベクターへの搭載効率が低いという問題点が残されています。
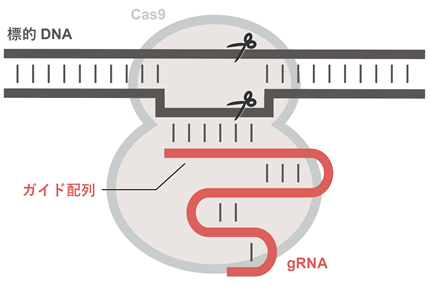
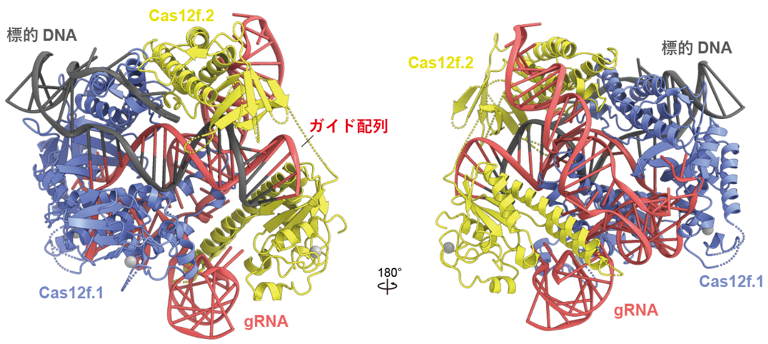
今回、東京大学の濡木理教授らのグループはV型CRISPR-Casシステムに関与する小型のCas12f(529アミノ酸残基)に着目し構造解析を行いました。クライオ電子顕微鏡を用いて、Cas12f–gRNA–標的DNA複合体の立体構造を決定したところ、予想外なことに、2つのCas12f分子(Cas12f.1とCas12f.2と命名)が1つのgRNA分子に結合し、標的DNAを認識することが明らかになりました(図2)。すなわち、Cas9と異なり、Cas12fはCas12f.1とCas12f.2からなる二量体として機能することが明らかになりました。Cas12f.1とCas12f.2の構造比較から、2つのCas12f分子は部分的に構造を変化させ、gRNAと標的DNAと結合していることが明らかになりました。立体構造を基に設計した変異体を用いて生化学的解析を行った結果、(1)二量体の形成が標的DNAの切断に必要なこと、(2)Cas12f.1がDNA切断を触媒することが示唆されました。さらに、Cas12aなど他のCas12酵素との比較から、Cas12酵素は小型のCas12fから分子進化した可能性が示唆されました。これらの成果は、多様なCRISPR-Cas酵素のさらなる理解、および、小型で効率的なゲノム編集ツールの開発につながることが期待されます。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)先端的バイオ創薬等基盤技術開発事業「安全な遺伝子治療を目指した万能塩基編集ツールの創出」(研究代表者:濡木理)、日本学術振興会科学研究費助成事業基盤研究(B)「RNA依存性エフェクター複合体の構造機能解析」(課題番号:18H02384研究代表者:西増弘志)、科学技術振興機構戦略的創造研究推進事業(CREST)「細胞外微粒子の1粒子解析技術の開発を基盤とした高次生命科学の新展開」(研究代表者:渡邉力也)、AMED「創薬等ライフサイエンス研究支援基盤事業」の一環とした「創薬等先端技術支援基盤プラットフォーム(BINDS)」などの支援により行われました。
発表雑誌
- 雑誌名
- 「Molecular Cell」(2020年12月16日オンライン版公開予定)
- 論文タイトル
- Structure of the miniature type V-F CRISPR-Cas effector enzyme
- 著者
- Satoru N. Takeda1, Ryoya Nakagawa1, Sae Okazaki1,2, Hisato Hirano1, Kan Kobayashi1,3, Tsukasa Kusakizako1, Tomohiro Nishizawa1, Keitaro Yamashita1,4, Hiroshi Nishimasu1,2,*, Osamu Nureki1,*
- 東京大学大学院理学系研究科
- 現在:東京大学先端科学技術研究センター
- 現在:ペプチドリーム株式会社
- 現在:MRC Laboratory of Molecular Biology
- *責任著者
- DOI番号
- 10.1016/j.molcel.2020.11.035
用語解説
- (注1)CRISPR-Cas酵素
- 原核生物のもつCRISPR-Cas獲得免疫システムにおいて外来核酸の分解を担う酵素。CRISPR-Cas酵素は6つのタイプ(I–VI型)に分類される。II型CRISPR-Cas酵素Cas9やV型CRISPR-Cas酵素Cas12fはgRNAと複合体を形成し、gRNAと相補的な2本鎖DNAを特異的に切断する。
- (注2)クライオ電子顕微鏡
- 光学顕微鏡では可視光を用いて像を観測するのに対し、クライオ電子顕微鏡では試料を低温下に置き、電子を用いて像を拡大し観測する。電子線の持つ波長は可視光線よりも短いため、光学顕微鏡では見ることが難しい原子レベルの大きさの試料を観測することが可能となる。クライオ電子顕微鏡法は結晶化が難しいタンパク質の構造解析にも有効である。
- (注3)ウイルスベクター
- 目的遺伝子を標的細胞に導入するために利用されるウイルス。アデノ随伴ウイルスなどのウイルスベクターを用いることにより、Cas9やgRNAを目的の組織に導入することができる。
お問い合わせ先
研究に関すること
東京大学大学院理学系研究科生物科学専攻
教授 濡木理(ぬれきおさむ)
TEL:03-5841-4392
E-mail:nureki“AT”bs.s.u-tokyo.ac.jp
報道に関すること
東京大学大学院理学系研究科・理学部 広報室
学術支援職員 吉岡奈々子、教授・広報室長 飯野雄一
TEL:03-5841-8856
E-mail:kouhou.s“AT”gs.mail.u-tokyo.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 先端的バイオ創薬等基盤技術開発事業担当
E-mail:sentan-bio“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和2年12月17日
最終更新日 令和2年12月17日


