自然免疫応答分子STING活性制御機構の解明―自己炎症性疾患治療薬への応用に期待―
プレスリリース
東北大学大学院生命科学研究科
日本医療研究開発機構
発表のポイント
- DNAウイルスに感染すると、自然免疫応答経路の1つであるSTING経路*1が活性化し、自然免疫・炎症応答が生じますが、STINGの異常な活性化はSAVI*2やCOPA異常症*3などの自己炎症性疾患を引き起こします。
- COP-I小胞*4によるSTINGのゴルジ体から小胞体への逆行性輸送が、STING経路の不要な活性化を防いでいることを明らかにしました。
- ウイルス感染時などに産生されるSTINGリガンドはこの機構を阻害することでSTINGのゴルジ体への蓄積を促していることを発見しました。
- SAVIやCOPA異常症では、このSTINGの小胞体における局在の維持機構が破綻することでSTINGが恒常的に活性化してしまっていたことから、STINGの活性化阻害剤がこれらの自己炎症性疾患の治療に有用であることが期待されます。
概要
DNAウイルス感染すると、シグナル伝達経路であるSTING経路が活性化し、I型インターフェロン*5を誘導することで感染防御に寄与します。ウイルス感染時にSTINGが小胞体からゴルジ体へ移動して活性化する分子機構はすでに明らかとなっていましたが、ウイルス感染のない定常状態にSTING経路が活性化しないようにする分子機構は不明でした。今回、東北大学大学院生命科学研究科の向井助教・田口教授らのグループは、ウイルス感染の刺激がない状態でも、STINGが小胞体からゴルジ体へ移動しており、COP-I小胞が常にSTINGをゴルジ体から小胞体へ戻すことでSTINGの活性化を抑制する機構が存在することを明らかにしました。本研究は、定常状態でのSTINGの制御機構、及びその機構の破綻に起因する疾患の分子機構を初めて明らかにした重要な報告です。
本研究成果は、1月4日付でNature Communications誌(電子版)に掲載されます。
詳細な説明
自然免疫応答経路の1つであるSTING経路は、DNAウイルス感染した際に活性化してI型インターフェロンを誘導するシグナル伝達経路です。最近、このSTING経路はウイルスDNAだけでなく自己ゲノムDNAやミトコンドリアDNAにも応答すること(DNA刺激による応答)が明らかになり、腫瘍免疫応答において重要な役割を果たすことや、自己炎症性疾患、老化性炎症、パーキンソン病、ハンチントン病、筋萎縮性側索硬化症における炎症病態に寄与することが報告され、非常に注目されています。これまでのSTING経路の研究は、マウスを用いた病態モデルでの解析が中心であり、細胞内でのSTINGの活性制御機構に迫った研究は限られていました。
これまでに、東北大学大学院生命科学研究科の向井助教・田口教授らのグループはDNAウイルス感染時のSTING経路の活性化機構を解析し、DNAウイルス感染に伴ってSTINGが小胞体からゴルジ体へ移行すること、及びゴルジ体でSTINGがパルミトイル化されて下流シグナルが活性化することを明らかにしてきました(Mukai et al., Nat Commun 2016; Ogawa et al., BBRC 2018; Hansen et al., PNAS 2018)。今回、ウイルス感染がない定常状態でのSTINGの制御機構を解析したところ、DNA刺激がない状態においてSTINGが活性化しないように積極的に小胞体に留める機構が存在することを、マウスの胎児線維芽細胞を用いた実験によって発見しました。
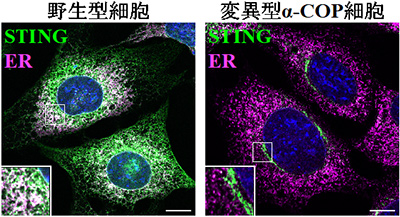
COP-I小胞輸送は、ゴルジ体から小胞体への物質輸送を担う膜輸送経路として知られています。このCOP-I小胞輸送を阻害すると、DNA刺激がない状態でもSTINGがゴルジ体に蓄積し(図1)、炎症応答が惹起されました。このことから、普段からDNA刺激がない状態でもSTINGは小胞体からゴルジ体へ移動しており、それを上回るスピードでCOP-I小胞輸送がSTINGを小胞体に戻すことでゴルジ体に蓄積することを防ぐ機構が存在することが示唆されました。興味深いことに、STINGのリガンドであるcGAMP*6で刺激した細胞や、STINGが恒常的に活性化するSAVIやCOPA異常症の細胞の中では、STINGのCOP-I小胞輸送が阻害されることでSTINGがゴルジ体に蓄積し、炎症応答が誘導されることが分かりました。以上の結果から、SAVIやCOPA異常症の病態発症の分子機構と、腫瘍免疫療法において非常に着目されているSTINGリガンドの細胞内での役割が明らかとなりました。今後、STINGのゴルジ体―小胞体間輸送制御機構やゴルジ体でのSTINGの活性化機構が、上述の疾患の創薬標的となることが期待されます。
本研究は日本医療研究開発機構(AMED)革新的先端研究開発支援事業(PRIME)「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」研究開発領域(研究開発総括:横山信治)における研究開発課題「細胞内小器官特異的脂質環境が制御するシグナル伝達とその破綻に起因する疾患の分子機構の解明」(研究開発代表者:田口友彦)及び文部科学省科学研究費補助金(19H00974、20H05307、20H03202)の支援を受けて行われました。
用語説明
- *1 STING経路:
- Stimulator of interferon genesの略。小胞体に局在する4回膜貫通型タンパク質で、細胞質DNAの出現に反応してゴルジ体へ移動し、自然免疫・炎症応答を活性化する。ゴルジ体で活性化したSTINGは、TBK1(キナーゼ)、IRF3(転写因子)をリクルートし、TBK1によってリン酸化されたIRF3がI型インターフェロンを産生する。この一連の経路をSTING経路と呼ぶ。
- *2 SAVI:
- STING-associated vasculopathy with onset in infancyの略称であり、STINGの点変異に起因する常染色体顕性の遺伝性自己炎症性疾患。SAVI型の恒常活性化体のSTINGが発現してしまうことで、恒常的なI型インターフェロンの産生、全身性の炎症、特に皮膚炎、間質性肺炎を呈する。
- *3 COPA異常症:
- COP-I複合体のαサブユニットであるα-COP(遺伝子名:COPA)の点変異に起因する常染色体顕性の遺伝性自己炎症性疾患。恒常的なI型インターフェロンの産生、間質性肺炎を呈する。
- *4 COP-I小胞:
- ゴルジ体から小胞体への輸送を担う輸送小胞。COP-I小胞は、7種類の異なるタンパク質サブユニット(α, β, β', γ, δ, ε, ζ)から構成されるコートタンパク質複合体が小胞を形成する。αサブユニットであるα-COP(遺伝子名:COPA)はCOPA異常症の原因遺伝子である。
- *5 I型インターフェロン:
- ウイルス感染時に誘導される抗ウイルス応答を担うサイトカイン。
- *6 cGAMP:
- 細胞質に2本鎖DNAが出現すると、サイクリックGMP-AMP合成酵素が活性化し、セカンドメッセンジャーであるcGAMP(cyclic GMP-AMP)を生成する。cGAMPはSTINGに直接結合し、STING経路を活性化する。抗原提示細胞(樹状細胞)内でのSTING経路の活性化は腫瘍免疫応答に必要であるため、cGAMPやcGAMPアナログは腫瘍免疫応答を活性化する創薬シーズとして注目されている。
研究手法
本研究では、STINGノックアウトマウス由来の胎児線維芽細胞にGFPタグを付加したSTINGを発現させ、STINGの細胞内局在と下流シグナルの活性化の関係を、超解像度顕微鏡などを用いて評価しました。
論文題目
- 題目
- Homeostatic regulation of STING by retrograde membrane traffic to the ER
- 著者
- Kojiro Mukai, Emari Ogawa, Rei Uematsu, Yoshihiko Kuchitsu, Fumika Kiku, Takefumi Uemura, Satoshi Waguri, Takehiro Suzuki, Naoshi Dohmae, Hiroyuki Arai, Anthony K. Shum, Tomohiko Taguchi
- 筆頭著者情報
- 氏名:向井 康治朗
- 所属:東北大学 大学院生命科学研究科 脳生命統御科学専攻
- 細胞ネットワーク講座 細胞小器官疾患学分野
- 雑誌
- Nature Communications
- DOI
- 10.1038/s41467-020-20234-9
お問い合わせ先
研究に関すること
東北大学大学院生命科学研究科
担当:田口 友彦(たぐち ともひこ)
電話番号:022-795-6676
Eメール:tomohiko.taguchi.b8”AT”tohoku.ac.jp
報道に関すること
東北大学大学院生命科学研究科広報室
担当:高橋 さやか(たかはし さやか)
電話番号:022-217-6193
Eメール:lifsci-pr”AT”grp.tohoku.ac.jp
AMEDの事業に関すること
国立研究開発法人日本医療研究開発機構
シーズ開発・研究基盤事業部 革新的先端研究開発課
Eメール: kenkyuk-ask”AT”amed.go.jp
※Eメールは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年1月5日
最終更新日 令和3年1月5日


