プレスリリース ウイルスのRNAを感知するToll様受容体と輸送に関与するUNC93B1との複合体構造の解明
プレスリリース
東京大学
理化学研究所
日本医療研究開発機構
発表者
石田英子(東京大学大学院薬学系研究科 特任研究員)
浅見仁太(東京大学大学院薬学系研究科 博士課程1年)
張志寛(東京大学大学院薬学系研究科 助教)
西澤知宏(東京大学大学院理学系研究科 准教授)
重松秀樹(理化学研究所放射光科学研究センター 研究員)
大戸梅治(東京大学大学院薬学系研究科 准教授)
清水敏之(東京大学大学院薬学系研究科 教授)
発表のポイント
- 自然免疫受容体のToll様受容体(TLR)のうち、ウイルスや細菌の核酸を認識するTLR3およびTLR7とそれらをエンドソームに運ぶタンパク質UNC93B1との複合体の構造を解明しました。
- 核酸認識TLRが正しく機能を発揮するために重要な、TLRのエンドソームへの移行プロセスの一段階を可視化することに成功しました。
- TLR3およびTLR7の関与する自己免疫疾患に対する新たな治療薬の開発に役立つと期待されます。
発表概要
自然免疫系は、ウイルスや細菌などの病原体が体内に侵入してきたときに、これらを感知し速やかに免疫機能を活性化させ、インターフェロン(注1)などの抗ウイルス分子の産生を促します。Toll様受容体(TLR)は自然免疫系において病原体由来の分子を認識するセンサーとして働きます。中でもTLR3、7、8、9はウイルスや細菌由来の核酸(DNAやRNA)を認識することが知られています。我々の生体内には自らの核酸が多く存在するため、自己由来の核酸を認識することによる誤った免疫応答を避けるために、これらのTLRは細胞中で存在する場所を厳密に制御される必要があります。UNC93B1はこれら核酸認識TLRと結合し、TLRを細胞内の適切な場所に運ぶ役割を果たすことが報告されています。しかしながら、TLRとUNC93B1の詳細な相互作用様式はこれまで明らかになっていませんでした。
東京大学大学院薬学系研究科の石田英子特任研究員、浅見仁太大学院生、張志寛助教、大戸梅治准教授、清水敏之教授、および東京大学大学院理学系研究科、理化学研究所の研究グループはクライオ電子顕微鏡(Cryo-EM)(注2)を用いて、TLR3-UNC93B1複合体およびTLR7-UNC93B1複合体の立体構造を明らかにしました。その結果、TLRとUNC93B1は主に互いの膜貫通領域を介して結合していることが示されました。TLRによる自己由来の核酸の認識は、関節リウマチや全身性エリテマトーデスなどの自己免疫疾患につながることが知られています。この研究により、核酸認識TLRが正しく機能を発揮するための重要なステップが明らかになったことから、新たな自己免疫疾患の治療薬の開発が進むことが期待されます。
発表内容
研究の背景
自然免疫系は、私たちの身体に先天的に備わる防御システムであり、体内に侵入してきたウイルスや細菌などの病原体を感知し排除する役割を持っています。Toll様受容体(TLR)は、これら病原体に特徴的な構造(分子パターン)を見分けるセンサーとして働きます。TLRの認識する分子パターンはさまざまありますが、TLR3、7、8、9は病原体由来の核酸(DNAやRNA)を認識するTLRとして一群のファミリーを形成しています。核酸分子は微生物からヒトに至るまで普遍的な構造であるため、これら核酸認識TLRは、エンドソームとよばれる細胞外の物質を取り込んだ小区画内にのみ存在し、核や細胞質に存在する自己由来の核酸からは隔離される必要があります。UNC93B1はこれらTLRの小胞体からエンドソームへの移行に関わっていることが知られていました。しかし、TLRとUNC93B1の結合様式はこれまで明らかになっていませんでした。
研究内容
本研究グループは、TLRとUNC93B1の相互作用様式を明らかにするために、TLRとUNC93B1を共発現させた培養細胞から、TLR3-UNC93B1およびTLR7-UNC93B1の安定な複合体を得ることに成功しました。得られた複合体は東京大学のクライオ電子顕微鏡を用いて、それぞれ3.4Åおよび4.2Åの分解能で構造解析しました。構造解析の結果、TLR3とUNC93B1は1:1の複合体を形成しており、UNC93B1の12本の膜貫通ヘリックスのうち、主に3本目と6本目のヘリックスがTLR3の膜貫通ヘリックスと相互作用していることが分かりました(図1)。一方で、TLR7はUNC93B1と2:2の複合体を形成していました(図2)。TLR7もTLR3と同様の膜貫通ヘリックスを介した相互作用によりUNC93B1と結合していました。これに加えてTLR7-TLR7およびUNC93B1-UNC93B1の間の相互作用も確認され、これにより2:2複合体を形成していると考えられました(図2)。今回の結果により、TLRとUNC93B1の相互作用が明らかになり、一部のTLRがUNC93B1により輸送される機構の一端が明らかになりました。
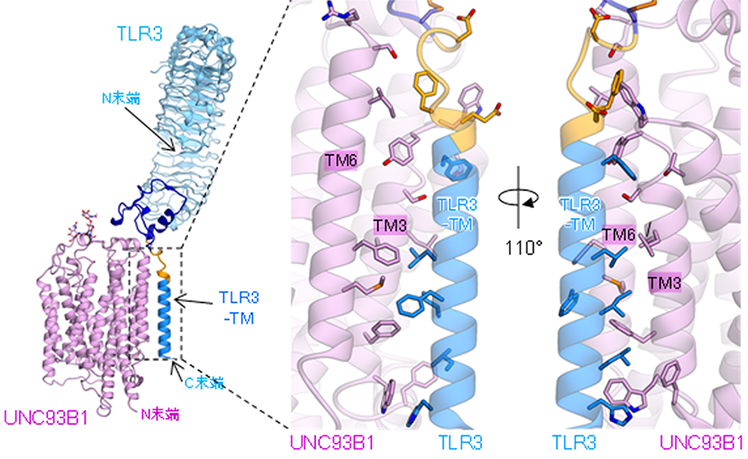
(右図)膜貫通領域でのTLR3とUNC93B1の相互作用部位の拡大図。
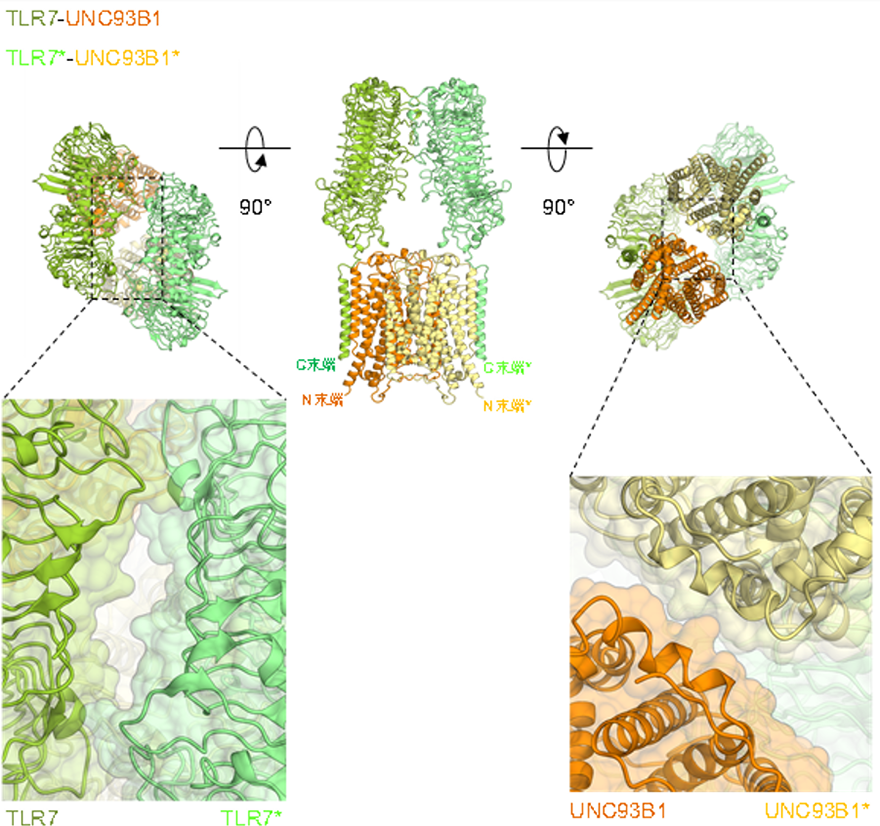
UNC93B1の構造はこれまで明らかになっていませんでしたが、興味深いことに、MFS型輸送体(注3)とよばれるさまざまな分子の輸送に関わるトランスポーターファミリーと非常によく似た構造であり、UNC93B1の分子中央に空洞が観察されました。これまでUNC93B1のトランスポーターとしての活性は報告されていませんが、この部位が何らかの機能的役割を果たす可能性が考えられます。
TLRはリガンドの結合に伴って活性化型の二量体を形成し免疫応答を促進します。今回得られたTLR3-UNC93B1複合体の構造をTLR3の細胞外ドメインの活性化型二量体の構造と重ね合わせてみると、TLR3に結合したUNC93B1同士が衝突することが示されました(図3)。したがって、今回得られた構造から、TLR3が活性化する際にはUNC93B1が解離するという機構が考えられます。
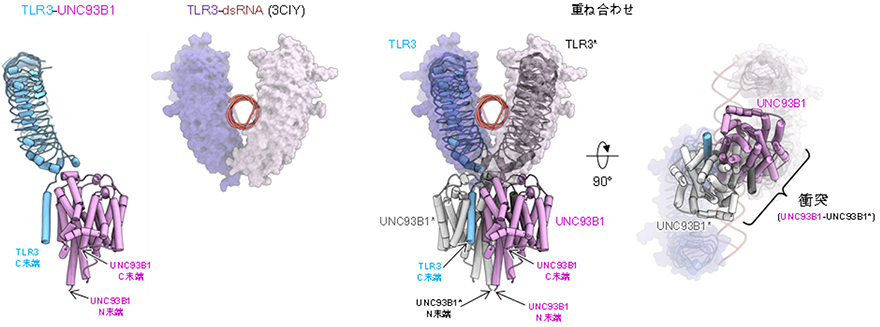
今後の展開
TLRはヒトでは10種類報告されており、それぞれ異なる分子パターンを認識します。これにより自然免疫は多種多様な病原体の侵入に対して迅速な免疫応答を可能にしています。一方で、TLRの制御機構の破綻は健常な組織を傷つけ個体の生命を脅かす危険性があります。本研究によって、核酸認識TLRが自己の核酸から隔離され正しい認識の場へ送られるために重要な複合体の構造が明らかになりました。本研究に基づき、今後自己免疫疾患の新規治療法や予防法の開発が進むことが期待できます。
本研究は、日本学術振興会科学研究費助成事業、日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業(BINDS)JP20am0101070」などの支援により行われました。
発表雑誌
- 雑誌名
- Nature Structural & Molecular Biology
- 論文タイトル
- Cryo-EM structures of Toll-like receptors in complex with UNC93B1
- 著者
- 石田英子*、浅見仁太、張志寛、西澤知宏、重松秀樹、大戸梅治†、清水敏之†(*筆頭著者、†責任著者)
- DOI番号
- 10.1038/s41594-020-00542-w
- アブストラクトURL
- https://www.nature.com/articles/s41594-020-00542-w
用語解説
- (注1)インターフェロン
- 細菌やウイルスなどの病原体の侵入に対して免疫系の細胞が分泌するタンパク質で、ウイルスの増殖を抑制する作用や免疫系を活性化する作用を発揮する。
- (注2)クライオ電子顕微鏡
- 透過型電子顕微鏡法の一種で、試料を低温状態で測定する。近年著しい発展を遂げ、特に単粒子解析法によりタンパク質の立体構造を高分解能で決定する手法として広く使われてきている。
- (注3)MFS型輸送体
- MFS(major facilitator superfamily)は最大級のメンバーを持つ典型的な輸送体ファミリーであり、有機および無機アニオンや代謝産物など様々な輸送体がある。促進拡散あるいはイオンに共役する能動輸送の形式をとる。
お問い合わせ先
東京大学大学院薬学系研究科
准教授 大戸梅治(おおとうめはる)
電話:03-5841-4842 FAX:03-5841-4891
E-mail:umeji“AT”mol.f.u-tokyo.ac.jp
教授 清水敏之(しみずとしゆき)
電話:03-5841-4840 FAX:03-5841-4891
E-mail:shimizu“AT”mol.f.u-tokyo.ac.jp
東京大学大学院 薬学系研究科 蛋白構造生物学教室
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)
電話:03-6870-2219 FAX:03-6870-2244
E-mail:20-ddlsg-16“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年1月12日
最終更新日 令和3年1月12日


