プレスリリース 環状ペプチドは立体構造を変えて細胞に入る―中分子ペプチド医薬のデザイン・発展に貢献する新発見―
プレスリリース
理化学研究所
日本医療研究開発機構
理化学研究所(理研)生命機能科学研究センター生体分子動的構造研究チームの嶋田一夫チームリーダーらの共同研究グループ※は、溶液核磁気共鳴(NMR)法[1]を用いた立体構造解析により、中分子[2]環状ペプチドCyclorasin[3]の細胞内移行性を決める要因が、溶媒環境に応じて構造を変化させる立体的な柔軟性であることを解明しました。
本研究成果は、新たな創薬モダリティ[4]として注目される中分子を医薬として活用する際に、細胞内への移行性がより高く、より活性の強い分子構造をデザインし、創薬の幅を広げることに貢献します。
今回、共同研究グループは、抗がん標的であるRasタンパク質[5]の阻害活性を持ち、配列が互いに類似しているにもかかわらず細胞内移行性が大きく異なる環状ペプチド群について、溶液NMR法を用いた立体構造解析を行いました。水溶液中の立体構造と、細胞膜の表面を模倣する有機溶媒中での立体構造を比較した結果、細胞内に移行できる環状ペプチドは、溶媒環境に応じて柔軟に立体構造を変化させ、有機溶媒中で細胞内移行に有利な両親媒性[6]構造を形成する一方、細胞内に移行できないペプチドは、連続したかさ高いアミノ酸残基[7]側鎖同士の立体的な障害により、同様の構造変化を起こせないことが分かりました。このことは、溶媒環境に応じた立体構造的な柔軟性が、環状ペプチドの細胞内移行性を左右する重要な構造要素であることを示しています。
本研究は、科学雑誌『Angewante Chemie International Edition』オンライン版(2021年2月16日付)に掲載されます。
- ※共同研究グループ
- 理化学研究所 生命機能科学研究センター 生体分子動的構造研究チーム
チームリーダー 嶋田一夫(しまだいちお)
産業技術総合研究所 細胞分子工学研究部門 動的創薬モダリティ研究グループ
研究グループ長 竹内恒(たけうちこう)
研究員 徳永裕二(とくながゆうじ)
バイオ産業情報化コンソーシアム
研究員 今井美咲(いまいみさき)
研究員 鴨志田一(かもしだはじめ)
研究員 藤崎美和(ふじさきみわ)
第一三共RDノバーレ株式会社
構造化学グループ長 半沢宏之(はんざわひろゆき)
副主任研究員 滝沢剛(たきざわたけし) - 研究支援
- 本研究は、日本医療研究開発機構(AMED)「次世代治療・診断実現のための創薬基盤技術開発事業」(革新的中分子創薬技術の開発)および日本学術振興会(JSPS)科学研究費補助金特別推進研究「核磁気共鳴法による膜タンパク質のin situ機能解明(研究代表者:嶋田一夫)」、同挑戦的研究(萌芽)「中分子の膜透過を評価し膜透過活性を付与する創薬基盤技術の構築(研究代表者:竹内恒)」の支援によって行われました。
背景
現在、創薬においては、数少ない創薬標的分子[8]をめぐって各製薬企業が激しい競争を展開しています。これは、従来の低分子を中心とした創薬では、医薬品創出につながる標的タンパク質が枯渇してきていることに一因があります。したがって今後、創薬標的の枯渇を解消し、医療をさらに充実させるためには、従来の低分子では狙えなかった標的分子、特に細胞内のシグナル伝達[5]を担うタンパク質-タンパク質相互作用(PPI)[9]標的にできる新たな創薬モダリティの確立が必要です。
環状ペプチドやマクロライドなどの環状中分子は、標的分子上の広い範囲を認識できるため、高いPPI阻害活性を示す新しい創薬モダリティとして注目されています。しかし、一部の環状ペプチドについて細胞内に移行してPPI阻害活性を示したとの報告がある一方、その多くはほとんど細胞内移行性を持たないことも知られています。そのため、中分子医薬の発展には、環状ペプチドの細胞内移行性を決定する要因を明らかにし、細胞内移行性を高める論理的な設計を行うことが求められています。
研究手法と成果
今回、共同研究グループは、環状ペプチドの細胞内移行性を検証するモデルとして、抗がん活性を示すことが知られている環状ペプチド群Cyclorasinに着目しました。Cyclorasinは、細胞内シグナル伝達因子であるRasタンパク質とRafタンパク質[5]のPPIに対する阻害活性を持ち、細胞内に移行することでその作用を示します。
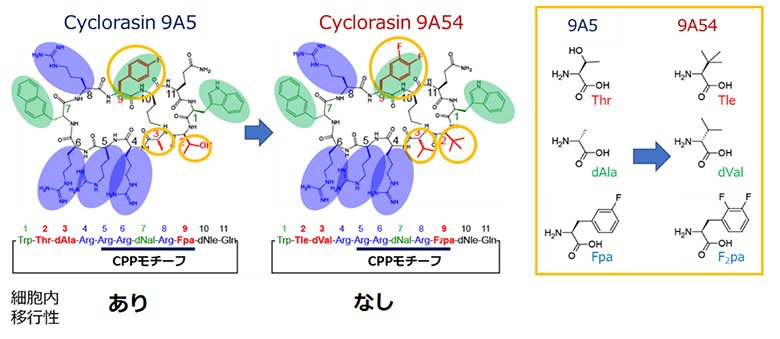
Cyclorasinのうち、11残基[7]で構成される環状ペプチドであるCyclorasin 9A5と9A54は、細胞内移行性に寄与する細胞透過ペプチド(CPP)モチーフ[10]や、細胞膜透過性を促進すると見られる芳香族残基[7]と塩基性残基[7]が共通しています(図1)。また、異なる三つの残基については、疎水的な性質の高いTle(ターシャリーロイシン)[11]、dVal(D-バリン)[11]、F2pa[11](L-3, 4-ジフルオロフェニルアラニン)を持つ9A54の方が、高い細胞内移行性を示すと期待されました(図1)。しかし、実際は9A5のみが細胞内移行性を示し、この要因は全く明らかでありません。
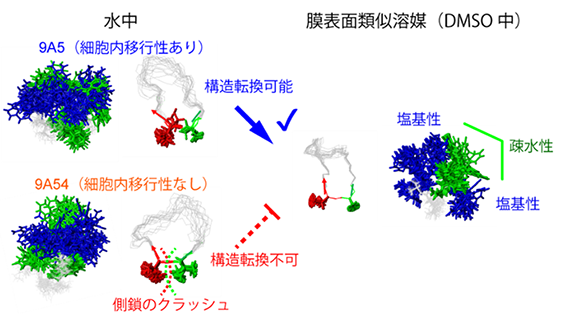
本研究では、9A5と9A54の細胞内移行性の違いについて、構成する残基の個々の性質だけでは分からない立体構造上の特徴に要因があると考え、それぞれの立体構造を、溶液核磁気共鳴(NMR)法を用いて明らかにすることを試みました。立体構造解析にあたっては、水溶液中の構造だけではなく、細胞膜の表面を模倣する環境として有機化合物ジメチルスルホキシド(DMSO)を溶媒とする溶液中での解析も行いました。
その結果、両者の立体構造中における、芳香族からなる疎水性残基と塩基性残基の分布は水中では大きく異ならないものの(図2左)、DMSO中では、9A5のみ、その構造が大きく変化することが明らかになりました(図2右)。9A5のDMSO中の構造は、片側に芳香族残基が集まり、芳香族残基の周囲に複数の塩基性残基が配置される両親媒性構造となっており、このような構造は、細胞内移行性に有利であることが知られています。
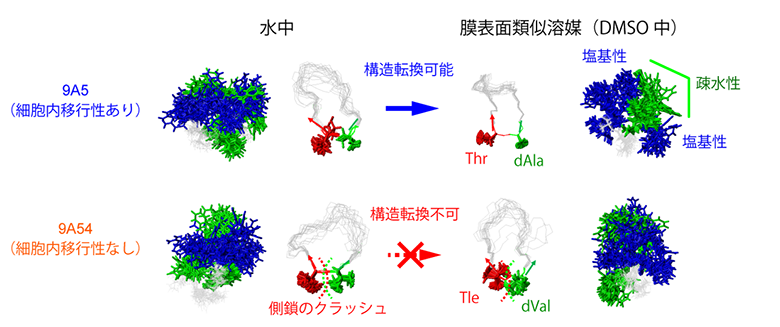
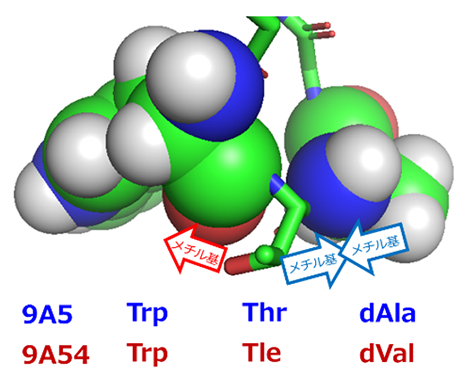
9A5と9A54のDMSO中での構造を配列の異なる部位を中心として比較すると、9A5は残基番号2のThr[11](スレオニン)、残基番号3のdAla[11](D-アラニン)を頂点としたよりタイトなターン構造(折れ曲がり構造)を形成していることが分かりました(図2A右、図3)。9A5はこのことにより、コンパクトな両親媒構造を形成していました。一方、9A54の残基番号2、3は、側鎖がよりかさ高い残基(Tle、dVal)となっています。そのため、9A5と同様の構造を9A54が形成しようとしても、立体障害を起こしてしまいターン構造は取りえないことが分かりました(図3矢印)。
さらに、既に報告のあるCyclorasin群について、残基番号2、3の側鎖のかさ高さと細胞内移行性の関係を検討したところ、両者が逆相関を示すことが明らかになりました(図4)。このうち2種のペプチド9A12と9A44dについて追加の立体構造解析を行うと、9A5と同等の細胞内移行性を示す9A12が構造転換できるのに対して、細胞内移行性のない9A44dは構造転換を起こせないことも確認できました(図4)。
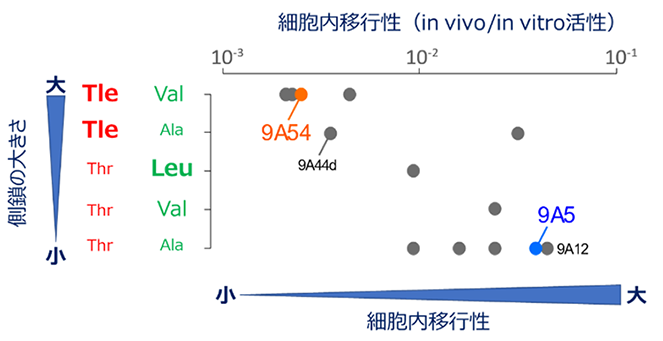
以上の結果から、Cyclorasin群の一部が細胞内移行性を示せない要因は、連続したアミノ酸残基の側鎖の立体障害により細胞内移行性を示す構造への転換が妨げられることにあることが分かりました。これは、溶媒環境に応じた柔軟な構造変化が、環状ペプチドの細胞内移行性を左右する重要な要素であることを示します。
今後の期待
本研究により、環状ペプチドの細胞内移行性が、溶媒環境に応じた柔軟な構造変化により実現されることが明らかとなりました。このことは、環状ペプチドの細胞内移行性の予測に、細胞膜表面を模倣するDMSOのような溶媒環境を含め、多様な溶媒において立体構造解析を行うことが重要であることを示しています。多様な環境において原子レベルの立体構造解析が行えるNMR法は、その目的の達成に重要な役割を果たします。また、現在、さらにスループットを改善するため、計算機科学的手法により、同様の予測が可能であるかの検討を行っています。
これまで、環状ペプチドの細胞内移行性を改善する試みとして、主鎖構造の改変を行い、ペプチドの全体的な構造を変化させる試みがなされてきました。しかし、今回の結果は、より簡単な側鎖の置換だけで、環状ペプチドに細胞透過活性を付与できる可能性を示しており、本研究の成果は、高い細胞移行性と薬理学的活性を示す中分子医薬のデザインに貢献するものです。
論文情報
- タイトル
- Conformational plasticity of cyclic Ras-inhibitor peptides defines cell permeabilization activity.
- 著者名
- Koh Takeuchi, Imai Misaki, Yuji Tokunaga, Miwa Fujisaki, Hajime Kamoshida, Takeshi Takizawa, Hiroyuki Hanzawa, and Ichio Shimada
- 雑誌
- Angewandte Chemie International Edition
- DOI
- 10.1002/anie.202016647
補足説明
- [1]溶液核磁気共鳴(NMR)法
- 水溶液に溶けたタンパク質などを、強力な磁場の中に置くことで生じる「原子の共鳴現象」を観測することで、溶液中のタンパク質などの分子の構造や運動性を原子レベルで調べることができる分光法。製薬だけでなく、食品、材料、化学などさまざまな分野で活用されている。NMR はNuclear Magnetic Resonanceの略。
- [2]中分子
- 従来の医薬品に用いられてきた低分子と、抗体などの高分子の中間に位置付けられ、分子量が数百から数千程度の領域にあるものを中分子と呼ぶ。タンパク質-タンパク質相互作用のように広い相互作用面を標的とすることが可能である。
- [3]環状ペプチド、Cyclorasin
- 環状ペプチドは、通常のペプチドと異なり、N末端とC末端がアミド結合を形成することにより環化したペプチド。中でも中分子と呼ばれる分子量500~2000程度の環状ペプチドが、膜移行性を示すことが多く、新たな創薬モダリティとして注目されている。Cyclorasinは2016年に米国の研究グループが発表した環状ペプチドで、cyclic Ras inhibitor(環状のRas阻害剤)にちなんで名付けられた。
- [4]創薬モダリティ
- 創薬を進める上での分子種。低分子や中分子医薬のほか、抗体医薬、核酸医薬、細胞医薬など。
- [5]Rasタンパク質、シグナル伝達、Rafタンパク質
- 分泌因子などの刺激で細胞が増殖・分化する際、細胞外刺激が細胞内に伝えられることをシグナル伝達と呼ぶ。シグナル伝達の実体は、細胞膜上の受容体タンパク質から細胞内のタンパク質を経て、核内のタンパク質に連鎖的に活性化反応(主としてタンパク質のリン酸化)が起きることである。Rasタンパク質は細胞質側の細胞膜付近で機能し、タンパク質リン酸化酵素であるRafタンパク質を活性化する。ヒトのRasタンパク質をコードするKRASやNRASは、代表的ながん遺伝子として知られる。
- [6]両親媒性
- 水に溶けやすい性質(親水性)と溶けにくい性質(疎水性)の両方を兼ね備えていること。細胞膜を構成する脂質は両親媒性分子であり、中分子が両親媒性であることは細胞膜透過に有利となる場合が多い。
- [7]アミノ酸残基、残基、芳香族残基、塩基性残基、疎水性残基
- 単分子として存在するアミノ酸に対し、タンパク質やペプチド中のアミノ酸は、アミノ酸残基または単に残基と呼ばれる。残基の性質はアミノ酸の側鎖で決まり、芳香族の側鎖を持つ芳香族残基、塩基性の側鎖を持つ塩基性残基、疎水性の側鎖を持つ疎水性残基などと呼ばれる。
- [8]創薬標的分子
- 多くの医薬分子は、疾患を引き起こす変異タンパク質や、病原菌・ウイルス由来分子を標的に結合し、その機能を制御することで薬効を示す。このような結合場所が見つかる可能性の高いタンパク質が医薬品創出につながる創薬標的分子といえるが、従来の低分子を中心とした創薬では、タンパク質の活性化部位などの標的部位の探索が困難になりつつある。
- [9]タンパク質-タンパク質相互作用(PPI)
- タンパク質間の相互作用のこと。ヒトの細胞には13~65万のタンパク質相互作用があることが知られており、それらは病態とも深く関わっている魅力的な創薬標的を多く含む。タンパク質間相互作用の阻害活性を持つ分子(PPI阻害剤)は新たな医薬品候補であるが、これまでに確立したPPI阻害剤は30種程度にとどまっている。PPIはprotein-protein interactionの略。
- [10]細胞透過ペプチド(CPP)モチーフ
- タンパク質は本来細胞膜を透過しにくいが、一部のタンパク質は細胞内透過能を持つ。細胞透過ペプチド(CPP)モチーフは、それらのタンパク質で、細胞内透過に重要な領域として見つかった配列であったが、現在では合成ペプチドを含め多くのCPPモチーフが報告されている。CPPはcell-penetrating peptideの略。
- [11]Tle、dVal、F2pa、Thr、dAla
- 環状ペプチドの合成では、天然のタンパク質を構成する20種類以外のアミノ酸を導入することができる。Tle、dVal、F2pa、dAlaはそれぞれ、ターシャリーロイシン、D-バリン、L-3,4-ジフルオロフェニルアラニン、D-アラニンを指し、疎水性の強さは、Tle>Thr(スレオニン)、dVal>dAla、F2pa>Fpa(L-4-フルオロフェニルアラニン)となる。
発表者・機関窓口
発表者
理化学研究所 生命機能科学研究センター 生体分子動的構造研究チーム
チームリーダー 嶋田一夫(しまだいちお)
生命機能科学研究センターに関する問い合わせ
理化学研究所 生命機能科学研究センター センター長室 報道担当
山岸敦(やまぎしあつし)
E-mail:ayamagishi“AT”riken.jp
機関窓口
理化学研究所 広報室 報道担当
E-mail:ex-press“AT”riken.jp
*今般の新型コロナウイルス感染症対策として、理化学研究所では在宅勤務を実施しておりますので、メールにてお問い合わせ願います。
事業に関すること
国立研究開発法人日本医療研究開発機構
創薬事業部 医薬品研究開発課
次世代治療・診断実現のための創薬基盤技術開発事業担当
E-mail:jisedai-med“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年2月16日
最終更新日 令和3年2月16日


