免疫の個人差をつかさどる遺伝子多型の機能カタログを作成―多様な免疫細胞ごとの違いと疾患による修飾が明らかに―
プレスリリース
理化学研究所
科学技術振興機構
日本医療研究開発機構
発表者
太田 峰人 (東京大学大学院医学系研究科 免疫疾患機能ゲノム学講座 特任助教)
永渕 泰雄 (東京大学大学院医学系研究科 免疫疾患機能ゲノム学講座 特任助教)
岡村 僚久 (東京大学大学院医学系研究科 免疫疾患機能ゲノム学講座 特任准教授)
藤尾 圭志 (東京大学大学院医学系研究科 生体防御腫瘍内科学講座/東京大学医学部附属病院 アレルギー・リウマチ内科 教授)
山本 一彦 (理化学研究所 生命医科学研究センター センター長)
発表のポイント
- 日本人の免疫疾患患者および健常人の末梢血から分取した28種類の免疫細胞の遺伝子発現を定量化し、遺伝子多型が遺伝子発現に与える影響をカタログ化しました。このカタログを用いて、さまざまな免疫疾患発症に関わる細胞種や遺伝子を明らかにしました。
- 免疫細胞の種類・症例数および症例の多様性において、過去の報告を大きく上回る遺伝子多型の機能カタログを世界に先駆けて発表しました。
- 本研究の成果は、免疫が関わるさまざまな病態のゲノム研究に応用可能であり、治療標的の同定や病態解明につながることが期待されます。
発表概要
免疫が病態に関わる疾患は自己免疫疾患や自己炎症性疾患など多様にあり、その多くは発症の原因が不明で、難病に分類されます。これまでゲノムワイド関連解析(GWAS、注1)で疾患の発症と関わる多くの遺伝子多型(注2)が同定されてきました。しかし、その多型がどのように疾患発症に関わるかを解明するには、疾患と関わる細胞の遺伝子発現とゲノム配列を組み合わせた大規模なデータベースが必要でした。この度、東京大学の太田峰人特任助教、藤尾圭志教授、理化学研究所の山本一彦センター長、中外製薬株式会社の角田浩行創薬基盤研究部長らの研究グループは、免疫疾患患者および健常人、計416例の末梢血(血管の中を流れる血液)から分取した28種類の免疫細胞9,852サンプルを解析し、過去の報告を大きく上回る規模の遺伝子発現データベースを構築しました。さらに、ゲノム配列との関連を解析し、これらの免疫細胞における遺伝子多型の機能についてのカタログを作成しました。このデータを既報のGWASデータと組み合わせて解析することで、さまざまな免疫疾患と関連する細胞種や遺伝子を明らかにしました。今回作成したカタログは、免疫が関連する疾患・形質の原因解明に役立つものと考えられます。また、ゲノム機能のデータベースは、これまで欧米人主体に作成されてきましたが、アジア人とのゲノム構造の違いが課題となっていました。本研究により日本発のカタログを作成したことで、アジア人を対象としたゲノム研究の発展や、欧米人のデータとの統合解析によるゲノム機能の詳細な解明に役立つことが期待されます。
なお本研究は、中外製薬株式会社との共同研究費、国立研究開発法人科学技術振興機構(JST)研究成果展開事業 共創の場形成支援(センター・オブ・イノベーション(COI)プログラム)、国立研究開発法人日本医療研究開発機構(AMED)難治性疾患実用化研究事業、免疫アレルギー疾患実用化研究事業の支援により行われ、日本時間4月30日に米国科学誌『Cell 』(オンライン版)に掲載されます。
発表内容
(1)研究の背景
ゲノム研究は、疾患の発症原因に迫ることができる重要なアプローチです。これまで、さまざまな疾患に対してGWASが行われ、疾患発症に関わる多くの遺伝子多型(疾患感受性多型)が同定されてきましたが、特に成人で発症する多因子疾患では、疾患感受性多型の多くがタンパク質を直接コードする領域ではなく、遺伝子の発現量を制御する領域に位置することが分かってきました。この遺伝子発現制御領域は、細胞種や環境によってその役割や活性の強さが大きく異なります。そのため、疾患と関連した細胞種や環境において、これらの遺伝子多型が遺伝子発現にどのような影響を及ぼすかを理解することは、疾患発症のメカニズムを解明する上で非常に重要となります。そこで、本研究グループは、免疫疾患の病態解明のためには、免疫細胞における遺伝子多型の機能を詳細に理解することが重要と考え、大規模な免疫細胞のeQTL (expression quantitative trait loci:遺伝子の発現量の個人差と関連するゲノム領域、注3)データベースを作成しました。eQTL解析は遺伝子多型と遺伝子発現の関連解析で、ある遺伝子多型があった時に、どの細胞種における、どの遺伝子の発現量を上げるのか、または下げるのか、という情報(eQTL効果量)が得られます(図1)。さらに、eQTLデータをGWASデータと組み合わせて解析することで、疾患の発症に重要な細胞や遺伝子を同定することができます。
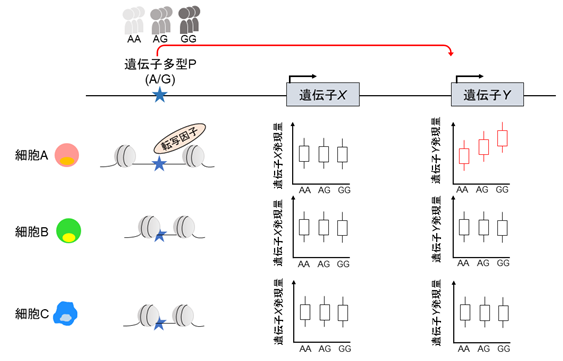
(2)研究の内容
本研究では、免疫疾患のうち、代表的な10疾患の患者および健常人、計416例の末梢血から、28種類に及ぶ免疫細胞9,852サンプルをセルソーター(注4)で分取し、RNAシーケンス(注5)で遺伝子発現量を解析しました(図2)。さらに、全ゲノムシーケンス(注6)で得られたゲノム情報と遺伝子発現量の関連解析を行うことで(図2)、28種類の免疫細胞のeQTLカタログ『ImmuNexUT』(Immune cell gene expression atlas from the University of Tokyo)を作成しました。本データベースは論文発表に合わせウェブ上で公開します(https://www.immunexut.org/)。ImmuNexUTは、これまで報告のあった免疫細胞のeQTLデータを細胞の種類や症例数において大きく上回り、詳細な遺伝子多型の機能(ゲノムの個人差が免疫の個人差に与える影響)についての解析を可能としました。
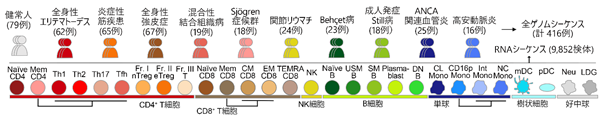
実際にImmuNexUTのeQTLデータを、これまでに報告されている免疫細胞のオープンクロマチン領域(注7)やエンハンサー領域(注8)といったエピゲノム(注9)データと比較すると、対応する細胞種同士において遺伝子発現制御領域が良く一致することが分かりました。このことから、28種類に細かく分けた免疫細胞がそれぞれ異なる遺伝子発現制御メカニズムを持っていて、ImmuNexUTはその違いを反映できていることが示唆されました。また、免疫細胞は外部からの刺激やシグナルに応じて、遺伝子発現が精緻に制御されていますが、本研究では、さまざまな炎症状態にある患者の検体を解析することで、生体内の環境に応じてeQTL効果量が変化する様子を、各免疫細胞単位で初めて明らかにしました(図3)。
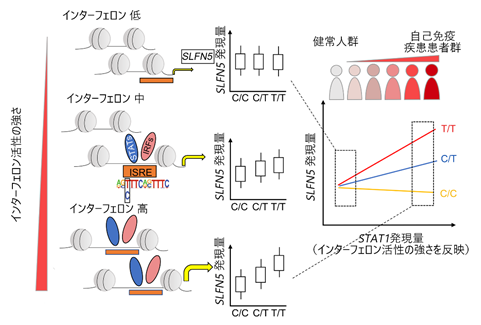
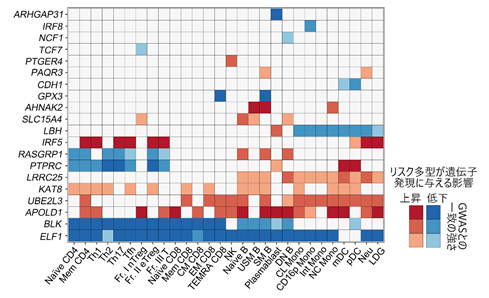
次に、GWASとImmuNexUTを組み合わせた解析では、まずLDスコア回帰法(注10)を用いて全ゲノムの遺伝情報と細胞種に特異的なeQTLの関連を解析することで、さまざまな免疫疾患の発症に、それぞれ異なる免疫細胞が関わる様子を明らかにしました(図4)。さらに、詳細にGWASとeQTLのシグナルの一致を評価し、疾患発症に関与する遺伝子を同定するには、ゲノム構造が類似したデータ同士を比較することが有効です。そこで、これまで報告された日本人の全身性エリテマトーデス(注11)のGWASデータとImmuNexUTのeQTLデータの一致について解析することで全身性エリテマトーデス発症に関わる多くの候補遺伝子と、それに関わる免疫細胞をリスト化しました(図5)。これらの中には、細胞種に特異的なeQTL効果を持つものや、細胞種によって逆向きのeQTL効果を持つものがあり、細胞種を精密に分けたeQTLカタログが病態の理解に役立つことを示唆しています。
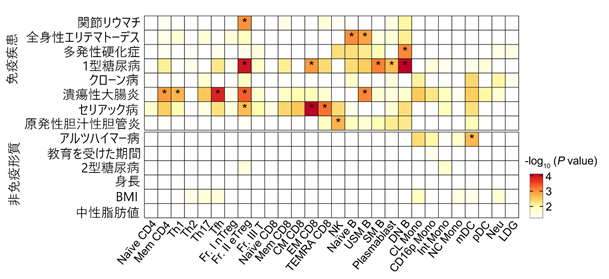
(3)社会的意義と今後の予定
免疫細胞が関わる病態は免疫疾患、感染症、がんや動脈硬化など多岐にわたります。本研究グループが作成したeQTLカタログをさまざまな疾患・形質のゲノム研究と組み合わせることで、病態に関わる細胞種や遺伝子の同定に役立つことが期待されます。また、これまでゲノム機能のデータベースの多くは欧米人主体に作成されてきましたが、アジア人と欧米人ではゲノムの構造などが異なるため、アジア人のゲノム研究にはアジア人のゲノム機能のデータがより適しています。本研究の成果である日本発のeQTLカタログ『ImmuNexUT』は、アジア人のゲノム研究の発展や、欧米人のデータとの統合解析によるゲノム機能の詳細な解明に役立つことが期待されます。
発表雑誌
- 雑誌名
- Cell(オンライン版:4月30日)
- 論文タイトル
- Dynamic landscape of immune cell-specific gene regulation in immune-mediated diseases
- 著者
- Mineto Ota*, Yasuo Nagafuchi, Hiroaki Hatano, Kazuyoshi Ishigaki, Chikashi Terao,Yusuke Takeshima, Haruyuki Yanaoka, Satomi Kobayashi, Mai Okubo, Harumi Shirai,Yusuke Sugimori, Junko Maeda, Masahiro Nakano, Saeko Yamada, Ryochi Yoshida,Haruka Tsuchiya, Yumi Tsuchida, Shuji Akizuki, Hajime Yoshifuji, Koichiro Ohmura,Tsuneyo Mimori, Ken Yoshida, Daitaro Kurosaka, Masato Okada, Keigo Setoguchi,Hiroshi Kaneko, Nobuhiro Ban, Nami Yabuki, Kosuke Matsuki, Hironori Mutoh,Sohei Oyama, Makoto Okazaki, Hiroyuki Tsunoda, Yukiko Iwasaki, Shuji Sumitomo,Hirofumi Shoda, Yuta Kochi, Yukinori Okada, Kazuhiko Yamamoto, Tomohisa Okamura,Keishi Fujio* (*責任著者)
- DOI番号
- 10.1016/j.cell.2021.03.056
用語解説
- 注1:ゲノムワイド関連解析(Genome wide association study, GWAS)
- 疾患(発症や治療反応性など)や形質(身長や体重など)と遺伝子多型の頻度の関連を、全ゲノム領域において網羅的に検出する解析。疾患や形質で頻度が特に多い(あるいは少ない)遺伝子多型のリストが得られる。
- 注2:遺伝子多型
- DNAの塩基配列が個体間で異なる部位。集団内で比較的高頻度(1%以上)に存在するものを指す。
- 注3:eQTL(expression quantitative trait loci)
- 発現量的形質遺伝子座。遺伝子の発現量の個人差と関連するゲノム領域を指す。また、あるゲノム領域が遺伝子発現量に与える影響をeQTL効果と呼ぶ。
- 注4:セルソーター
- 表面タンパクを蛍光抗体で標識した細胞などを、蛍光を認識して分取する装置。特定の表面タンパクの組み合わせによって、さまざまな細胞種を別々に集めることが可能。
- 注5:RNAシーケンス
- 次世代シーケンサーと呼ばれる一度に大量の塩基配列を読み取ることができる装置を用いて、網羅的に遺伝子の発現量を解析する手法。
- 注6:全ゲノムシーケンス
- 次世代シーケンサーを用いて、網羅的にゲノム配列を解析する手法。
- 注7:オープンクロマチン領域
- DNAがヒストンタンパク質などに巻き付くことで形成するDNA・タンパク質複合体はクロマチンと呼ばれる。活性化した転写制御領域ではクロマチンは開いた状態となり、オープンクロマチン領域と呼ばれる。
- 注8:エンハンサー領域
- 遺伝子の転写量を増大させる作用を持つゲノム領域。エンハンサーへの転写因子の結合を介して、遺伝子発現が制御される。
- 注9:エピゲノム
- ゲノム塩基配列の変化を伴わない、後天的な遺伝子発現制御メカニズムの総称。ヒストンの化学的修飾やDNAメチル化によってもたらされる。
- 注10:LDスコア回帰法
- ゲノム全体に存在する多くの遺伝子多型が疾患発症に関わるというポリジェニック・モデルを前提として、各遺伝子多型間の相関情報(LDスコア)とGWAS統計量の関連を利用することで、GWASのさまざまな特徴を定量化できる手法。本研究では、細胞種特異的なeQTL効果量とGWAS統計量の関連を定量化し、各疾患発症に関わる免疫細胞種の同定を行った。
- 注11:全身性エリテマトーデス
- 代表的な自己免疫疾患。自己に対する抗体の出現と、組織への免疫複合体の沈着を特徴とし、腎臓・皮膚・中枢神経など全身の臓器に障害が生じ得る。発症原因は不明。
お問い合わせ先
研究内容に関するお問い合わせ先
東京大学大学院医学系研究科 免疫疾患機能ゲノム学講座
特任助教 太田 峰人(おおた みねと)
取材に関するお問い合わせ先
東京大学医学部附属病院 パブリック・リレーションセンター
担当:渡部、小岩井
TEL:03-5800-9188(直通) E-mail:pr“AT”adm.h.u-tokyo.ac.jp
理化学研究所 広報室 報道担当
E-mail:ex-press“AT”riken.jp
国立研究開発法人科学技術振興機構(JST) 広報課
TEL:03-5214-8404 E-mail:jstkoho“AT”jst.go.jp
JST事業に関するお問合せ先
国立研究開発法人科学技術振興機構(JST)
科学技術振興機構 イノベーション拠点推進部 COIプログラム担当
TEL:03-5214-7997 E-mail:coi“AT”jst.go.jp
AMED事業に関するお問い合せ先
国立研究開発法人日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課
免疫アレルギー疾患実用化研究事業
TEL:03-6870-2286 E-mail:nambyo-i“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年4月30日
最終更新日 令和3年4月30日


