プレスリリース 病原性寄生虫ジアルジアのゲノムDNA折りたたみの基盤構造を解明
プレスリリース
東京大学
科学技術振興機構
日本医療研究開発機構
発表者
佐藤 祥子(東京大学定量生命科学研究所 クロマチン構造機能研究分野 特任助教)
滝沢 由政(東京大学定量生命科学研究所 クロマチン構造機能研究分野 准教授)
胡桃坂 仁志(東京大学定量生命科学研究所 クロマチン構造機能研究分野 教授)
発表のポイント
- 病原性寄生虫であるジアルジア(和名:ランブル鞭毛虫)のヌクレオソーム(注1)構造をクライオ電子顕微鏡解析(注2)により世界で初めて解明しました。
- ジアルジアのヌクレオソームは“開いた”構造を形成すること、高等真核生物とは異なる特徴的な表面構造をもつことを明らかにしました。
- ジアルジアは世界中で最も感染者数の多い病原性寄生虫の一つであり、ジアルジアのヌクレオソームの詳細な立体構造が解明されたことにより、医薬品開発の足がかりになることが期待されます。
発表概要
東京大学定量生命科学研究所クロマチン構造機能研究分野の佐藤祥子特任助教、滝沢由政准教授、胡桃坂仁志教授らのグループは、病原性寄生虫であるジアルジアのDNA折りたたみの基盤構造を解明し、他の生物種とは異なる特徴的な部分構造をもつことを明らかにしました。
真核生物のゲノムDNAは、様々なタンパク質と複合体を形成し、折りたたまれて核内に収納されています。遺伝子の発現制御や、遺伝情報の次世代への継承は、折りたたまれたDNA上で起こります。このDNA折りたたみの基本単位は、ヌクレオソームと呼ばれる構造体で、円盤状のタンパク質複合体にDNAが巻きついた規則的な構造を形成しています。ヌクレオソームは、DNAの折りたたみ構造を決める、遺伝子制御の基盤となる構造体です。ジアルジアは、ヒトなどの小腸に寄生する寄生虫で、世界で最も感染者数の多い感染症の一つであるジアルジア症の原因となる病原体です。ジアルジアのDNAもまた、ヌクレオソームを基盤構造として折りたたまれています。しかし、ジアルジアのヌクレオソームの構造や性質は、今まで不明でした。本研究では、ジアルジアのヌクレオソームを試験管内で再構成し、クライオ電子顕微鏡解析と生化学的解析を組み合わせることにより、ヌクレオソームの詳細な三次元構造を世界で初めて解明しました。
本研究で、ジアルジアのヌクレオソームは、DNAの末端がヒストン(注3)から剥がれ、“開いた”構造を形成することが明らかになりました。また、ヌクレオソーム表面にあるタンパク質の結合領域が他の生物とは異なる形をしており、ヌクレオソームに結合する因子の種類などが、ヒトとジアルジアのヌクレオソームでは異なることが考えられました。
本研究で明らかになった構造情報は、ジアルジアに特異的に作用する薬剤を探索する基盤となり、医薬品開発につながることが期待されます。
本研究は、がん研究会がん研究所の立和名博昭博士、高エネルギー加速器研究機構の安達成彦博士、およびNational University of Ireland GalwayのAndrew Flaus博士らのグループとの共同研究で行われました。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の創薬等ライフサイエンス研究支援基盤事業(BINDS)「エピジェネティクス研究と創薬のための再構成クロマチンの生産と性状解析」(代表:胡桃坂仁志、JP21am0101076)、国立研究開発法人科学技術振興機構(JST)の戦略的創造研究推進事業(ERATO)「胡桃坂クロマチンアトラスプロジェクト」(研究総括:胡桃坂仁志、JPMJER1901)、および日本学術振興会(JSPS)の科学研究費助成事業 新学術領域研究(研究領域提案型)「遺伝子制御の基盤となるクロマチンポテンシャル」(代表:胡桃坂仁志、JP18H05534)の支援を受けて実施されました。また、電子顕微鏡解析は、AMED BINDS(代表:千田俊哉、JP21am0101071、代表:吉川雅英、JP21am0101115)からの支援を受けて実施されました。
発表内容
研究の背景
真核生物のゲノムDNAは、様々なタンパク質と複合体を形成し、折りたたまれて核内に収納されています(図1)。遺伝子の発現制御や、遺伝情報の次世代への継承は、折りたたまれたDNA上で起こります。このDNA折りたたみの基本単位は、ヌクレオソームと呼ばれる構造体で、4種類のヒストンタンパク質H2A、H2B、H3、H4各二分子ずつからなる円盤状の複合体にDNAが約1.7回巻きついて形成されています。ヌクレオソームは、DNAの折りたたみ構造を決める、遺伝子制御の基盤となる構造体です。
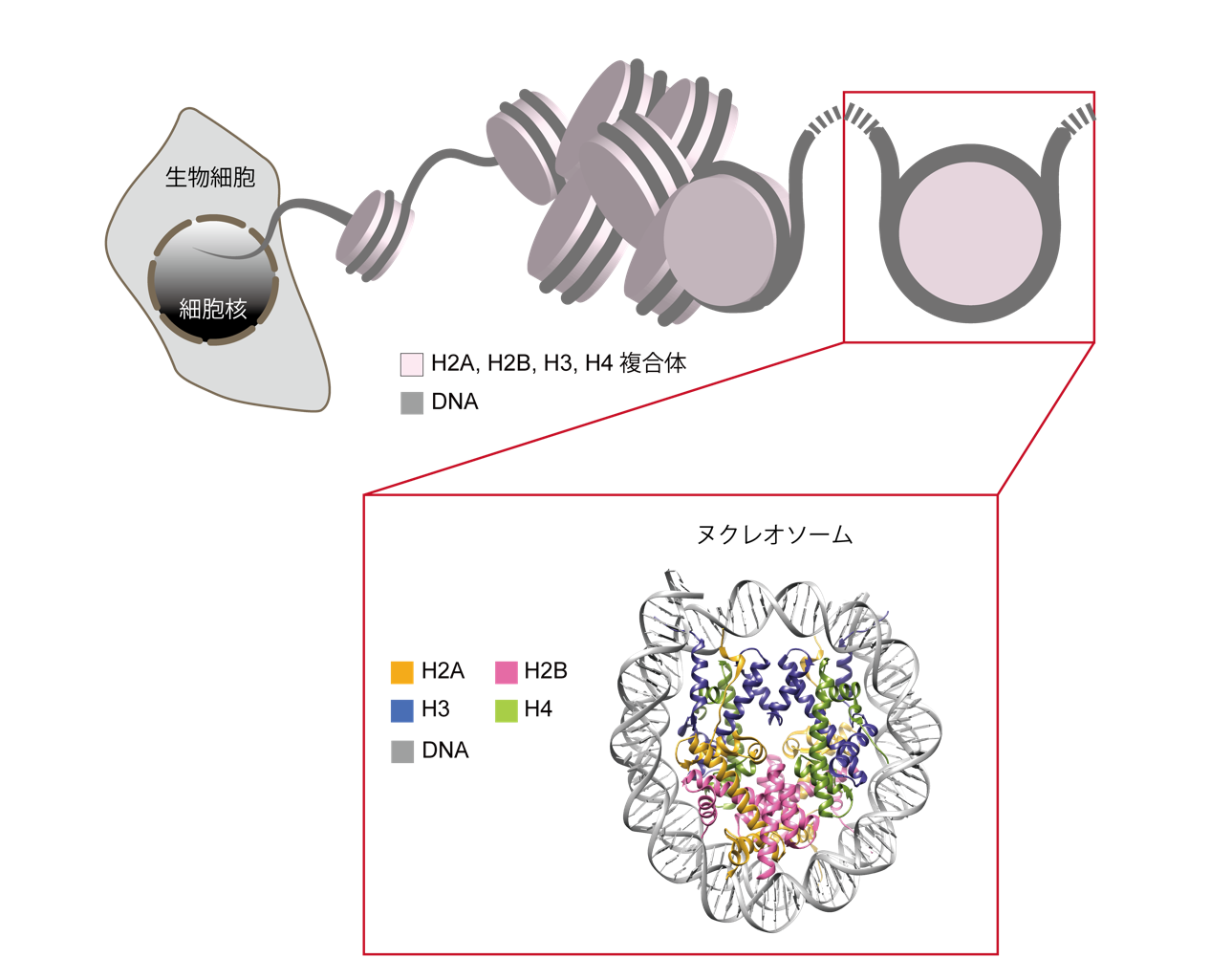
ジアルジアは、単細胞の真核生物で、ヒトをはじめ、イヌなどのペット、ヤギなどの家畜を含む、動物の小腸に寄生する寄生虫です。小腸上皮に吸着して増殖し、下痢症状を伴うジアルジア症の原因となる病原体です。ジアルジア症は、数億人の感染者がいると推定されており、世界で最も多く見られる感染症の一つです。ジアルジアは、他の真核生物と同様に、4種類のヒストンタンパク質をもち、ヌクレオソームを基盤構造として折りたたまれたDNA上で遺伝子の発現制御を行っています。ヒストンを構成するアミノ酸配列(注4)は、生物種間でよく似ていることが知られていますが、ジアルジアのヒストンタンパク質のアミノ酸配列は、ヒトをはじめとした高等真核生物とは、大きく異なっていることが分かっていました。しかし、ジアルジアのヌクレオソームがどのような構造であるのか、どのような性質をもっているのかは、今まで不明でした。
研究内容
研究グループは、ジアルジアのヌクレオソームの性状と立体構造を世界で初めて解明し、ヒトなどの高等真核生物とは異なる特徴的な部分構造をもつことを明らかにしました。
本研究では、ヒトに感染するジアルジア由来の4種類のヒストンタンパク質を、大腸菌を用いて作製して高純度に精製し、試験管の中でDNAと混ぜてヌクレオソームを再構成しました。この再構成ヌクレオソームを、クライオ電子顕微鏡を用いて観察することにより、ジアルジアのヒストンタンパク質によってつくられるヌクレオソームの詳細な三次元構造を決定することに成功しました(図2中央)。また、生化学的手法により、ジアルジアヌクレオソームの性質を調べました。
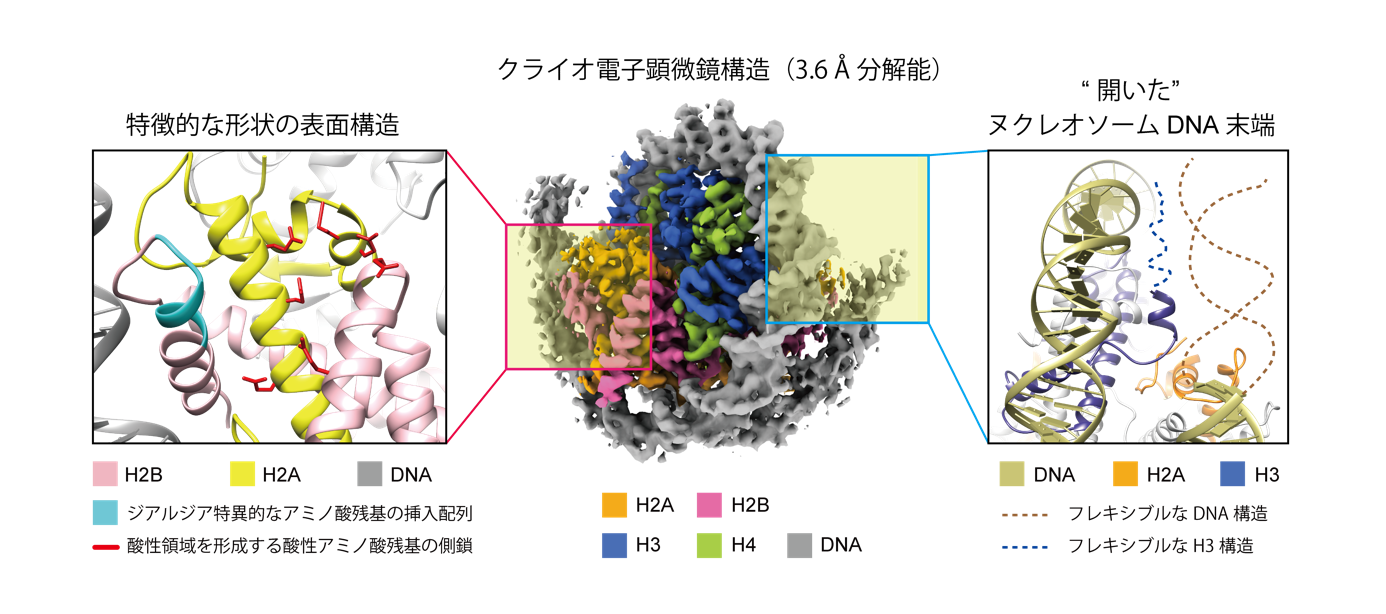
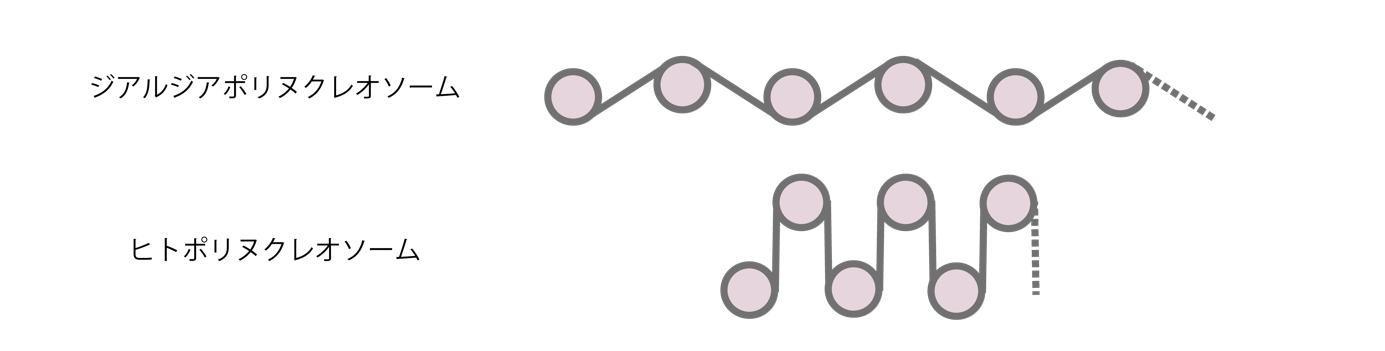
本研究により、ジアルジアのヌクレオソームは、DNAの末端がヒストンから剥がれ(図2右)、フレキシブルに動くことのできる“開いた”構造を形成していることが明らかになりました(図3左)。このことから、ジアルジアのゲノムDNAの折りたたみ構造は、DNA上で反応する酵素などがアクセスしやすい、“開いた”構造であることが考えられます。これと一致して、試験管内で再構成したポリヌクレオソーム(注5)の性状解析は、ジアルジアのポリヌクレオソームがヒトのものと比べて“開いた”構造であることを示しています(図4)。
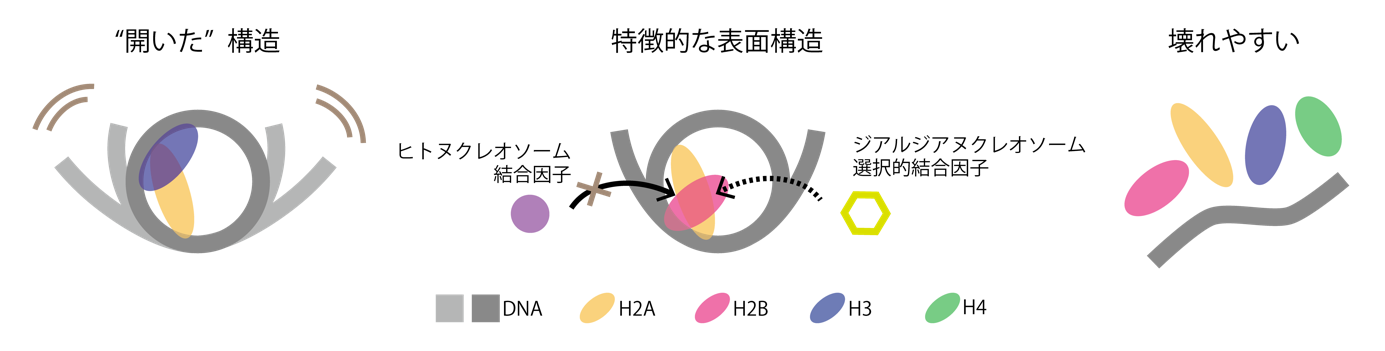
ヌクレオソーム表面には、DNA折りたたみ構造を制御するタンパク質などが結合する“足場”として働く、酸性領域が存在しています。これまでに、単細胞の真核生物である出芽酵母からヒトなどの高等真核生物まで、様々な生物種のヌクレオソーム構造が解明されており、この酸性領域は、一部のヒストン亜種(注6)を除いて、種間を超えて共通した領域であることが分かっています。この酸性領域を含む周辺の領域の構造が、ジアルジアヌクレオソームでは他の生物種とは異なる、特徴的な形状であることを見いだしました(図2左)。そこで、ヌクレオソームの酸性領域を認識するペプチドの結合性を調べたところ、ヒトヌクレオソームの酸性領域に結合する代表的なペプチドが、ジアルジアヌクレオソームには結合できないことが分かりました。ジアルジア特有のアミノ酸残基の挿入が、酸性領域にペプチドが近づくのを阻害している可能性が考えられます(図2左)。ジアルジアとヒトのヌクレオソームで因子の結合性が異なっていたことから、ジアルジアのヌクレオソームに選択的に結合する相互作用因子が存在する可能性が示唆されました(図3中央)。これに加え、今回行った生化学的解析から、ジアルジアのヌクレオソームは、不安定で壊れやすい性質をもつことが明らかになりました(図3右)。
今後の展開
本研究で明らかになったヌクレオソームの性状・構造情報は、ジアルジアに特異的に作用する薬剤を探索する基盤となるものであり、医薬品開発につながることが期待されます。また、単細胞の真核生物であるジアルジアは、真核生物の進化の過程で初期に分岐し、宿主に適応して進化したと考えられている生物です。本研究で得られたDNA折りたたみの基盤情報をもとに、ジアルジアの遺伝子制御メカニズムについて解明が進むと、私たちがもつ複雑な遺伝子制御機構がどのように進化してきたのか、生物の進化と多様性を議論する分野にも貢献できると考えられます。
発表雑誌
- 雑誌名
- 「Nucleic Acids Research」(オンライン版:2021年8月5日)
- 論文タイトル
- Cryo-EM structure of the nucleosome core particle containing Giardia lamblia histones
- 著者
- Shoko Sato*, Yoshimasa Takizawa*, Fumika Hoshikawa, Mariko Dacher, Hiroki Tanaka, Hiroaki Tachiwana, Tomoya Kujirai, Yukari Iikura, Cheng-Han Ho, Naruhiko Adachi, Indu Patwal, Andrew Flaus, and Hitoshi Kurumizaka*
- DOI番号
- 10.1093/nar/gkab644
- URL
- https://doi.org/10.1093/nar/gkab644
用語解説
- (注1)ヌクレオソーム
- 4種類のヒストン(注3)タンパク質からなる円盤状の複合体にDNAが約1.7回巻きついた構造体。真核生物の細胞核内におけるDNAの折りたたみ構造の基本単位(図1)。
- (注2)クライオ電子顕微鏡
- 試料に電子線を照射し、原子レベルの構造を観察できる顕微鏡装置。試料を急速凍結することで、溶液中に近い状態を維持した試料を観察できる。
- (注3)ヒストン
- ヌクレオソーム(注1)を構成する塩基性タンパク質。H2A、H2B、H3、H4を各二分子ずつ含む円盤状の複合体として存在し、DNAが巻きつく性質をもつ(図1)。
- (注4)アミノ酸配列
- アミノ酸はタンパク質の構成要素。タンパク質は、アミノ酸が鎖状に配列し、折りたたまれることによって形成されるため、アミノ酸配列によってタンパク質の性質と機能が決まる。タンパク質中のアミノ酸は、アミノ酸残基と呼ばれる。
- (注5)ポリヌクレオソーム
- 複数のヌクレオソームがDNAでつながれて連なった構造体。真核生物のゲノムDNAは、長大なポリヌクレオソームである(図1および4)。
- (注6)ヒストン亜種
- DNA複製期に新たに合成されたゲノムDNAに取り込まれ、ヌクレオソームを形成するヒストンを主要型ヒストンという。ヒストン亜種は、後に一部の主要型ヒストンと置き換わる。ヒストン亜種と主要型ヒストンは、アミノ酸配列(注4)が部分的に異なる。本研究では、ヒトヌクレオソームの再構成に主要型ヒストンを用いた。
お問い合わせ先
本研究に関するお問い合わせ
胡桃坂 仁志(クルミザカ ヒトシ)
東京大学 定量生命科学研究所 教授
〒113-0032 東京都文京区弥生1-1-1
TEL:03-5841-7826 FAX:03-5841-1468
E-mail:kurumizaka“AT”iqb.u-tokyo.ac.jp
報道担当
東京大学定量生命科学研究所 総務チーム
TEL:03-5841-7813 FAX:03-5841-8465
E-mail:soumu“AT”iqb.u-tokyo.ac.jp
科学技術振興機構 広報課
TEL:03-5214-8404 FAX:03-5214-8432
E-mail:jstkoho“AT”jst.go.jp
JST事業に関するお問い合わせ
科学技術振興機構 研究プロジェクト推進部
内田 信裕(ウチダ ノブヒロ)
TEL:03-3512-3528 FAX:03-3222-2068
E-mail:eratowww“AT”jst.go.jp
AMED事業に関するお問い合わせ
日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 創薬等ライフサイエンス研究支援基盤事業(BINDS)
TEL:03-6870-2219 FAX:03-6870-2244
E-mail:20-ddlsg-16“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年8月6日
最終更新日 令和3年8月6日


