プレスリリース 疲弊したT細胞を若返らせ、強い抗腫瘍効果をもつT細胞の作製に成功―がん免疫療法における新規CAR-T療法の開発―
プレスリリース
慶應義塾大学医学部
日本医療研究開発機構
慶應義塾大学医学部微生物学・免疫学教室の吉村昭彦教授らの研究グループは、疲弊したT細胞を若返らせ強い抗腫瘍効果を持つT細胞へと転換する簡便な方法を開発することで、より効果的なCAR-T療法(注1)を実現可能としました。
CAR-T療法は、がん患者の末梢血由来T細胞に体外でがんを認識する遺伝子CARを導入して増やし、がん細胞を攻撃できるようにしてから患者へ再び戻す治療法です。CAR-T療法などのT細胞療法は極めて有用ながん治療法として注目されていますが、体外で増幅させたり、体内でがん細胞と戦ううちに消耗し攻撃力が落ちる「疲弊」と呼ばれる現象によって治療効果が落ちる問題がありました。疲弊したT細胞(注2)が多いCAR-T細胞は、患者体内で維持されにくく、十分な治療効果を得ることが出来ないことから、疲弊化したT細胞を「若返らせる」さまざまな取り組みがなされてきました。この若いT細胞はステムセルメモリーT細胞(注3)と呼ばれており、盛んに分裂してがん細胞を攻撃できる細胞を数多く生み出すことができます。しかし、疲弊T細胞をステムセルメモリーT細胞に変換させる方法はこれまで不明でした。
研究グループは、作製されたCAR-T細胞をIL-7、CXCL12、IGF-I、NOTCHリガンドの4つの因子(たんぱく質)を組み合わせて培養することで、疲弊した状態からステムセルメモリー様の「若い」T細胞へと転換できることを見出しました。このステムセルメモリー様CAR-T細胞は、がん細胞と反応して素早く増殖し、寿命が長く、強い抗腫瘍効果を発揮することが確認されました。今回の培養方法は、従来のCAR-T細胞に比べてより強力で長期生存可能なCAR-T細胞を作製できることから、早期にがん治療への応用が期待されます。
本研究成果は2021年10月19日(米国時間)に米癌学会の専門誌『Cancer Research Communications』に公開されました。
研究の背景と概要
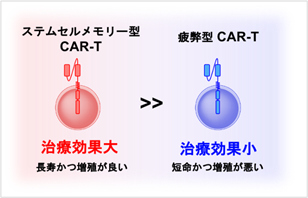
免疫細胞、特にT細胞はウイルスや細菌だけでなく、がん細胞を体内から排除するのに極めて重要な細胞です。近年、がん患者からT細胞を分離しがん細胞を攻撃できるように遺伝子を導入したT細胞(CAR-T)を、再び患者体内に戻すCAR-T療法が次世代のがん免疫療法として注目されています。しかしながら、T細胞は体内や試験管内で何度も刺激を受けることによって疲弊状態へと陥ってしまい、増殖しにくくなり、腫瘍細胞を殺傷する機能も低下します。実際にCAR-T療法やチェックポイント阻害療法(注4)などのがん免疫療法の効果が高い患者では疲弊T細胞が少なく、若いメモリー(記憶)T細胞であるステムセルメモリーが多いことが知られています。CAR-Tの作製自体でもT細胞を長期間体外で増幅するために疲弊化は避けられません。このような疲弊してしまったCAR-T細胞を患者体内に戻しても十分な治療効果は得られません。一方で、ステムセルメモリーの性質を持ったCAR-T細胞は自己を複製する能力や増殖能力に優れており、長期にわたって治療効果を維持できることが明らかとなっています(図1)。
研究の成果
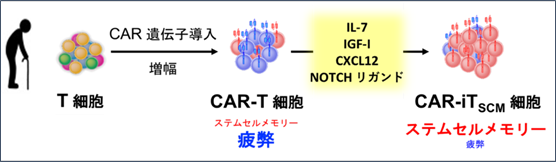
研究グループは、以前にCAR-T細胞をOP9-hDLL1細胞と呼ばれるフィーダー細胞(注5)と一緒に培養することによってがん細胞と戦うことができる状態へと若返らせる方法を報告しました。この細胞はステムセルメモリーT細胞に似た性質を示すことから「ステムセルメモリー様CAR-T細胞(CAR-iTSCM)」と命名しました。しかしながら、このCAR-iTSCM誘導方法はフィーダー細胞としてマウス由来の細胞を用いるため、マウス由来成分の混入リスクや培養のスキルを要することから必ずしも臨床での応用には適していないという問題を抱えていました。
本研究では、臨床での応用を見据えてフィーダー細胞に依存しない方法(フィーダーフリー法)で、疲弊CAR-T細胞をより抗腫瘍効果の強いCAR-T細胞へと若返らせる方法の開発を目指しました。CAR-iTSCM誘導にはフィーダー細胞が重要な役割を果たしていると考え、フィーダー細胞であるストローマ細胞(注6)が発現する因子についてスクリーニングを行った結果、IL-7、IGF-I、CXCL12、NOTCHリガンドの4因子を用いることで、CAR-iTSCM誘導のフィーダーフリー化に成功しました(図2)。
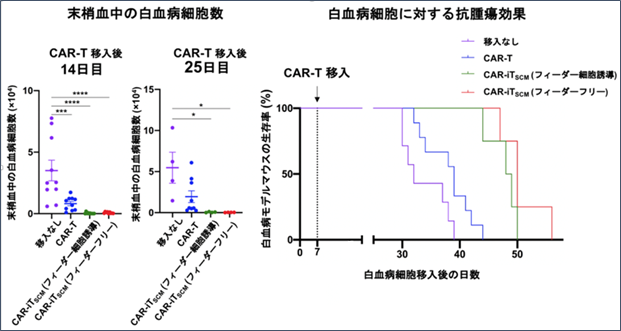
フィーダーフリー誘導のCAR-iTSCMの性質を細胞表面分子の発現や遺伝子プロファイル、代謝状態を確認したところ、フィーダーフリー法で誘導したCAR-iTSCM細胞は疲弊が消失しておりステムセルメモリー様の性質を示すことが明らかとなりました。また、がん細胞と反応して急速に増殖し、従来のCAR-T細胞よりも強力な抗腫瘍効果が認められました(図3)。
今後の展開
研究グループが開発したフィーダーフリー培養法は、疲弊したCAR-T細胞の若返りを可能とし、より抗腫瘍効果の強いステムセルメモリー様CAR-T細胞へと若返らせることに成功しました。本研究成果は、より効果的なCAR-T療法として早期に臨床応用できることが期待されます。
現在、CAR-T療法の適応は血液がんのみであり、固形がんはCAR-T細胞の疲弊が起こり易くCAR-T療法による治療がより難しいと考えられています。今回開発したCAR-iTSCM誘導法はそうした問題を取り払うことができると考えられ、固形がんに対しても治療効果が期待できます。また、用いるCARの構造上の問題によってはしばしば疲弊が起こり易いCAR-T細胞が生じることが指摘されています。CAR-iTSCM誘導法はこのようなCARの性質を問わない汎用性が期待されます。またCAR-iTSCM誘導の分子メカニズムを解明することで、体外ではなく、がん患者の体内においても疲弊T細胞をTSCMに転換する方法を見出すことで、これまでにない新たな免疫療法の開発につながることが期待されます。
論文
- 英文タイトル
- Rejuvenating effector/exhausted CAR-T cells to stem cell memory-like CAR-T cells by resting them in the presence of CXCL12 and the NOTCH ligand
- タイトル和訳
- CXCL12とNOTCHリガンド存在化でCAR-T細胞を休息させることで、エフェクター/疲弊CAR-T細胞をステムセルメモリー様CAR-T細胞へと若返らせることができる。
- 著者名
- 安藤眞、近藤泰介、富里亘、伊藤美菜子、七野成之、スリラットタナコーン、三瀬節子、中川原賢亮、吉村昭彦
- 掲載誌
- Cancer Research Communications
- DOI
- 10.1158/2767-9764.CRC-21-0034
研究グループ
- 慶應義塾大学医学部微生物学・免疫学教室(安藤眞、近藤泰介※、スリラットタナコーン、三瀬節子、吉村昭彦)、同内科学教室(呼吸器)(中川原賢亮)
※2020年3月31日まで在籍。 - 九州大学生体防御医学研究所(伊藤美菜子)
- 東京理科大学生命科学研究所(七野成之)
特記事項
本研究は、日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「全ライフコースを対象とした個体の機能低下機構の解明」研究開発領域(JP20gm1110009)、JSPS科研費(JP21H05044)、公益財団法人高松宮妃癌研究基金研究助成金、公益財団法人安田記念医学財団安田医学賞、公益財団法人武田科学振興財団研究助成金、公益財団法人持田記念医学薬学振興財団研究助成金、慶應義塾学事振興資金などの支援によって行われました。
用語解説
- (注1)CAR-T療法
- がん患者の末梢血から分離したT細胞にキメラ抗原受容体(CAR)と呼ばれる特定のがん細胞を反応できるようにする分子の遺伝子を導入したT細胞(CAR-T)を作製する。試験管内で増幅したCAR-T細胞をがん患者に再び戻す療法で、CAR-T細胞ががん細胞を殺傷することが期待される。
- (注2)疲弊T細胞
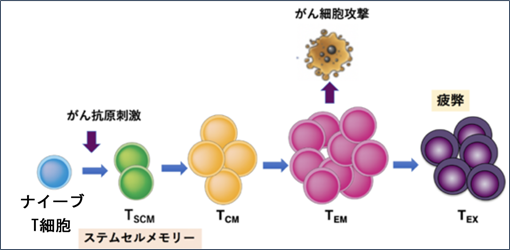
- T細胞は体内や試験管内で慢性的に活性化され続けると増殖できなくなったり、標的細胞を攻撃できなくなったりする。この現象を「疲弊」という。疲弊状態に陥ったT細胞(図4、TEX)は、生体内に戻しても増殖能力やがんを攻撃する能力が弱く、高い治療効果を期待できない。このような疲弊化したT細胞はPD−1のようなチェックポイント分子(注4)を多数発現していることが知られている。
- (注3)ステムセルメモリーT細胞
- 未感作T細胞(ナイーブT細胞)は病原体やがん細胞などの異物と遭遇すると増殖し、活性化されるが、やがて多くは死滅する。しかし一部は次の再感染や再発に備えてメモリーT細胞となる。メモリーT細胞は分化段階の異なる複数の種類、ステムセルメモリーT細胞(TSCM)、セントラルメモリーT細胞(TCM)、エフェクターメモリーT細胞(TEM)(図4)が存在する。この中でがん細胞への攻撃力が最も強く分化が進んだ細胞がTEMで、ナイーブT細胞に近く、最も長寿であり、長期にわたって免疫記憶を保持すると考えられているメモリーT細胞がステムセルメモリーT細胞(TSCM)である。TSCMは分化の進んだTCMやTEMを数多く生み出すことができる。
【図4】がんを攻撃するT細胞の分化様式 - (注4)チェックポイント阻害療法
- がん細胞は免疫細胞の攻撃から逃れるために、免疫応答にブレーキをかける。免疫チェックポイント分子と呼ばれるたんぱく質は、このようなブレーキの役割を果たしており、その代表的なものがPD-1やCTLA4であり、PD-1やCTLA4の機能を抗体により阻害することで腫瘍内の免疫反応を増強するのが免疫チェックポイント阻害療法である。抗PD-1抗体の代表的なものがオプジーボであり、発見者の本庶佑教授がノーベル医学生理学賞を受賞した。
- (注5)フィーダー細胞
- 細胞同士の接触刺激や栄養因子を提供、産生することで周囲の細胞の生存や分化、増殖するための環境を提供する細胞。
- (注6)ストローマ細胞
- 間質細胞の一種で、フィーダー細胞として試験管内で免疫細胞の発生やiPS細胞からT細胞を誘導するのにもよく使われる。
お問い合わせ先
本発表資料のお問い合わせ先
慶應義塾大学医学部 微生物学・免疫学教室
教授 吉村昭彦(よしむら あきひこ)
TEL:03-5363-3483 FAX:03-5360-1508
E-mail:yoshimura“AT”a6.keio.jp
本リリースの配信元
慶應義塾大学信濃町キャンパス
総務課 山崎・飯塚・奈良
〒160-8582 東京都新宿区信濃町35
TEL:03-5363-3611 FAX:03-5363-3612
E-mail:med-koho“AT”adst.keio.ac.jp
慶應義塾大学医学部・医学研究科
AMED事業に関するお問い合わせ先
日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課
TEL:03-6870-2224 FAX:03-6870-2246
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年10月20日
最終更新日 令和3年10月20日


