プレスリリース ヒストンメチル化酵素NSD2は発がん性変異により安全装置が外れ、制御不能になる
プレスリリース
横浜市立大学
量子科学技術研究開発機構
日本医療研究開発機構
横浜市立大学大学院医学研究科 生化学 仙石徹講師、佐藤光助教、緒方一博教授、同大学大学院生命医科学研究科 西澤知宏教授、量子科学技術研究開発機構 量子生命・医学部門量子生命科学研究所生体分子シミュレーショングループ Amarjeet Kumar博士研究員、河野秀俊グループリーダー、東京大学理学系研究科 生物科学専攻 濡木理教授らの研究グループは、血液がん発症に関わるヒストンメチル化酵素NSD2の発がん性変異体の活性亢進メカニズムを明らかにしました。この発見はNSD2の変異が関係する血液がんの治療薬開発につながるものと期待されます。
本研究成果は、Nature Communicationsに掲載されました。(日本時間2021年11月15日19時)
研究成果のポイント
- 血液がん発症に関わるヒストンメチル化酵素NSD2と基質ヌクレオソームとの複合体の立体構造をクライオ電子顕微鏡を用いて解明
- NSD2の発がん性変異による活性亢進メカニズムを解明
- NSD2変異が関係する血液がんの治療薬開発への貢献が期待される
研究背景
近年、一部の血液がんの発症には、ヌクレオソーム(注1)中のヒストンH3をメチル化する酵素NSD2の異常な活性亢進が関わっていることがわかってきました。例えば、リンパ性白血病の一部ではNSD2にメチル化活性を亢進させるアミノ酸変異(E1099K)が見つかっています。一方、多発性骨髄腫の20%では染色体転座t(4;14)(注2)によりNSD2タンパク質の量が異常に増加しています。
これらの症例では、NSD2の基質であるヒストンH3の36番目のリジン残基(H3K36)が異常に高いレベルでメチル化を受けています。このH3K36のメチル化は遺伝子発現の調節にかかわることが知られており、H3K36メチル化の異常は遺伝子発現パターンを変化させることで造血細胞のがん化につながると考えられています。
そこで、本研究ではこのNSD2の発がん性変異E1099Kがどのようにヒストンメチル化活性を異常亢進させるかを調べました。
研究内容
本研究ではクライオ電子顕微鏡を用いた単粒子解析法(注3)を用い、NSD2とヌクレオソームとの複合体の立体構造を決定しました(図1)。既に解かれていたNSD2の単独構造(図2左上)では、自己阻害ループと呼ばれるNSD2の一部の領域が基質結合部位を覆っており(close型)、H3の結合を妨げていました。一方、ヌクレオソームとの複合体(図2右下)では、基質結合部位は自己阻害ループに覆われておらず(open型)、H3が基質結合部位に結合していることが明らかとなりました。
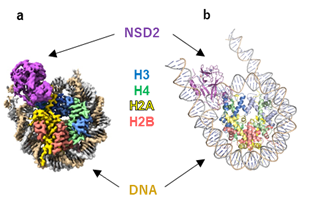
a.電子顕微鏡密度図 b.リボンモデル
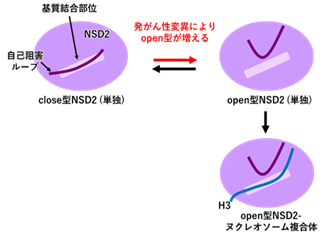
さらに分子動力学シミュレーション(注4)を用いて解析したところ、発がん性変異を持たないNSD2では自己阻害ループが基質結合部位に常に留まっていました。これらの解析から、自己阻害ループがいわば安全装置として働き、NSD2による異常なメチル化を防いでいることがわかりました。
一方、発がん性変異E1099Kを有するNSD2についても分子動力学シミュレーションを用いて解析したところ、発がん性変異E1099Kが存在すると自己阻害ループが外れてopen型の構造をとりやすくなっていることがわかりました。すなわち、発がん性変異によりNSD2の安全装置が外れ、NSD2の活性が制御不能になることで、H3K36のメチル化レベルが異常に上昇し、ひいては細胞のがん化につながる変化を引き起こすことが考えられます。
今後の展開
本研究で解明した立体構造に基づき、NSD2のヒストンメチル化活性を抑える薬剤を設計することで、NSD2の活性亢進あるいは発現亢進による血液がんに対する治療法の進展が期待されます。
研究費
本研究は科学研究費助成事業の基盤研究(C)、新学術領域研究、学術変革領域研究(B)などの支援を受け、また、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業「創薬等先端技術支援基盤プラットフォーム(BINDS)」の技術支援を受けて行われました。
論文情報
- タイトル
- Structural basis of the regulation of the normal and oncogenic methylation of nucleosomal histone H3 Lys36 by NSD2
- 著者
- Ko Sato, Amarjeet Kumar, Keisuke Hamada, Chikako Okada, Asako Oguni, Ayumi Machiyama, Shun Sakuraba, Tomohiro Nishizawa, Osamu Nureki, Hidetoshi Kono, Kazuhiro Ogata, and Toru Sengoku
- 掲載雑誌
- Nature Communications
- DOI
- 10.1038/s41467-021-26913-5
用語説明
- (注1)ヌクレオソーム
- ヒトを含む真核生物のゲノムが核内に折りたたまれる際の最小の繰り返し構造。4種類のヒストンタンパク質(H2A, H2B, H3, H4)が複合体をつくり、それにDNAが巻き付いた構造をもつ。ヒストンのメチル化などのさまざまな化学修飾によってヌクレオソームの構造的、機能的性質が影響を受ける。
- (注2)染色体転座
- 染色体異常の一種で、染色体の一部分が切断され他の場所に移動する現象。染色体転座t(4;14)では4番染色体と14番染色体間で切断断片の交換が起きている。
- (注3)クライオ電子顕微鏡による単粒子解析法
- 液体窒素温度(-196℃)下で電子顕微鏡により生体高分子を撮影し、得られた数十万から数百万個の目的分子の撮影像から立体構造を再構築する方法。試料の撮影を低温で行うため、電子線による試料のダメージが少なく高解像度のデータが得られる。クライオ電子顕微鏡法を開発した3名の研究者には2017年にノーベル化学賞が贈られている。
- (注4)分子動力学シミュレーション
- 研究対象とする分子がどのように動くかをコンピュータによりシミュレーションする研究手法。対象分子および周りの水分子などを構成する原子に働く力を時間経過とともに繰り返し計算し、運動方程式を解くことによって分子の動きを追跡する。
お問い合わせ先
取材対応に関する窓口
横浜市立大学 広報課長 上村一太郎
Tel:045-787-2414
Mail:koho“AT”yokohama-cu.ac.jp
量子科学技術研究開発機構 経営企画部 広報課
Tel:043-206-3026
Mail:info“AT”qst.go.jp
AMED事業に関する窓口
日本医療研究開発機構 創薬事業部 医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)
Tel:03-6870-2219
Mail:20-ddlsg-16“AT”amed.go.jp
※Mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和3年11月16日
最終更新日 令和3年11月16日


