プレスリリース 腸と皮膚の新たなクロストーク:腸内細菌叢を変えて皮膚の健康に影響を及ぼす脂質分解酵素の発見
プレスリリース
東京大学
日本医療研究開発機構
発表者
村上 誠(東京大学大学院医学系研究科附属疾患生命工学センター健康環境医工学部門 教授)
武富 芳隆(東京大学大学院医学系研究科分子細胞生物学専攻細胞情報学 講師)
三木 寿美(東京大学大学院医学系研究科附属疾患生命工学センター健康環境医工学部門 特任研究員)
発表のポイント
- 腸管内腔に分泌されるsPLA2-IIAという「リン脂質を分解する酵素」が、腸内細菌叢の調節に関わることを初めて明らかにしました。
- sPLA2-IIAの欠損による腸内細菌叢の変化が、皮膚の疾患(皮膚がん、乾癬)に二次的影響を及ぼすことがわかりました。
- 腸管のsPLA2-IIAは、皮膚疾患の新たな創薬標的・予測バイオマーカーとなることが期待できます。
発表概要
東京大学大学院医学系研究科の村上誠教授らの研究グループは、慶應義塾大学薬学部の有田誠教授、同先端生命科学研究所の曽我朋義教授、医薬基盤健康栄養研究所の國澤純プロジェクトリーダーらとの共同研究により、腸管内腔に分泌されるリン脂質分解酵素の一つであるIIA型分泌性ホスホリパーゼA2(sPLA2-IIA)(注1)が、腸内細菌叢(注2)のバランスを変えることによって、皮膚がんや乾癬(注3)などの皮膚疾患に影響を及ぼすことを発見しました。これまで、sPLA2は発現している局所の組織微小環境中において固有の機能を発揮すると考えられてきましたが、本研究結果は、sPLA2の一つであるsPLA2-IIAが腸内細菌叢の調節を介して遠隔臓器に二次的変容を導くことを示しており、sPLA2の新しい動作原理を提示するものです。このことから、腸管のsPLA2-IIAを標的とした創薬は、皮膚疾患の新たな診断や治療に役立つ可能性が期待できます。
本研究成果は、2022年1月25日(米国東部標準時)に米国科学誌「JCI insight」のオンライン版に掲載されました。
発表内容
研究の背景
最近、腸内細菌叢の変容が宿主の全身の健康状態に大きな影響を及ぼすことが注目されています。ある種の腸内細菌が産生する代謝物は、全身の免疫・代謝・神経系などの調節に深く関わります。これまでに、いくつかの宿主側の因子(その多くは抗菌活性を有するペプチドや腸内免疫の調節に関わる因子)が腸内細菌叢の制御に関わることが報告されていますが、その全体像は十分に解明されていません。
村上らの研究グループは、長年にわたり脂質の代謝に関わる酵素群の研究を行ってきました。sPLA2ファミリーは、細胞外に分泌されるリン脂質分解酵素の一群で、そのうちの一つであるsPLA2-IIAは1980年代後半に発見され、最も古くから研究されているsPLA2分子種です。ヒトにおいて、sPLA2-IIAは炎症時に様々な組織中に発現誘導されることから、これまでにその機能として、発現局所において脂質メディエーター(注4)の産生を介して炎症に関わる可能性や、感染細菌の膜リン脂質を分解することで生体防御に関わる可能性などが提唱されてきました。例外的にヒトの腸管には炎症の有無にかかわらずsPLA2-IIAが常に高発現していますが、その生理的意義は不明でした。特定のタンパク質の生体内での機能を調べるためには、その遺伝子を欠損(ノックアウト)したマウスの解析が極めて有用であり、C57BL/6系統(注5)のマウスが広く用いられています。しかしながら、C57BL/6系統のマウスはsPLA2-IIA遺伝子に先天的な変異を持ち、sPLA2-IIAを発現していないため、C57BL/6マウスを用いた通常のノックアウト技術は適用できず、sPLA2-IIAの機能を調べることができませんでした。そのため、sPLA2-IIAの生体内機能の解析にはsPLA2-IIA過剰発現(トランスジェニック)マウスが利用されてきました。
本研究で、村上らは、BALB/c系統(注5)のマウスが正常のsPLA2-IIA遺伝子を持つ点に着目し、この系統でsPLA2-IIA遺伝子をノックアウトしました。多くの組織でsPLA2-IIAの発現が見られるヒトとは異なり、野生型のBALB/cマウスではsPLA2-IIAは腸管(小腸>大腸)にほぼ限局して発現していました(図1A)。こうした組織分布に関する動物間種差はしばしば問題となりますが、見方を変えれば、sPLA2-IIAを欠損させたBALB/cマウスは、腸管に恒常的に高発現しているsPLA2-IIAの機能を調べるには絶好の解析ツールといえます。
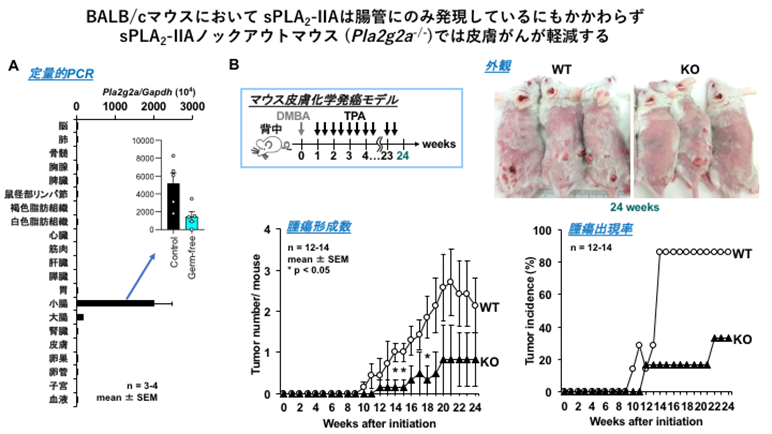
(B)皮膚化学発がんモデルにおいて、sPLA2-IIAノックアウトマウス(KO)では野生型マウス(WT)と比べて皮膚がんの形成率及び出現率が低減する。
研究内容
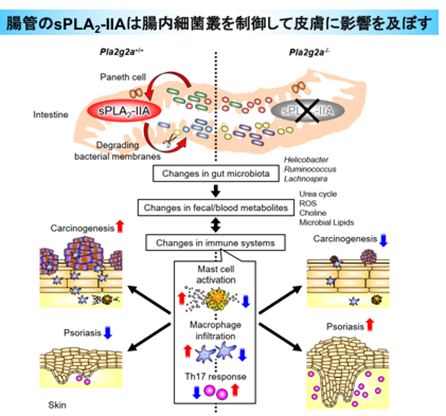
村上らはこれまでに、sPLA2ファミリーの全ての分子種のノックアウトマウスを網羅的に作製し、表現型の比較解析を進めてきました。その過程で、sPLA2-IIAノックアウトマウスでは皮膚がんができにくい(図1B)一方で、乾癬が悪化しやすいことを見出しました。しかしながら、上述のようにBALB/cマウスではsPLA2-IIAは腸管のみに発現しており、皮膚や免疫系を含む、腸管以外の組織では痕跡程度しか検出できないため、なぜ皮膚に表現型が顕在化するのかが謎でした。小腸において、sPLA2-IIAは様々な抗菌ペプチドを分泌するパネート細胞(注6)に発現しており、抗生物質の投与によりその発現が大きく低下します。このことから村上らは、sPLA2-IIAは腸内細菌成分により発現誘導され、抗菌ペプチドの一つとして腸内細菌の膜リン脂質を分解して腸内細菌叢のバランスを変えることで、二次的に皮膚に影響を及ぼしている可能性を想定しました。
実際に、sPLA2-IIAノックアウトマウスと野生型マウスの腸内細菌叢を比較解析すると、ノックアウトマウスでは属レベルで一部の腸内細菌(Helicobacter, Ruminococcus, Lachnospira属など)に明らかな相違が見られました(図2A)。sPLA2-IIAノックアウトマウスと野生型マウスを出生時から同居飼育(co-housing)すると、互いに食糞する結果、両群の腸内細菌叢に違いが見られなくなり(図2B)、野生型マウスとノックアウトマウスの皮膚の表現型の差が消失しました(図2C)。また、ノックアウトマウスの小腸では腸管の免疫や上皮バリアに関わる遺伝子群の発現に変化が見られ(図2D)、特に腸内細菌叢の違いを反映して免疫グロブリン(抗体)遺伝子の発現が大きく変化していました(図2E)。
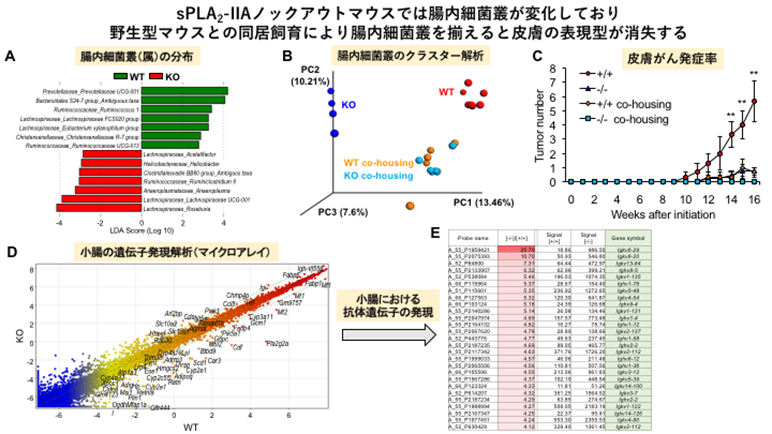
(C)皮膚がんモデルにおいて、別居飼育した野生型マウスはノックアウトマウスと比べて腫瘍数が多いが、同居飼育群では皮膚がんの発症が低下し、欠損マウスのレベルに近づく。
(D)野生型マウスとsPLA2-IIAノックアウトマウスの小腸における遺伝子発現の網羅的プロファイリング。対角線から外れている遺伝子がsPLA2-IIA欠損の影響を受けており、この中には免疫や代謝に関わる遺伝子が多く含まれる。
(E) 腸内細菌叢の違いを反映して、sPLA2-IIAノックアウトマウスの小腸では野生型マウスと比べて免疫グロブリン(抗体)遺伝子の多くが発現増加している(赤色で表示)。
さらに、ノックアウトマウスでは野生型マウスと比べて19の血漿成分に有意な変化がみられ、その中には免疫調節やがん化に関わるものも含まれていました(図3A)。糞便中の脂質を網羅的に分析した結果、ノックアウトマウスでは宿主ではなく腸内細菌に固有に存在する脂質成分が有意に減少していました(図3B)。さらに、よりクリーンな飼育環境で飼育すると、野生型マウスの腸管においてHelicobacterやRuminococcusなどの腸内細菌が減少し、その結果sPLA2-IIAの発現量が低下することで、野生型マウスとノックアウトマウスの間で腸内細菌叢に違いが見られなくなり、それと同時に皮膚の病態に差が認められなくなりました。

以上の結果から、小腸パネート細胞から分泌されるsPLA2-IIAは腸内細菌叢の調節に関わり、この経路が遮断されると腸内細菌叢に変容が生じ、二次的に遠隔の皮膚に表現型が顕在化すると結論しました(図4)。
本研究の意義・今後の予定
本研究は、長年不明であったsPLA2-IIAの腸管における機能を初めて明らかにしたものです。腸管にはsPLA2-IIA以外のsPLA2分子種も発現していることから、これらも同様に腸内細菌叢の制御を介して遠隔臓器に影響を及ぼしている可能性があり、今後はこれを証明し、理論を一般化することが必要です。上述のように、ヒトとマウスではsPLA2-IIAの発現分布に違いがありますが、腸管に高発現している点については共通していることから、ヒトにおいても腸管のsPLA2-IIAは腸内細菌叢の調節に関わっていることが予想されます。このことから、腸管のsPLA2-IIAを標的とした創薬は、皮膚疾患の新たな診断や治療に役立つ可能性が期待できます。
謝辞
本研究は、日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「疾患脂質代謝に基づく生体組織の適応・修復機構の新基軸の創成と医療技術シーズの創出」(研究開発代表者:村上誠、課題番号:20gm1210013)、革新的先端研究開発支援事業ステップタイプ(課題番号20gm4010005)、免疫アレルギー疾患実用化研究事業(課題番号20ek0410052)、ならびに日本学術振興会科研費(新学術領域研究、基盤研究、挑戦的萌芽研究;課題番号JP15H05905, JP16H02613, JP16K18882, JP19K07042, JP19K22483, JP20H04939, JP20H05691)の支援により実施されました。
本論文と同時に、海外共同研究者であるEric Boilard教授(カナダ、ラバル大学)らにより、同じ学術誌に関連論文が発表されました(#参考論文)。この関連論文は、sPLA2-IIA過剰発現マウスを用いて、sPLA2-IIAによる腸内細菌叢の調節とその関節炎における意義について解析を行っており、本論文の研究成果を相補するものです。この研究にも東京大学大学院医学系研究科の村上誠教授が共著者として貢献しています。二つの論文の同時発表に向けて、実りある討論と助言を賜ったEric Boilard教授に深く感謝致します。
発表雑誌
- 雑誌名
- JCI insight(オンライン版:2022年1月25日)
- 論文タイトル
- Group IIA secreted phospholipase A2 controls skin carcinogenesis and psoriasis by shaping the gut microbiota
- 著者
- Yoshimi Miki, Yoshitaka Taketomi, Yuh Kidoguchi, Kei Yamamoto, Kazuaki Muramatsu, Yasumasa Nishito, Jonguk Park, Koji Hosomi, Kenji Mizuguchi, Jun Kunisawa, Tomoyoshi Soga, Eric Boilard, Siddabasave Gowda B. Gowda, Kazutaka Ikeda, Makoto Arita, Makoto Murakami*
JCI Insight. 2022;7(2):e152611. - DOI番号
- 10.1172/jci. insight.152611
- アブストラクトURL
- https://insight.jci.org/articles/view/152611
- #参考論文(同時掲載)
- 雑誌名
- JCI insight(オンライン版:2022年1月25日)
- 論文タイトル
- The interaction of secreted phospholipase A2-IIA with the microbiota alters its lipidome and promotes inflammation
- 著者
- Etienne Doré, Charles Joly-Beauparlant, Satoshi Morozumi, Alban Mathieu3, Tania Lévesque, Isabelle Allaeys, Anne-Claire Duchez, Nathalie Cloutier, Mickaël Leclercq, Antoine Bodein, Christine Payré, Cyril Martin, Agnes Petit-Paitel, Michael H. Gelb, Manu Rangachari, Makoto Murakami, Laetitia Davidovic, Nicolas Flamand, Makoto Arita, Gérard Lambeau, Arnaud Droit, Eric Boilard*
JCI Insight 2022;7(2):e152638 - DOI番号
- 10.1172/jci. insight.152638
- アブストラクトURL
- https://insight.jci.org/articles/view/152638
用語解説
- (注1)IIA型分泌性ホスホリパーゼA2(sPLA2-IIA)
- グリセロリン脂質のグリセロール骨格sn-2位のアシル結合を加水分解して脂肪酸とリゾリン脂質を遊離する酵素群はホスホリパーゼA2(PLA2)と総称される。哺乳動物では50種類以上のPLA2分子種が存在し、それぞれが特有の生命応答に関わることが明らかとなってきている。このうち細胞外に分泌されるPLA2はsPLA2(secreted PLA2)と呼ばれ、哺乳動物には11種の分子種が存在する。本研究で取り扱っているsPLA2-IIAはそのうちのひとつである。
- (注2)腸内細菌叢
- ヒトの腸内には体内に棲む細菌のうち約9割が棲みついており、その数は100~1000兆個、種類は1000種類以上、重さは1~2 kgに達するといわれている。腸内細菌叢にはエネルギー産生、物質代謝、免疫調節、感染予防、肥満予防など様々な働きがある。腸内細菌叢の乱れは腸疾患のほか、動脈硬化、糖尿病、アレルギー、がん、神経疾患などの多彩な病態と結びつく。
- (注3)乾癬
- 慢性かつ難治性の皮膚角化疾患。赤い発疹が出現し、その上に角質細胞が剥がれ落ちた白疹が出現する。白色人種に多く、日本人の罹患率は約0.1%である。表皮の増殖速度が正常時をはるかに上回り、周縁の皮膚組織に炎症を起こしながら表皮が過度に増殖し、角化の亢進によって白いカサブタ状の皮疹を多く生じる。病態形成にT細胞性の自己免疫系(特にTh17免疫応答)が関与するといわれている。マウスの皮膚に化学物質(イミキモド)を反復塗布すると、乾癬と類似した病態を誘導できる。
- (注4)脂質メディエーター
- 生理活性脂質とも呼ばれる。アラキドン酸などの脂肪酸やリゾリン脂質から特異的合成酵素による代謝を受けて生合成され、特異的な受容体を介してシグナルを伝達する。PLA2はリン脂質から脂肪酸とリゾリン脂質を遊離することから、脂質メディエーター産生経路の最上流に位置すると考えられている。
- (注5)C57BL/6系統とBALB/c系統
- 遺伝的背景がそれぞれ同一であること、交配が容易であること、頑健性などの理由によって、最も広く研究に使われているマウス系統である。C57BL/6系統は暗褐色、BALB/c系統は白色の毛色を持ち、特に前者はヒト疾患のモデルとして使用される遺伝子改変マウスの「遺伝的背景」として広く使用されている。両系統はTh1型とTh2型の免疫反応に違いがあり、C57BL/6では感染防御や腫瘍免疫に重要なTh1免疫応答が支配的であるが、BALB/cはアレルギーに重要なTh 2免疫応答を誘発しやすく、より強い体液反応を起こす傾向がある。したがって、免疫学、腫瘍、感染性疾患などの研究に応用するには、両者の間に存在する多くの違いを考慮して、研究内容と目的によって選択する必要がある。本研究の焦点であるsPLA2-IIAは先天的変異のためC57BL/6系統には存在せず、BALB/c系統では腸管に発現していることから、BALB/c背景でsPLA2-IIAノックアウトマウスを作出し、野生型のBALB/cマウスと比較検討した。
- (注6)パネート細胞
- 小腸において微生物に対する防御因子を備える細胞で、機能的に好中球に類似し、小腸での自然免疫に関与する。細菌や細菌抗原に曝露した時、パネート細胞は腸管内腔に抗菌ペプチドを分泌し、胃腸の障壁の維持に寄与する。細菌あるいは細菌成分としてのリポ多糖、ムラミールジペプチド、リピドAなどへの曝露は、パネート細胞による抗菌ペプチドの分泌を刺激する。パネート細胞が分泌する抗菌ペプチドにはデフェンシン(細菌膜に穴を開けるタンパク質)やリゾチーム(細胞壁を構成するムコ多糖類を加水分解する酵素)があり、本研究で取り扱っているsPLA2-IIAもその一つといえる。
お問い合わせ先
東京大学大学院医学系研究科 附属疾患生命工学センター 健康環境医工学部門
教授 村上 誠(むらかみ まこと)
〒113-8655 東京都文京区本郷7-3-1
E-mail:makmurak"AT"m.u-tokyo.ac.jp
AMED 事業に関するお問い合わせ
日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課
TEL:03-6870-2224 FAX:03-6870-2246
E-mail:kenkyuk-ask"AT"amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和4年1月26日
最終更新日 令和4年1月26日


