プレスリリース HER2陽性の再発・進行骨・軟部肉腫と婦人科悪性腫瘍を対象とする非ウイルス遺伝子改変HER2 CAR-T細胞の医師主導治験開始
プレスリリース
信州大学医学部附属病院
日本医療研究開発機構
ポイント
- 信州大学発、非ウイルス遺伝子改変CAR-T細胞の医師主導治験(第二弾)を開始
- 日本初のHER2を標的とするキメラ抗原受容体(CAR)-T細胞注1
- 日本初の骨・軟部肉腫と婦人科悪性腫瘍を対象とするCAR-T細胞治験
- アカデミア発CAR-T細胞の産学官連携による臨床開発
概要
信州大学 医学部小児医学教室 中沢洋三教授、学術研究・産学官連携推進機構 遺伝子・細胞治療センター 柳生茂希教授らの研究グループは、2019年よりブライトパス・バイオ株式会社と共同で、HER2を標的とするキメラ抗原受容体(CAR)-T細胞の研究・開発を進めてきました。このたび、日本医療研究開発機構(AMED)再生医療実用化研究事業において、HER2陽性の再発・進行骨・軟部肉腫および婦人科悪性腫瘍の患者を対象に、HER2 CAR-T細胞療法の安全性の評価を目的とした第I相医師主導治験を信州大学医学部附属病院(以下、信大病院)で開始します。治験製品の製造および品質試験も信大病院で実施する予定です。
治験の背景
対象疾患
HER2は細胞の増殖、分化、生存、代謝などに関わる受容体型チロシンキナーゼの1つで、骨・軟部肉腫の16~60%に発現していることが知られています。婦人科悪性腫瘍においても、子宮体癌の18~80%、子宮頸癌の21%、卵巣癌の27%に発現することが知られています。外陰癌および膣癌においてもHER2の高発現や遺伝子増幅が報告されています。
骨肉腫は小児、若年成人に好発する最も頻度の高い原発性骨悪性腫瘍で、小児および若年成人を中心に人口10万人あたり0.59人に発症します。化学療法と骨切断術や関節離断術などの外科的治療を組み合わせた集学的治療が行われますが、患者の40~50%が肺転移をきたし、再発・転移性骨肉腫患者の5年生存率は30年間ほぼ変わらず20~30%です。
軟部肉腫は筋肉や脂肪組織などの軟部組織から発生する悪性腫瘍の総称で、人口10万人あたり3.60人に発症します。全身のあらゆる部位に発生し、腫瘍の種類によって発生部位や好発年齢に特徴がみられます。横紋筋肉腫、軟部発生ユーイング肉腫や滑膜肉腫は10歳台から20歳台の若年者に好発します。化学療法、外科的治療、放射線治療を組み合わせた集学的治療が行われますが、化学療法抵抗性の肉腫が多く、再発・進行例の予後は不良です。
婦人科悪性腫瘍は子宮、卵巣、外陰、膣などに発生する腫瘍の総称で、人口10万人あたり子宮体癌が26.3人、子宮頸癌が16.9人、卵巣癌が20.1人、外陰癌が1.5人、膣癌が0.6人に発生します。
子宮体癌は子宮内膜癌と子宮肉腫に大別され、50~60歳台に好発し、増加傾向にあります。外科的治療、化学療法などが行われる。再発例は治療抵抗性で、有効な二次治療法は確立されていません。子宮肉腫は婦人科悪性腫瘍の中でも特に予後が不良の腫瘍で、標準治療法が確立されていません。
子宮頸癌はヒトパピローマウイルスの持続感染が原因となって前癌病変を経て発症し、30~50歳台に多くみられます。扁平上皮癌が約75%、腺癌が約23%で腺癌の割合が増加しています。治療は外科的治療、放射線療法、再発転移例には同時放射線化学療法や多剤併用化学療法が行われます。扁平上皮癌の治療開発は進んでいるものの、腺癌の標準治療法は確立されていません。
卵巣癌は40歳台以上に好発し、日本で増加しています。外科的治療と化学療法が行われますが、進行例では治療後2年以内に約55%、5年以内に70%以上が再発します。
これらの骨・軟部肉腫や婦人科悪性腫瘍の治療不応・再発・進行例においては、外科的治療、化学療法、放射線治療に取って代わる有効性の高い治療方法の開発が切望されています。
CAR-T細胞療法
キメラ抗原受容体(CAR)は、がん細胞上の標的抗原と特異的に結合する領域とT細胞に活性化シグナルを伝達する領域を併せ持つ合成T細胞受容体の総称で、遺伝子改変技術を用いてCARを発現させたT細胞はCAR-T細胞と呼ばれます。がん患者の血液を採取し、体外でCAR-T細胞を作製し、患者の体内に戻す遺伝子治療法がCAR-T細胞療法です。患者の体内でがん細胞に出会ったCAR-T細胞は、標的抗原と結合し、活性化シグナルを介して、がん細胞に殺細胞機能を発揮します。その抗腫瘍効果は従来の抗がん薬よりも強く、最も有望な次世代がん治療法の1つと期待されています。
現在、血液腫瘍においては、B細胞性腫瘍(急性リンパ芽球性白血病と悪性リンパ腫)と多発性骨髄腫を対象とする4製品のCAR-T細胞が国内で承認されています。一方、固形腫瘍においては、世界中で多数のがん種を対象に多種類のCAR-T細胞の臨床試験が進められていますが、いまだ薬事承認に至った製品はありません。
非ウイルス遺伝子改変CAR-T細胞の開発
これまで薬事承認されたCAR-T細胞はすべて、ウイルスベクターを用いた製法(ウイルス法)で製造されています。それに対して中沢教授の本研究グループは、2007年から非ウイルスベクターを用いた、効率的・安価・安全なCAR-T細胞の製法(piggyBac法)を開発し、これまでに19編の国際論文を発表してきました。2021年には日本医療研究開発機構(AMED)革新的がん医療実用化研究事業の支援のもと、世界で初めてGM-CSF受容体を標的に、CD116陽性骨髄系腫瘍(急性骨髄性白血病と若年性骨髄単球性白血病)を対象とするGMR CAR-T細胞のヒト初回投与医師主導治験を開始しました(jRCT2033210029)。
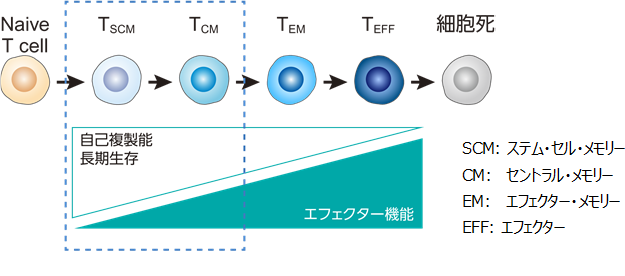
中沢教授と柳生教授らは、2016年から固形腫瘍に対する非ウイルス遺伝子改変CAR-T細胞の開発に取り組んでいます。PiggyBac法で作製したCAR-T細胞は、ウイルス法と異なり、分化早期の増殖能が高く、「免疫疲弊」が生じていない幹細胞様メモリーT細胞(Tscm: stem cell memory、図1)が多く含まれるため効果の持続性に優れ、固形腫瘍にも有効であることをヒト細胞や動物を用いた実験で明らかにしてきました(Nakamura K, et al. Mol Ther Methods Clin Dev 2021; Kubo H, et al. et al. Mol Ther Oncolytics 2021; Tomida A, et al. Cancer Science 2021)。
HER2 CAR-T細胞の開発
HER2は多くの固形がんに様々な程度で発現が認められます。そのため、標的治療の良い適応とされ、HER2を高発現する乳癌および胃癌の患者に対しては、複数の抗体薬が薬事承認されています。しかし、これらの抗体薬はHER2低発現がんに対しては効果が不十分で、乳癌と胃癌以外のがん種における適応症は得られていません。
中沢教授は米国ベイラー医科大学留学中に、HER2 CAR-T細胞がHER2低発現の脳腫瘍に対しても良好な抗腫瘍効果を発揮することを報告しています(Nakazawa Y, et al., Mol Ther 2011)。それらの結果を踏まえて、ベイラー医科大学では、レトロウイルス遺伝子改変HER2 CAR-T細胞の第Ⅰ/II相臨床試験が実施され、骨・軟部肉腫と悪性神経膠腫患者における良好な忍容性と有効性が確認されています(J Clin Oncol, 2015; JAMA Oncol, 2017; Nat Commun 2020)。
そこで中沢教授と柳生教授は、独自のpiggyBac法による幹細胞様メモリーT細胞リッチなCAR-T細胞製造技術と米国のHER2 CAR-T細胞の臨床成果を組み合わせることによって、より効果的なHER2 CAR-T細胞療法が実現可能になると考え、2019年からブライトパス・バイオ株式会社と共同で、piggyBac遺伝子改変HER2 CAR-T細胞の研究・開発に着手しました(2019年8月19日信州大学プレスリリース注2)。
この共同研究の結果、piggyBac遺伝子改変法と効果的な培養法(特許出願中)を組み合わせた、独自のHER2 CAR-T細胞(BP2301)の作製に成功しました(Nakamura K, et al. Mol Ther Methods Clin Dev 2021; Shioya K, et al. AACR Annual Meeting 2022)。
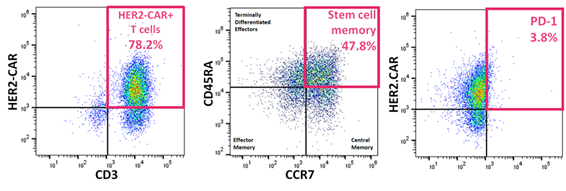
PiggyBac遺伝子改変HER2 CAR-T細胞の特徴です。
- CARを高発現し、豊富な幹細胞様メモリーT細胞を含み、疲弊マーカー(PD-1)をほとんど発現しない(図2)。
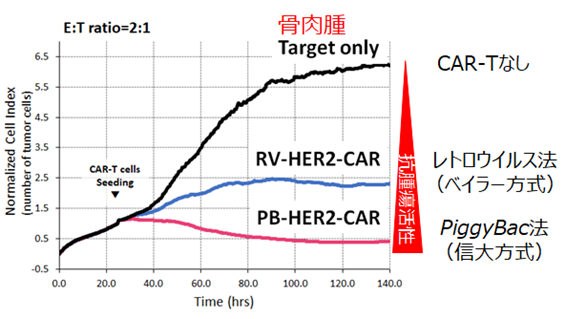
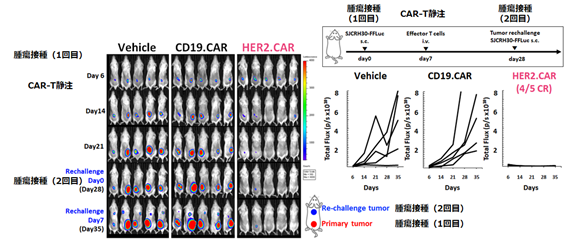
- レトロウイルス遺伝子改変HER2 CAR-T細胞よりも高い抗腫瘍活性を有する(図3)。
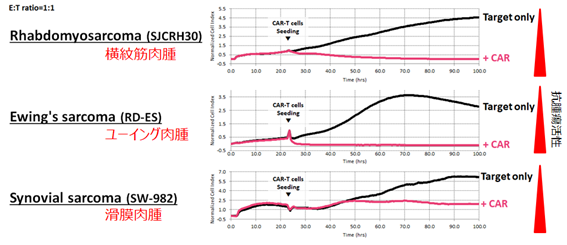
- 骨肉腫、横紋筋肉腫、ユーイング肉腫、滑膜肉腫、トリプルネガティブ乳癌、卵巣癌などの広範ながん種に対して抗腫瘍効果を誘導する(図4)。
- 担癌マウスモデルにおいて持続的な抗腫瘍効果を発揮する(図5)。
医師主導治験概要
2022年5月6日付けで、「HER2特異的キメラ抗原受容体(CAR)遺伝子改変T細胞療法の安全性に関する臨床第Ⅰ相試験」の治験届が受理され、信大病院小児科・産科婦人科・整形外科において本医師主導治験を開始します。本治験は、標準治療が不応・不耐もしくは標準治療後に再発又は進行した、難治性の骨・軟部肉腫および婦人科悪性腫瘍患者を対象とした、遺伝子改変T細胞療法の臨床第I相試験になります。具体的には、治験製品である非ウイルス遺伝子改変自家HER2 CAR-T細胞(BP2301)を患者に輸注し、その安全性を検証します。併せて、臨床効果とCAR-T 細胞の体内動態を評価します。患者の長期安全性も5年間観察します(付随研究「HER2特異的キメラ抗原受容体(CAR)遺伝子改変T細胞療法の安全性に関する臨床第Ⅰ相試験」における治験製品のヒト体内における作用機序解明及び長期追跡調査)。
| 治験課題名 | HER2特異的キメラ抗原受容体(CAR)遺伝子改変T細胞療法の安全性に関する臨床第Ⅰ相試験 |
|---|---|
| 治験の相 | 第Ⅰ相 |
| 治験の目的 | 標準治療により不応・不耐もしくは再発又は進行HER2陽性骨・軟部肉腫および婦人科悪性腫瘍患者に対する、BP2301(HER2.CAR-T遺伝子改変T細胞製剤)投与の忍容性検討並びに安全性の評価及び有効性の探索的検討を行う。 |
| 治験デザイン | 単施設、非盲検、用量漸増試験 |
| 対象 | 標準治療不応・不耐もしくは再発又は進行HER2陽性骨・軟部肉腫および婦人科悪性腫瘍 |
| 目標被験者数 | 最大12例の患者(1コホート当たり最大6例の評価) |
| 予定試験期間 | 3年(2022年5月~ 2025年4月) |
| 評価項目 | 主要評価項目
|
| 投与量 | 用量漸増:第1用量(低用量)、第2用量(高用量)
|
治験製品の製造・品質管理
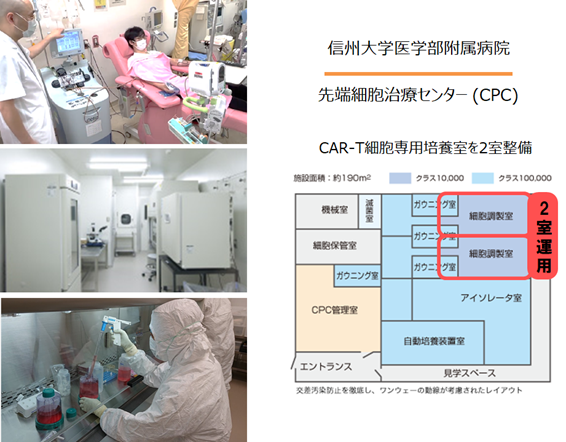
治験製品(BP2301)は、非ウイルスベクター製法の利点を活かして、適切に管理された信大病院 先端細胞治療センター 細胞調製室(CPC)で製造します(図6)。信大病院CPCでは、専用培養室2室を活用することによって、現在医師主導治験中のGMR CAR-T細胞と合わせて、2種類の非ウイルス遺伝子改変CAR-T細胞の製造が行われることになります。また、治験製品の品質試験は、AMED 再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(遺伝子治療製造技術開発)で整備された信州大学遺伝子・細胞治療研究開発センター・品質検査室(QC Lab)で実施されます。
今後期待される展開
本医師主導治験でHER2 CAR-T細胞の安全性が確認され、有効性も期待できる場合は、1日でも早く1人でも多くの患者さんに届けられるように、企業治験へ橋渡し、薬事承認を目指します。また、独自に開発した本製品の非ウイルスベクター製法は、簡便かつ低コストで高性能な製品製造が可能となるため、産学官連携を通じてわが国の新しい医療産業振興に貢献できると考えています。
用語説明
- 注1 キメラ抗原受容体(CAR)-T細胞
- キメラ抗原受容体(CAR)は、がん細胞上の標的抗原と特異的に結合する領域とT細胞に活性化シグナルを伝達する領域を併せ持つ合成T細胞受容体の総称で、遺伝子改変技術を用いてCARを発現させたT細胞をCAR-T細胞と呼ばれる。
- 注2 2019年8月19日信州大学プレスリリース
- 信州大学とブライトパス・バイオが固形がんCAR-T細胞療法の共同研究開発契約を締結
研究費
- 2018年度~2023年度 AMED 再生医療・遺伝子治療の産業化に向けた基盤技術開発事業(遺伝子治療製造技術開発) 「遺伝子・細胞治療の実用化を促進するための霊長類モデルを用いた安全性評価系の基盤整備」(研究開発代表者:中沢 洋三)
- 2022年度~2024年度 AMED 再生医療実用化研究事業「HER2陽性の再発・進行骨・軟部肉腫及び婦人科悪性腫瘍を対象とする非ウイルス遺伝子改変HER2 CAR-T細胞の臨床第Ⅰ相医師主導治験」(研究開発代表者:中沢 洋三)
お問い合せ先
治験に関すること
信州大学医学部附属病院 臨床研究支援センター
電話:0263-37-3389(直通)(平日午前9時~午後5時)
e-mail:her2-car”AT”shinshu-u.ac.jp
報道に関すること
信州大学医学部小児医学教室
電話:0263-37-2642(直通)(平日午前9時~午後4時)
e-mail:child”AT”shinshu-u.ac.jp
AMED事業に関すること
日本医療研究開発機構(AMED)
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
再生医療実用化研究事業担当
e-mail:saisei3"AT"amed.go.jp
※e-mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 令和4年5月9日
最終更新日 令和4年5月9日


