プレスリリース 側頭葉てんかん責任遺伝子の同定と発症メカニズムの解明―海馬への興奮性入力の増加が原因―
プレスリリース
名古屋市立大学
日本医療研究開発機構
研究のポイント
- 海馬硬化を伴う内側側頭葉てんかんの複数の患者において、変異を示す新規責任遺伝子CUX2、CASPを発見しました。
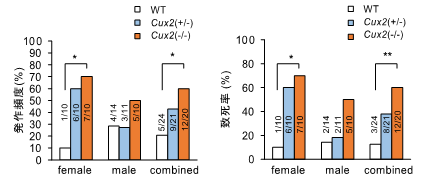
- けいれん感受性が高いことなど、てんかん症状の一部をモデルマウスで再現しました。
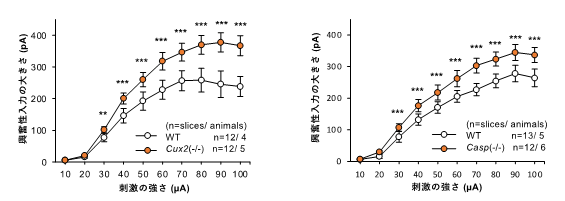
- 発症メカニズムの一つとして、海馬への興奮性入力の増加を提案しました。
- 本研究成果は、ヒトのてんかん病態の理解や治療法の開発・改良に貢献する可能性があります。
研究成果の概要
名古屋市立大学大学院医学研究科 脳神経科学研究所 神経発達症遺伝学分野の山川和弘 教授、鈴木俊光 講師、福岡大学 医学部 廣瀬伸一 教授、湊病院北東北てんかんセンター 兼子直 医師、静岡てんかん・神経医療センター 井上有史 医師、理化学研究所 脳神経科学研究センター Adrian Moore チームリーダーらの共同研究グループは、以下の内容を見出しました。
- 様々な種類のてんかんを有する271名の患者のゲノムDNAを用いた変異解析において、同研究グループが以前に同定したてんかん関連領域1)に存在し、神経細胞の発生・機能に関わる転写因子2)をコードするCUX2遺伝子およびその類似遺伝子CASPの複数の変異が、側頭葉てんかん患者において集中して見出されること。
- CUX2疾患変異を有するタンパクがヒト培養細胞において異常な細胞内分布を示すこと。
- ショウジョウバエ神経細胞において、一部の患者変異がCUX2の本来持つ樹状突起伸長能を損なうこと。
- Cux2およびCasp欠損マウスがともにけいれん誘発剤であり、側頭葉てんかんモデル作成にも用いられるカイニン酸に対し大きな感受性の増大を示すこと。
- 両遺伝子欠損マウスにおいて、海馬への興奮性シナプス入力が大きく増加していること。
これらの結果は、CUX2およびCASPが側頭葉てんかん原因・関連遺伝子の有力な候補であり、側頭葉てんかんの発症メカニズムの一つが、海馬への興奮性入力の増加であることを提案するものです。これらの知見は側頭葉てんかんの遺伝子診断、発症メカニズムの理解、治療法の開発に大きく役立つものと思われます。
研究成果は、英国科学誌「Scientific Reports(サイエンティフィック・リポーツ)」電子版に2022年5月17日午前10時(英国時間)掲載(日本時間2022年5月17日午後6時)
背景
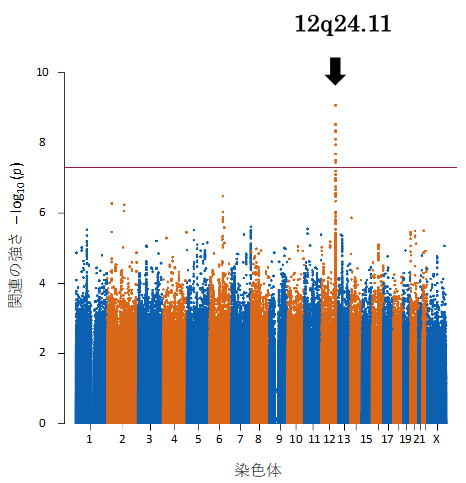
海馬硬化を伴う内側側頭葉てんかんは、国内においておよそ5万人が発症する難治てんかんです。本研究では、内側側頭葉てんかんの新規責任遺伝子の同定と、それら遺伝子の異常によって引き起こされる本疾患の発症メカニズムを検討しました。山川教授らの研究グループは昨年 (2021年)、約2,000人の様々な種類のてんかん患者ゲノムDNAを用いた全ゲノム関連解析(GWAS)3)により、てんかん発症に関わる新規遺伝子領域を12番染色体長腕(12q24)から同定し報告しました1)(図1)。しかし、その領域内には24個の候補遺伝子が位置しており、責任遺伝子は未同定のまま残されていました。
研究の成果
昨年報告した候補遺伝子領域内1)に位置し、神経細胞の樹状突起分岐やシナプス形成に関わる転写因子をコードするCUX2遺伝子の変異が、発症率の低い稀なてんかん性脳症の少数の患者で報告されています。そこで山川教授らの研究グループは、本遺伝子の変異がより広くてんかんに関わっているかどうかを調べるために、様々な種類のてんかんを有する271名の患者(特発性てんかん116名、側頭葉てんかん68名、その他の症候性てんかん87名)を対象に変異解析を行いました。その結果、9名の患者で一般集団では非常に稀、もしくは全く見出されないミスセンス変異4)を同定し、そのうち実に7名が内側側頭葉てんかん、1名が外側側頭葉てんかんの患者でした。また、CUX2変異タンパクがヒト培養細胞において異常な細胞内分布を示すことも確認しました。さらに野生型CUX2がショウジョウバエの神経細胞において樹状突起伸長と分岐を促進することを、また、この促進効果が一部の患者変異により減弱することを見出しました。これらの結果は、患者で見つかった変異がタンパクの機能を喪失させることを示唆するものでした。そこでCUX2ノックアウト(KO)マウスを用いてけいれん誘発剤に対する感受性を評価したところ、GABA-A受容体遮断薬であるペンチレンテトラゾールには感受性の増加を示さない一方、側頭葉てんかんモデルの作成にも使用されるカイニン酸には、大きな感受性の増大を示しました(図2)。更には、CUX2のパラログ5)であるCUX1でも、側頭葉てんかんの患者において変異が確認されました。CUX1にはN末端6)は共通だがC末端7)がユニークなショートアイソフォーム8)CASPが存在し、その変異解析を上記271名の患者で行ったところ、CASP特異的なC末端をコードする部分に、ミスセンス変異と欠失変異9)を2名の側頭葉てんかん患者でそれぞれ同定しました。そこでCasp特異的なC末端を改変したCasp-KOマウスを作成しけいれん誘発剤に対する感受性を評価したところ、Cux2-KOマウスと同様にカイニン酸への感受性の増大を示しました(図3)。
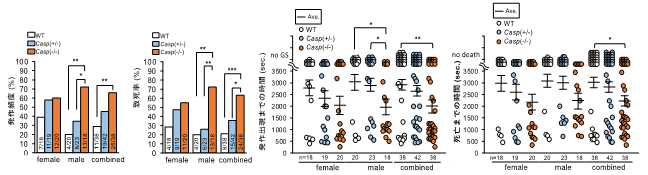
同研究グループは以前に、電位依存性カリウムチャネルKv4.2をコードするKCND2遺伝子の分断変異10)を、側頭葉てんかんの患者から同定し報告しています11)。この遺伝子のKcnd2-KOマウスもCux2-KOやCasp-KOマウスと同様に、カイニン酸への感受性の増大を示します12)。これらの知見も、CUX2やCASPがKCND2とともに、側頭葉てんかんの原因・関連遺伝子であることを支持するものです。さらに、Cux2-KOおよびCasp-KOマウスの海馬をスライスパッチクランプ法13)で解析したところ、嗅内皮質から海馬への興奮性シナプス伝達が増大していることが見出されました(図4)。この結果は、海馬への興奮性入力の増加がCUX2またはCASPの変異により引き起こされる側頭葉てんかん発症の共通メカニズムである可能性を示しています。
研究の意義と今後の展開や社会的意義など
本研究により、ヒト側頭葉てんかんの原因となる新たな責任遺伝子と発症メカニズムの一つが明らかにされたことで、今後、本疾患の病態への理解が深まり、新しい治療法や発症予防法の開発につながる可能性があります。さらには、患者さんへの遺伝カウンセリングにおいて科学的根拠に基づいて説明することや、医療の現場での遺伝子検査の実施により、患者個人に対応した適切な治療の方針を立てることが可能となり、副作用の軽減や医療費の削減に貢献することなどが期待されます。
用語解説
- 1)2021年4月29日プレスリリース
- 「日本人てんかん発症に関わる新規遺伝子領域を発見」 Suzuki et al., “Genome-wide association study of epilepsy in a Japanese population identified an associated region at chromosome 12q24.“ Epilepsia 62: 1391-1400 (2021). DOI: 10.1111/epi.16911
- 2)転写因子
- DNA上の特定の配列を認識して結合し、RNAの転写開始に関わる因子。
- 3)全ゲノム関連解析(GWAS)
- 疾患の感受性遺伝子を見つける方法の一つ。ヒトのゲノム全体を網羅する遺伝子多型を用いて、疾患を持つ群と疾患を持たない群とで遺伝子多型の頻度に差があるかどうかを統計学的に検定する方法。検定の結果得られたP値(偶然にそのようなことが起こる確率)が低いほど、相関が高いと判定できます。GWAS は、Genome-Wide Association Study の略。
- 4)ミスセンス変異
- 遺伝子がコードするタンパクにアミノ酸置換をもたらす変異。
- 5)パラログ
- 遺伝子重複によって生じた相同性をもつ遺伝子群。
- 6)N末端
- タンパク質のフリーなアミノ基(-NH2)で終端している側の末端。翻訳されるときは、N末端から作られます。
- 7)C末端
- タンパク質のフリーなカルボキシル基(-COOH)で終端している側末端。
- 8)アイソフォーム
- 選択的スプライシングやプロモーターの差異などにより形成される単一の遺伝子に由来する一連のタンパク。
- 9)欠失変異
- 遺伝子がコードするタンパクのアミノ酸を欠失させる変異。
- 10)分断変異
- 遺伝子がコードするタンパクを途中で分断させる変異。
- 11)
- Singh et al.,“A Kv4.2 truncation mutation in a patient with temporal lobe epilepsy.” Neurobiol. Dis. 24: 245–253(2006). DOI: 10.1016/j.nbd.2006.07.001.
- 12)
- Barnwell et al.,“Kv4.2 knockout mice demonstrate increased susceptibility to convulsant stimulation.” Epilepsia 50: 1741–1751(2009).
- 13)パッチクランプ法
- 細胞膜に細いガラス電極を当てることで、その細胞の電気活動を記録する実験手法。
研究助成
本研究の一部は、日本医療研究開発機構(AMED)難治性疾患実用化研究事業の研究開発課題「海馬硬化を伴う内側側頭葉てんかんの原因遺伝子同定と発症機構の解明(研究開発代表者: 山川和弘)」の助成により行われました。
論文情報
- 論文タイトル
- CUX2 deficiency causes facilitation of excitatory synaptic transmission onto hippocampus and increased seizure susceptibility to kainate
- 著者
- 鈴木 俊光1, 2,#, 立川 哲也2,#, 須藤 元輝2,#, Caroline Delandre3,18, Yun Jin Pai3, 宮本 浩之2, Matthieu Raveau2 , 下畑 充志2,19, 大守 伊織4, 浜野 晋一郎5, 萩野谷 和裕6, 植松 貢7, 高橋 幸利8,9, 森本 昌史10, 藤本 伸治11,12, 小坂 仁13, 小国 弘量14, 大澤 真木子14, 石井 敦士15, 廣瀬 伸一15, 兼子 直16,17, 井上 有史9, Adrian Walton Moore3, 山川 和弘1,2*
- (#co-first authors, *corresponding author)
- 所属
- 1名古屋市立大学大学院医学研究科 脳神経科学研究所 神経発達症遺伝学分野, 2理化学研究所 脳神経科学研究センター 神経遺伝研究チーム, 3理化学研究所 脳神経科学研究センター 神経細胞多様性研究チーム, 4岡山大学 教育学部, 5埼玉県立小児医療センター, 6宮城県立こども病院, 7東北大学 医学部, 8岐阜大学 医学部, 9静岡てんかん・神経医療センター, 10京都府立医科大学 医学部, 11名古屋市立大学大学大学院医学研究科, 12つつじが丘こどもクリニック, 13自治医科大学 医学部, 14東京女子医科大学 医学部, 15福岡大学 医学部, 16弘前大学 医学部, 17湊病院北東北てんかんセンター, 18タスマニア大学 メンジーズ医学研究所, 19日本医科大学大学院医学研究科
- 学術誌名
- Scientific Reports(サイエンティフィック・リポーツ)
- DOI
- 10.1038/s41598-022-10715-w
お問い合わせ先
研究に関する問い合わせ
名古屋市立大学大学院医学研究科・脳神経科学研究所・神経発達症遺伝学分野 教授
山川 和弘(やまかわ かずひろ)
住所: 〒467-8601 名古屋市瑞穂区瑞穂町字川澄1
E-mail:yamakawa”AT"med.nagoya-cu.ac.jp
報道に関する問い合わせ
名古屋市立大学 医学・病院管理部経営課
名古屋市瑞穂区瑞穂町字川澄1
TEL:052-858-7114 FAX:052-858-7537
E-mail:hpkouhou”AT"sec.nagoya-cu.ac.jp
AMEDの事業に関する問い合わせ
日本医療研究開発機構
難治性疾患実用化研究事業 担当
E-mail:nambyo-r”AT"amed.go.jp
E-mailは上記アドレス”AT"の部分を@に変えてください
関連リンク
掲載日 令和4年5月18日
最終更新日 令和4年5月18日


