プレスリリース ヒト受精卵から胎盤が発生する仕組みを解明―生殖補助医療や再生医療への貢献に期待―
プレスリリース
東北大学
日本医療研究開発機構
発表のポイント
- ほ乳類の受精卵が最初に迎える運命決定により、将来胎児となる細胞と胎盤となる細胞に分かれます。この段階までに、それぞれの特性を反映する細胞として、胚性幹細胞(ES細胞)注1と栄養膜幹細胞(TS細胞)注2が樹立されています。受精卵が迎える最初の運命決定をはじめ、その発生機構は、動物種による違いも存在し、ヒトについては多くが不明であり、細胞を用いた研究成果が重要な知見となります。
- ヒトES細胞をTS細胞に分化転換(リプログラミング)することにより、胎盤への分化に必須な遺伝子とその調節機構について解析しました。そのうち、ヒトをはじめとする霊長類だけに存在し、ゲノムインプリンティング注3を受ける小分子RNA注4のクラスターであるC19MC遺伝子注5が、胎盤の発生や分化に極めて重要な機能を持つことを明らかにしました。
- 本研究成果は、ヒト胎盤発生における基礎的な研究に留まらず、生殖補助医療や再生医療への貢献も期待できます。
概要
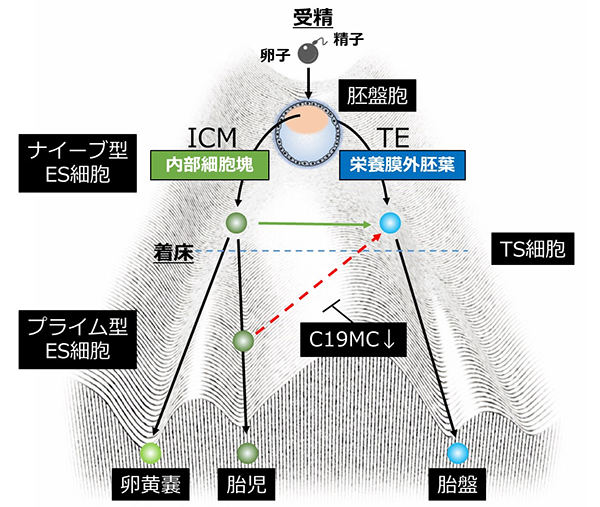
ほ乳類の受精卵が最初に迎える運命決定により、将来胎児となる細胞と胎盤となる細胞に分かれます(図1)。しかし、ヒトをはじめとする霊長類では、この胎盤への運命決定機構についての詳細は明らかではありませんでした。
東北大学大学院医学系研究科情報遺伝学分野の小林記緒(こばやし のりお)助教、岡江寛明(おかえ ひろあき)准教授、有馬隆博(ありま たかひろ)教授らのグループは、九州大学生体防御医学研究所、東京医科歯科大学と共同で、ヒト胎盤の発生や分化に必須な遺伝子を同定し、その制御機構を明らかにしました。
本研究では、ヒトES細胞(ナイーブ型とプライム型注6)からTS細胞への分化転換細胞を作製し、その細胞特性と遺伝子発現の変化について詳細に解析しました。その結果、TS細胞への分化転換には、霊長類だけが持つC19MC遺伝子が機能することが必須であることを明らかにしました。また、ゲノム編集技術を用いて、C19MC遺伝子がエピジェネティック注7な分子機構により発現調節を受けていることを明らかにしました。C19MC遺伝子は、ゲノムインプリンティングを受ける遺伝子(小分子RNA)であり、胎児と胎盤組織におけるインプリンティング制御の違いが細胞の運命決定に関与する可能性が示唆されました。本研究の成果は、ヒト受精卵や胎盤の発生メカニズムの理解に繋がるだけでなく、生殖補助医療や再生医療への応用等、多くの分野への発展が期待できます。
本成果は、日本時間2022年6月2日(木)午後6時(米国東部時間、6月2日(木)午前5時)Nature Communicationsに掲載されました。
研究内容
ほ乳類の受精卵は、受精後から卵割とよばれる分裂を続け、将来の胎児もしくは胎盤となる2種類の細胞に分かれます(図1)。これらの細胞は、同じ遺伝子配列をもつにも関わらず、全く異なる発生運命をたどります。これまで、ヒトをはじめとする霊長類では、この受精卵が迎える最初の運命決定について、その詳細な分子メカニズムは明らかではありませんでした。
当研究グループは、これまでにヒト受精卵や初期胎盤組織から栄養膜幹(Trophoblast Stem:TS)細胞を樹立することに成功しています。このTS細胞の培養技術を利用し、発生段階の異なるナイーブ型とプライム型の2種類のヒト胚性幹(Embryonic Stem:ES)細胞をTS細胞へ分化転換させ、その細胞特性と遺伝子発現の変化について詳細に解析しました。
着床前の胎児細胞に相当するナイーブ型ES細胞は、TS細胞へ分化転換したのに対して、着床後の胎児細胞に相当するプライム型ES細胞から分化転換した細胞は、TS細胞としての性質を保持していませんでした。遺伝子発現やDNAメチル化注8状態を網羅的に解析した結果、これらの細胞間では、C19MC遺伝子(Chromosome 19 microRNA cluster)の発現に顕著な違いがあることを突き止めました。C19MC遺伝子は、TS細胞やナイーブ型ES細胞で高発現し、プライム型ES細胞では1/100倍の低発現を示しました。本研究では、さらにゲノム編集技術を用いてC19MC遺伝子近傍のDNAメチル化領域の欠損TS細胞を作製したところ、C19MC遺伝子がエピジェネティックな制御を受け、DNAメチル化によりその発現が低下することを明らかにしました。このC19MC遺伝子は、霊長類だけがもつ遺伝子で、ゲノムインプリンティングを受ける遺伝子座に存在します。したがって、胎児と胎盤組織におけるインプリンティング制御の違いが細胞の運命決定に関与する可能性が示唆されました。本研究により、ヒト胎盤の発生に必須な分子とその制御機構が明らかになりました。また本研究成果は、ヒト受精卵や胎盤の発生メカニズムの基礎的研究に留まらず、生殖補助医療や再生医療への貢献が期待できます。
本研究は、文部科学省科学研究費補助金新学術領域研究(研究領域提案型)における「全能性プログラム」における研究課題「着床前胚に由来する幹細胞を用いた全能性の再構築」(研究代表者:岡江寛明)、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「健康・医療の向上に向けた早期ライフステージにおける生命現象の解明」における研究開発課題「ヒト胎盤の発生・分化に関する理解と臓器チップモデルの作製」(研究開発代表者:有馬隆博)により、行われました。
用語説明
- 注1 胚性幹細胞(ES細胞)
- ヒト受精卵の胎児細胞に由来する幹細胞。生体外においても、すべての胎児組織に分化する多能性を保ちつつ、ほぼ無限に増殖させることができるため、多能性幹細胞と呼ばれる。現在まで、2種のヒトES細胞(ナイーブ型・プライム型)が樹立されている。
- 注2 栄養膜幹細胞(TS細胞)
- 胎盤の中に存在する、高い増殖能と分化能を持つ幹細胞。ヒトTS細胞の培養法は、当研究室が独自に確立し、広く利用されている。
- 注3 ゲノムインプリンティング
- 遺伝的刷り込みと言われる。ほ乳類のゲノムは父親と母親由来の染色体を半分ずつ引き継ぎ、各染色体上の遺伝子は、父親由来または、母親由来の対立遺伝子(アリル)と呼ばれる。一般的に父親・母親由来にかかわらず遺伝子の発現は等価だが、一部の遺伝子はゲノムインプリンティングを受けており、父親あるいは母親由来の遺伝子より発現する。ヒト胎盤では、ゲノムインプリンティングの仕組みの実体は、DNAメチル化により説明されている。
- 注4 小分子RNA
- マイクロRNAとも呼ばれる。小分子RNAは、21-25塩基長の1本鎖RNA分子のことを指し、遺伝子の転写後発現調節を行う機能をもつ。
- 注5 C19MC
- Chromosome 19 microRNA clusterの略称。C19MCは、ヒト染色体19番に位置し、46 個のマイクロ RNA(小分子RNA)を含む大規模な遺伝子クラスターである。正常なヒト組織では、C19MC遺伝子は胎盤で高発現する。また、C19MC遺伝子は哺乳類に特有なゲノムインプリンティングを受ける遺伝子としても知られる。
- 注6 ナイーブ型・プライム型
- ヒトES細胞の未分化状態のこと。着床前の胎児細胞(内部細胞塊)に近い特徴を示すナイーブ型、着床後の胎児細胞に近い特徴を示すプライム型と呼んでいる。着床前から着床後の胎児細胞では、遺伝子発現の変化だけでなく、ゲノム全体のDNAメチル化レベルの上昇が明らかになっている。
- 注7 エピジェネティクス
- DNA情報を変更することなく、DNAやクロマチンへの後天的な化学修飾により遺伝子発現が制御される現象のこと。エピジェネティックな分子機構では、主にDNAメチル化、ヒストンの化学修飾などが協調して細胞内の遺伝子発現を制御している。
- 注8 DNAメチル化
- 遺伝子の発現を制御する仕組み。具体的には、細胞内では遺伝子の発現のオフの目印となるメチル基をDNAへ化学修飾することで、遺伝子の発現を低下させている。
論文題目
- English Title
- The microRNA cluster C19MC confers differentiation potential into trophoblast lineages upon human pluripotent stem cells.
- Authors
- Norio Kobayashi1, Hiroaki Okae1,*, Hitoshi Hiura2, Naoto Kubota3, Eri H Kobayashi1, Shun Shibata1, Akira Oike1, Takeshi Hori4, Chie Kikutake3, Hirotaka Hamada1, Hirokazu Kaji4, Mikita Suyama3, Marie-Line Bortolin-Cavaillé5, Jérôme Cavaillé5, Takahiro Arima1,*
- 1Department of Informative Genetics, Environment and Genome Research Center, Tohoku University Graduate School of Medicine, Sendai 980-8575, Japan
2Department of Bioscience, Faculty of Life Science, Tokyo University of Agriculture, Tokyo 156-8502, Japan
3Division of Bioinformatics, Medical Institute of Bioregulation, Kyushu University, Fukuoka 812-8582, Japan
4Department of Biomechanics, Institute of Biomaterials and Bioengineering, Tokyo Medical and Dental University, Tokyo 101-0062, Japan
5Molecular, Cellular and Developmental biology department (MCD), Centre de Biologie Intégrative (CBI), University of Toulouse, CNRS, UPS, 31062 Toulouse, France
お問い合わせ先
研究に関すること
東北大学大学院医学系研究科情報遺伝学分野
教授 有馬隆博(ありま たかひろ)
電話番号:022-717-7844
Eメール:tarima*med.tohoku.ac.jp(*を@に置き換えてください)
取材に関すること
東北大学大学院医学系研究科・医学部広報室
電話番号:022-717-8032
FAX番号:022-717-8931
Eメール:press*pr.med.tohoku.ac.jp(*を@に置き換えてください)
AMED事業に関すること
日本医療研究開発機構(AMED)
革新的先端研究開発支援事業
シーズ開発・研究基盤事業部 革新的先端研究開発課
電話番号:03-6870-2224
Eメール:kenkyuk-ask*amed.go.jp(*を@に置き換えてください)
関連リンク
掲載日 令和4年6月3日
最終更新日 令和4年6月3日


